22.9: Геометрія комплексів
- Page ID
- 24202
Геометрія комплексу майже повністю регулюється координаційним числом. Ми розглянемо тільки найпоширеніші координаційні числа, а саме 2, 4 і 6.
Номер координації = 2
Комплекси з двома лігандами незмінно лінійні. Найвідомішими прикладами таких сполук є комплекси Ag (I) і Au (I), такі як
2%25E2%2580%2593.jpg)
2%252B.jpg)
Обидва ці комплекси важливі. Au (CN) 2 — комплекс використовується для вилучення дрібних частинок золота з породи, в якій вони відбуваються. Подрібнену руду обробляють розчином КЦН і через неї продувають повітря:
\[ 4 \text{Au} (s) + 8 \text{CN}^{-} (aq) + \text{O}_{2} (g) + 2 \text{H}_{2} \text{O} (l) \rightarrow 4 \text{[Au(CN)}_{2} \text{]}^{-} (aq) + 4 \text{OH}^{-} (aq) \label{1} \]
Отриманий комплекс є водорозчинним. Комплекс срібла також розчинний у воді і дозволяє метод розчинення AgCl, який в іншому випадку дуже нерозчинний.
\[ \text{AgCl} (s) + 2 \text{NH}_{3} (aq) \rightarrow \text{[Ag(NH}_{3} \text{)}_{2} \text{]}^{+} (aq) + \text{Cl}^{-} (aq) \nonumber \]
Ця реакція часто використовується в лабораторії, щоб переконатися, що осад є AgCl (s).
42%252B_(square_planar)_and_Zn(NH3)42%252B_(tetrahedral)_.jpg)
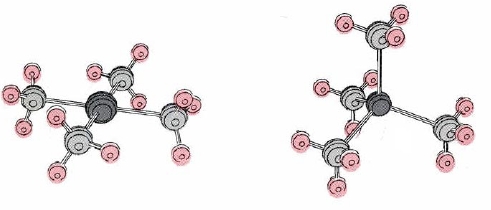
Номер координації = 4
Для цього координаційного числа можливі дві геометрії. Деякі комплекси, такі як іон [Pt (NH 3) 4] 2+, показаний на малюнку\(\PageIndex{1}\), є квадратними площинними, а інші, як Cd (NH 3) 4 2—, чотиригранні. Більшість чотирикоординованих комплексів Zn (II), Cd (II) та Hg (II) є чотиригранними, тоді як квадратному плоскому розташуванню віддають перевагу комплекси Pd (II), Pt (II) та Cu (II).
Оскільки квадратна плоска геометрія менш симетрична, ніж чотиригранна геометрія, вона пропонує більше можливостей для ізомерії. Відомий приклад такої ізомерії наводяться двома квадратними площинними комплексами.
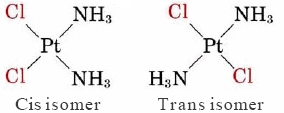2.jpg)
Ці два ізомери називаються геометричними ізомерами. Той ізомер, в якому два однакових ліганди знаходяться поруч один з одним, називається цис-ізомером, тоді як той, в якому вони знаходяться з протилежних сторін, називається транс-ізомером. Хоча ці два ізомери мають деякі властивості, які схожі, жодні властивості не ідентичні, а деякі дуже різні. Наприклад, цис-ізомер вищевказаного комплексу використовується як протипухлинний препарат для лікування ракових клітин. Транс-форма, навпаки, не проявляє подібної біологічної активності.
Варто відзначити, що цис-транс-ізомерія неможлива у випадку з тетраедричними комплексами. Як ви можете швидко переконатися, вивчивши будь-яку тривимірну чотиригранну форму, будь-який заданий кут тетраедра сусідить з іншими трьома. Оскільки всі кути перебувають між собою, жоден не є транс.
Номер координації = 6
Коли існує шість лігандів, геометрія комплексу майже завжди восьмигранна, як геометрія SF 6, або [Cr (H 2 O) 6] 3+. Всі ліганди рівновіддалені від центрального атома, а всі кути ліганд-метал-ліганд - 90°. Октаедричний комплекс також може розглядатися як похідний від квадратної площинної структури шляхом додавання п'ятого ліганда вище і шостого нижче на лінії через центральний іон металу і перпендикулярно площині.
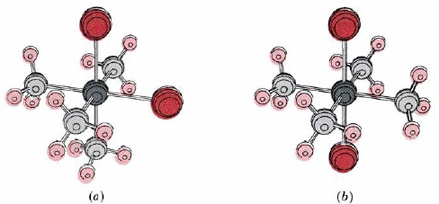4Cl2_.jpg)
Октаедрична структура також породжує геометричну ізомерію. Наприклад, дві різні сполуки, одна фіолетова і одна зелена, мають формулу [Co (NH 3) 4 Cl 2] Cl. Фіолетовий комплекс виявляється має цис-структуру і зелений транс, як показано на малюнку\(\PageIndex{2}\).
