5.2: Калориметрія
- Page ID
- 22731
- Поясніть техніку калориметрії
- Розрахувати та інтерпретувати теплові та пов'язані з ними властивості за допомогою типових даних калориметрії
Одна методика, яку ми можемо використовувати для вимірювання кількості тепла, що бере участь у хімічному або фізичному процесі, відома як калориметрія. Калориметрія використовується для вимірювання кількості тепла, що передається або від речовини. Для цього тепло обмінюється каліброваним предметом (калориметром). Зміна температури вимірювальної частини калориметра перетворюється в кількість тепла (так як попередня калібрування використовувалася для встановлення його теплоємності). Вимірювання тепловіддачі за допомогою цього підходу вимагає визначення системи (речовини або речовини, що зазнають хімічних або фізичних змін) та її оточення (інших компонентів вимірювального апарату, які служать або для забезпечення теплом системи, або поглинають тепло від системи). Знання теплоємності навколишнього середовища, а також ретельні вимірювання мас системи і оточення і їх температур до і після процесу дозволяє розрахувати теплоту, що передається, як описано в цьому розділі.
Калориметр - це пристрій, що використовується для вимірювання кількості тепла, що бере участь в хімічному або фізичному процесі. Наприклад, коли в розчині в калориметрі відбувається екзотермічна реакція, тепло, що виробляється реакцією, поглинається розчином, що підвищує його температуру. При виникненні ендотермічної реакції необхідне тепло поглинається від теплової енергії розчину, що знижує його температуру (рис.\(\PageIndex{1}\)). Зміна температури разом з питомою теплотою і масою розчину потім може бути використана для розрахунку кількості тепла, задіяного в будь-якому випадку.
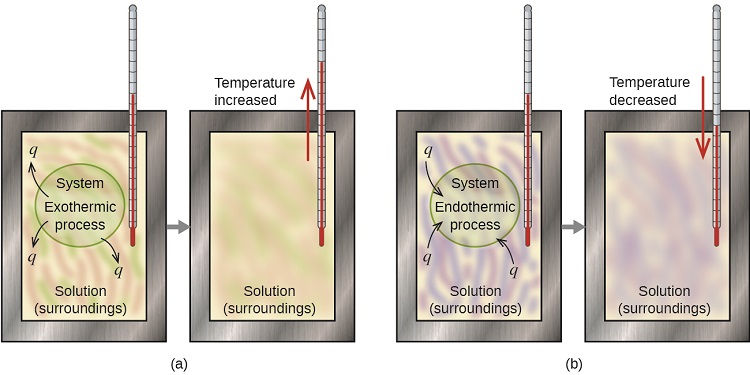
За умовністю q дається негативний (-) знак, коли система відпускає тепло в навколишнє середовище (екзотермічний); q дається позитивний (+) знак, коли система поглинає тепло з оточення (ендотермічний).
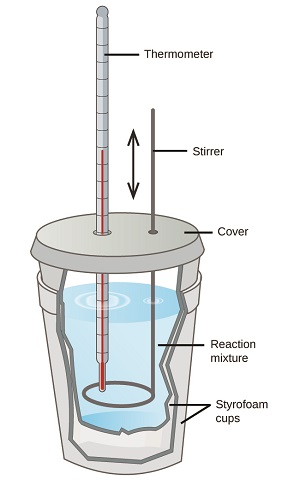
Вчені використовують добре ізольовані калориметри, які все, крім запобігання передачі тепла між калориметром і його навколишнім середовищем. Це дозволяє точно визначити теплоту, що бере участь в хімічних процесах, енергетичний вміст харчових продуктів і так далі. Студенти загальної хімії часто використовують прості калориметри, побудовані з полістирольних стаканчиків (рис.\(\PageIndex{2}\)). Ці прості у використанні калориметри «кавової чашки» дозволяють більше теплообмінюватися зі своїм оточенням, а отже, виробляти менш точні енергетичні значення.
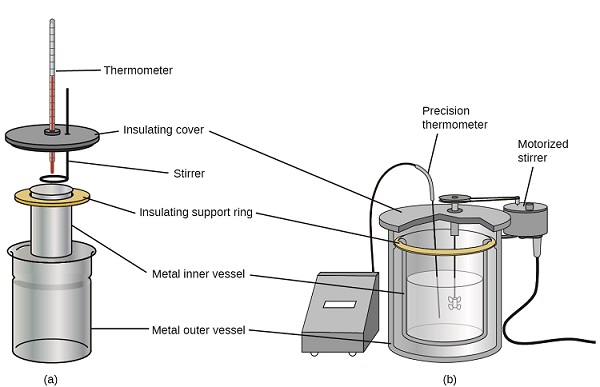
Також доступні калориметри комерційного розчину. Щодо недорогі калориметри часто складаються з двох тонкостінних чашок, які вкладені таким чином, що мінімізує тепловий контакт під час використання, разом із ізольованою кришкою, ручною мішалкою та простим термометром. Більш дорогі калориметри, що використовуються для промисловості та досліджень, зазвичай мають добре ізольований, повністю закритий реакційний посудину, моторизований механізм перемішування та більш точний датчик температури (рис.\(\PageIndex{3}\)).
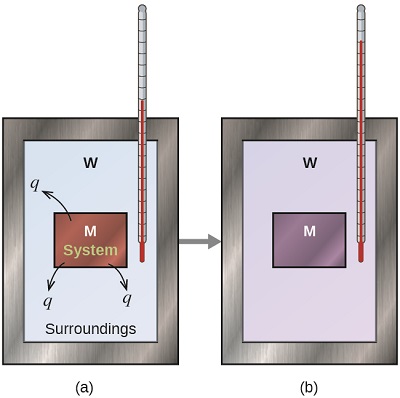
Перш ніж ми практикуємо проблеми калориметрії, пов'язані з хімічними реакціями, розглянемо простий приклад, який ілюструє основну ідею калориметрії. Припустимо, у нас спочатку є високотемпературна речовина, наприклад гарячий шматок металу (М), і низькотемпературне речовина, наприклад прохолодна вода (W). Якщо ми помістимо метал у воду, тепло буде надходити від М до Вт. Температура М зменшиться, а температура W буде збільшуватися, поки дві речовини не матимуть однакову температуру - тобто, коли вони досягнуть теплової рівноваги (рис.\(\PageIndex{4}\)). Якщо це відбувається в калориметрі, в ідеалі вся ця теплопередача відбувається між двома речовинами, без тепла, отриманого або втраченого ні калориметром, ні оточенням калориметра. За цих ідеальних обставин чиста зміна тепла дорівнює нулю:
\[q_\mathrm{\,substance\: M} + q_\mathrm{\,substance\: W}=0 \label{5.3.1} \]
Це співвідношення можна переставити, щоб показати, що тепло, отримане речовиною М, дорівнює теплоті, втраченому речовиною W:
\[q_\mathrm{\,substance\: M}=-q_\mathrm{\,substance\: W} \label{5.3.2} \]
Величина тепла (зміна), отже, однакова для обох речовин, і негативний знак лише показує, що\(q_{substance\, M}\) і\(q_{substance\, W}\) протилежні у напрямку теплового потоку (посилення або втрати), але не вказує на арифметичний знак будь-якого значення q (що визначається тим, чи є матерія, про яку йде мова, отримує або втрачає тепло, за визначенням). У конкретній описаній ситуації,\(q_{substance\, M}\) є негативним значенням і\(q_{substance\, W}\) є позитивним, так як тепло передається від М до Вт.
Гарячий 360-г шматок арматури (сталевий стрижень, який використовується для армування бетону) опускають у 425 мл води при 24,0 °С, кінцеву температуру води вимірюють як 42,7 °С. Розрахуйте початкову температуру шматка арматури. Припустимо, питома теплоємність стали приблизно така ж, як і для заліза (табл. Т4), і що вся тепловіддача відбувається між арматурою і водою (немає теплообміну з оточенням).
Рішення
Температура води збільшується від 24,0° C до 42,7° C, тому вода поглинає тепло. Це тепло надходило від шматка арматури, який спочатку був при більш високій температурі. Припускаючи, що вся тепловіддача була між арматурою і водою, без тепла «втрачається» в навколишнє середовище, то тепло, що віддається арматурою = − тепло, що приймається водою, або:
\[q_\ce{rebar}=−q_\ce{water} \nonumber \]
Оскільки ми знаємо, як тепло пов'язане з іншими вимірними величинами, ми маємо:
\[(c×m×ΔT)_\ce{rebar}=−(c×m×ΔT)_\ce{water} \nonumber \]
Допускаючи f = остаточний і i = початковий, в розгорнутому вигляді, це стає:
\[ c_\ce{rebar}×m_\ce{rebar}×(T_\mathrm{f,rebar}−T_\mathrm{i,rebar})=−c_\ce{water}×m_\ce{water}×(T_\mathrm{f,water}−T_\mathrm{i,water}) \nonumber \]
Щільність води становить 1,0 г/мл, тому 425 мл води = 425 м Відзначивши, що кінцева температура як арматури, так і води 42,7° C, заміщення відомих значень дає:
\[ \mathrm{(0.449\:J/g\: °C)(360g)(42.7°C−\mathit T_\mathrm{i,rebar})=-(4.184\:J/g\: °C)(425\:g)(42.7°C−24.0°C)} \nonumber \]
\[\mathrm{\mathit T_{i,rebar}=\dfrac{(4.184\:J/g\: °C)(425\:g)(42.7°C−24.0°C)}{(0.449\:J/g\: °C)(360\:g)}+42.7°C} \nonumber \]
Рішення цього дає Ti, арматура = 248° C, тому початкова температура арматури становила 248° C.
248-грамовий шматок міді опускають в 390 мл води при 22,6 °С, кінцеву температуру води вимірювали як 39,9° С. Обчислити початкову температуру шматка міді. Припустимо, що вся тепловіддача відбувається між міддю і водою.
- Відповідь
-
Початкова температура міді склала 335,6 °С.
248-г шматок міді спочатку при 314° C скидається в 390 мл води спочатку при 22,6° C Припускаючи, що вся тепловіддача відбувається між міддю і водою, обчислити кінцеву температуру.
- Відповідь
-
Кінцева температура (досягається як міддю, так і водою) становить 38,7° C.
Цей метод також може бути використаний для визначення інших величин, таких як питома теплоємність невідомого металу.
Металевий шматок 59,7 г, який був занурений у киплячу воду, швидко перенесли в 60,0 мл води спочатку при 22,0 °С. Кінцева температура 28,5° С. За допомогою цих даних можна визначити питому теплоємність металу. Використовуйте цей результат для ідентифікації металу.
Рішення
Припускаючи ідеальну тепловіддачу, тепло, що виділяється металом = −тепло, що приймається водою, або:
\[q_\ce{metal}=−q_\ce{water} \nonumber \]
У розгорнутому вигляді це:
\[c_\ce{metal}×m_\ce{metal}×(T_\mathrm{f,metal}−T_\mathrm{i, metal})=−c_\ce{water}×m_\ce{water}×(T_\mathrm{f,water}−T_\mathrm{i,water}) \nonumber \]
Відзначивши, що оскільки метал був занурений у киплячу воду, його початкова температура становила 100,0° C; а для води 60,0 мл = 60,0 г; ми маємо:
\[\mathrm{(\mathit c_{metal})(59.7\:g)(28.5°C−100.0°C)=−(4.18\:J/g\: °C)(60.0\:g)(28.5°C−22.0°C)} \nonumber \]
Рішення цього:
\[\mathrm{\mathit c_{metal}=\dfrac{−(4.184\:J/g\: °C)(60.0\:g)(6.5°C)}{(59.7\:g)(−71.5°C)}=0.38\:J/g\: °C} \nonumber \]
Порівнюючи це зі значеннями в таблиці Т4, наша експериментальна питома теплота найближча до значення для міді (0,39 Дж/г° C), тому ми ідентифікуємо метал як мідь.
92,9-г шматок сріблястого/сірого металу нагрівають до 178,0° C, а потім швидко переносять у 75,0 мл води спочатку при 24,0° C Через 5 хвилин і метал, і вода досягли однакової температури: 29,7° C Визначте питому теплоту і ідентичність металу. (Примітка: Ви повинні виявити, що питома теплоємність близька до температури двох різних металів. Поясніть, як можна впевнено визначити ідентичність металу).
- Відповідь
-
\(c_{metal}= 0.13 \;J/g\; °C\)
Ця питома теплота близька до тепла або золота, або свинцю. Важко було б визначити, який саме метал це грунтувався виключно на числових значеннях. Однак спостереження, що метал сріблястий/сірий на додаток до значення питомої теплоти вказує на те, що метал є свинцевим.
Коли ми використовуємо калориметрію для визначення тепла, що бере участь в хімічній реакції, застосовуються ті ж принципи, які ми обговорювали. Кількість тепла, що поглинається калориметром, часто досить мала, щоб ми могли нехтувати ним (хоча і не для високоточних вимірювань, як обговорювалося далі), а калориметр мінімізує енергообмін з навколишнім середовищем. Оскільки енергія не створюється і не руйнується під час хімічної реакції, загальна зміна енергії під час реакції не відбувається. Тепло, вироблене або споживане в реакції («система»), q реакція плюс тепло, поглинене або втрачене розчином («оточення»)\(q_{solution}\), повинні складати до нуля:
\[q_\ce{reaction}+q_\ce{solution}=0\ \label{ 5.3.10} \]
Це означає, що кількість тепла, виробленого або спожитого в реакції, дорівнює кількості тепла, поглиненого або втраченого розчином:
\[q_\ce{reaction}=−q_\ce{solution} \label{5.3.11} \]
Це поняття лежить в основі всіх проблем калориметрії і розрахунків.
Коли до калориметра кавової чашки додають 50,0 мл 0,10 М HCl (aq) і 50,0 мл 1,00 М NaOH (aq), обидві при 22,0° C, температура суміші досягає максимуму 28,9 °С.
\[\ce{HCl}(aq)+\ce{NaOH}(aq)⟶\ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
S рішення
Щоб візуалізувати, що відбувається, уявіть, що ви могли б об'єднати два рішення так швидко, що ніякої реакції не відбулося під час їх змішування; потім після змішування відбулася реакція. У момент змішування у вас є 100,0 мл суміші HCl і NaOH при 22,0° C, а потім HCl і NaOH реагують до тих пір, поки температура розчину не досягне 28,9° C.
Тепло, що виділяється реакцією, дорівнює тому, що приймається розчином. Тому:
\[q_\ce{reaction}=−q_\ce{solution} \nonumber \]
(Важливо пам'ятати, що цей зв'язок тримається лише в тому випадку, якщо калориметр не поглинає жодного тепла від реакції, і немає теплообміну між калориметром і його оточенням.)
Далі ми знаємо, що тепло, поглинене розчином, залежить від його питомої теплоти, маси і зміни температури:
\[q_\ce{solution}=(c×m×ΔT)_\ce{solution} \nonumber \]
Щоб приступити до цього розрахунку, нам потрібно зробити ще кілька розумних припущень або наближень. Оскільки розчин водний, ми можемо діяти так, ніби це вода з точки зору його питомих значень теплоти і маси. Щільність води становить приблизно 1,0 г/мл, тому 100,0 мл має масу близько 1,0 × 10 2 г (дві значущі цифри). Питома теплоємність води становить приблизно 4,18 Дж/г° C, тому ми використовуємо її для питомої теплоти розчину. Підстановка цих значень дає:
\[\mathrm{\mathit q_{solution}=(4.184\:J/g\: °C)(1.0×10^2\:g)(28.9°C−22.0°C)=2.89×10^3\:J} \nonumber \]
Нарешті, оскільки ми намагаємося знайти тепло реакції, ми маємо:
\[q_\ce{reaction}=−q_\ce{solution}=−2.89×10^3\:J \nonumber \]
Негативний знак говорить про те, що реакція екзотермічна. Він виробляє 2,89 кДж тепла.
Коли 100 мл 0,200 М NaCl (aq) і 100 мл 0,200 M AgNO 3 (aq) змішуються в калориметрі кавової чашки, температура збільшується до 23,5° C у твердих формах AgCl. Скільки тепла виробляється цією реакцією опадів? Які припущення ви зробили, щоб визначити свою цінність?
- Відповідь
-
\(1.34 \times 10^3\; J\); припустимо, що теплота не поглинається калориметром, тепло не обмінюється між калориметром та його оточенням, і що питома теплота та маса розчину такі ж, як і для води
Працюючи або граючи на свіжому повітрі в холодний день, ви можете використовувати грілку для рук, щоб зігріти руки (рис.\(\PageIndex{5}\)). Звичайна багаторазова грілка для рук містить перенасичений розчин NaC 2 H 3 O 2 (ацетат натрію) і металевий диск. Згинання диска створює ділянки зародження, навколо яких швидко кристалізується метастабільний NaC 2 H 3 O 2 (більш пізня глава про розчини буде досліджувати насичення і перенасичення більш детально).
Процес\(\ce{NaC2H3O2}(aq)⟶\ce{NaC2H3O2}(s)\) екзотермічний, і тепло, що виробляється цим процесом, поглинається вашими руками, тим самим зігріваючи їх (хоча б на час). Якщо грілка для рук розігрівається повторно, NaC 2 H 3 O 2 розчиняється і може бути використаний повторно.

Ще одна поширена грілка для рук виробляє тепло, коли вона розривається, піддаючи залізо і воду в руці тепліше кисню в повітрі. Одним із спрощених варіантів цієї екзотермічної реакції є
\[\ce{2Fe(s) + 3/2 O2(g) ⟶ Fe2O3(s)}.\ n\nonumber \]
Сіль у грілці для рук каталізує реакцію, тому вона швидше виробляє тепло; целюлоза, вермикуліт та активоване вугілля допомагають рівномірно розподіляти тепло. Інші типи грілок для рук використовують більш легку рідину (платиновий каталізатор допомагає легше рідини окислюватися екзотермічно), деревне вугілля (вугілля окислюється в спеціальному випадку) або електричні блоки, які виробляють тепло, пропускаючи електричний струм від акумулятора через резистивні дроти.
Коли тверда аміачна селітра розчиняється у воді, розчин стає холодним. Це основа для «моментального пакета з льодом» (рис.\(\PageIndex{5}\)). Коли 3,21 г твердого NH 4 NO 3 розчиняється в 50,0 г води при 24,9 °С в калориметрі, температура знижується до 20,3 °С.
Обчисліть значення q для цієї реакції і поясніть значення її арифметичного знака. Викладіть будь-які припущення, які ви зробили.

Рішення
Припускаємо, що калориметр перешкоджає теплопередачі між розчином і його зовнішнім середовищем (включаючи сам калориметр), в цьому випадку:
\[q_\ce{rxn}=−q_\ce{soln} \nonumber \]
з «rxn» та «soln», що використовуються як скорочення для «реакція» та «рішення» відповідно.
Припускаючи також, що питома теплоємність розчину така ж, як і для води, маємо:
\[\begin{align*} q_\ce{rxn} &=−q_\ce{soln}=−(c×m×ΔT)_\ce{soln}\\ &=\mathrm{−[(4.184J/g\: °C)×(53.2\:g)×(20.3°C−24.9°C)]}\\ &=\mathrm{−[(4.184J/g\: °C)×(53.2\:g)×(−4.6°C)]}\\ &+\mathrm{1.0×10^3\:J=+1.0\:kJ} \end{align*}\]
Позитивний знак для q вказує на те, що розчинення є ендотермічним процесом.
Коли 3,00-г зразка KCl було додано до 3,00 × 10 2 г води в калориметрі кавової чашки, температура знизилася на 1,05° C. скільки тепла бере участь у розчиненні KCl? Які припущення ви зробили?
- Відповідь
-
1,33 кДж; припустимо, що калориметр перешкоджає теплопередачі між розчином і його зовнішнім середовищем (включаючи сам калориметр) і що питома теплоємність розчину така ж, як і для води.
Якщо кількість тепла, поглиненого калориметром, занадто велике, щоб знехтувати або якщо ми потребуємо більш точних результатів, то ми повинні враховувати тепло, поглинене як розчином, так і калориметром.
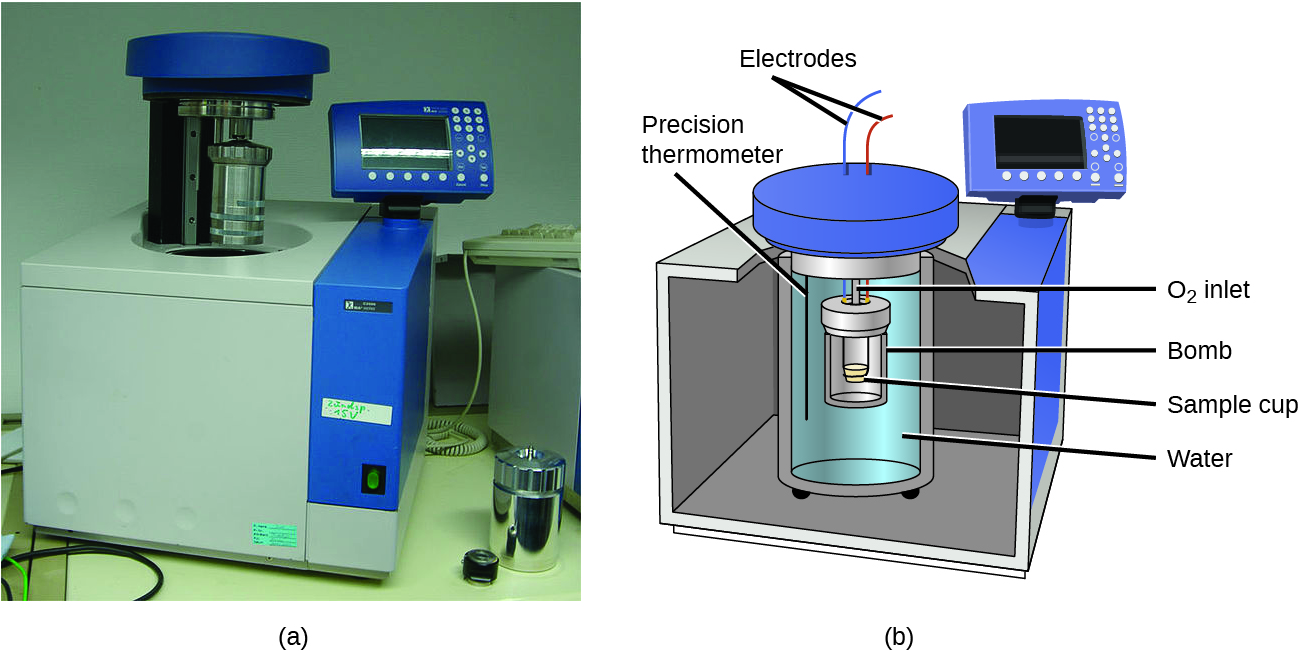
Описані калориметри призначені для роботи при постійному (атмосферному) тиску і зручні для вимірювання теплового потоку, що супроводжують процеси, що відбуваються в розчині. Інший тип калориметра, який працює в постійному обсязі, розмовно відомий як калориметр бомби, використовується для вимірювання енергії, виробленої реакціями, які дають велику кількість тепла і газоподібних продуктів, таких як реакції горіння. (Термін «бомба» походить від спостереження, що ці реакції можуть бути досить енергійними, щоб нагадувати вибухи, які можуть пошкодити інші калориметри.) Цей тип калориметра складається з міцного сталевого контейнера («бомба»), який містить реагенти і сам занурений у воду (рис.\(\PageIndex{6}\)). Зразок поміщається в бомбу, яка потім заповнюється киснем під високим тиском. Для розпалювання зразка використовується невелика електрична іскра. Енергія, вироблена реакцією, потрапляє в пастку сталевої бомби та навколишньої води. Збільшення температури вимірюється і поряд з відомою теплоємністю калориметра використовується для розрахунку енергії, виробленої реакцією. Калориметри бомби вимагають калібрування для визначення теплоємності калориметра і забезпечення точних результатів. Калібрування здійснюється за допомогою реакції з відомим q, таким як виміряна кількість бензойної кислоти, запаленої іскрою з дроту нікелевого запобіжника, який зважується до і після реакції. Зміна температури, вироблене відомою реакцією, використовується для визначення теплоємності калориметра. Калібрування, як правило, проводиться кожного разу, перш ніж калориметр використовується для збору даних досліджень.
Відео\(\PageIndex{1}\): Відео перегляду, як бомбовий калориметр готується до дії.
Коли 3,12 г глюкози, C 6 H 12 O 6, спалюється в бомбовому калориметрі, температура калориметра збільшується з 23,8 °С до 35,6 °С. Калориметр містить 775 г води, а сама бомба має теплоємність 893 Дж/°С. Скільки тепла виробляла спалювання зразка глюкози?
Рішення
При згорянні виробляється тепло, яке в першу чергу поглинається водою і бомбою. (Кількість тепла, поглиненого продуктами реакції, і нереагував надлишок кисню відносно малі, і робота з ними виходить за рамки цього тексту. Ми будемо нехтувати ними в наших розрахунках.)
Тепло, вироблене реакцією, поглинається водою і бомбою:
\ [\ почати {вирівнювати*}
&q_\ ce {rxn} =− (q_\ ce {вода} +q_\ ce {бомба})\\
&=\ mathrm {− [(4.184\ :Дж/г\:° C) × (775\ ::г) × (35,6° C−23,8° C) +893\ :J/C × (35,6° C - 23,8° C) +893\ :J/C × (35,6° C - 23,8° C) 8°C)]}\\
&=\ матрм {− (38,300\ :М+10,500\ :J)}\\
&=\ матрм {−48,800\: J = −48.8\: кДж}
\ кінець { вирівнювати*}\ nonumber\]
Ця реакція виділяла 48,7 кДж тепла при спалюванні 3,12 г глюкози.
Коли в калориметрі бомби спалюється 0,963 г бензолу, С 6 Н 6, температура калориметра збільшується на 8,39 °С, теплоємність якої становить 784 Дж/°С і занурюється в 925 мл води. Скільки тепла було вироблено при згорянні зразка глюкози?
Відповідь-
39,0 кДж
З моменту побудови першого в 1899 році для вимірювання тепла, виробленого живою людиною, побудовано 35 калориметрів. 1 Ці калориметри всього тіла різної конструкції досить великі, щоб вмістити окрему людину. Зовсім недавно цільнокімнатні калориметри дозволяють виконувати відносно нормальну діяльність, і ці калориметри генерують дані, які більш точно відображають реальний світ. Ці калориметри використовуються для вимірювання метаболізму людей в різних умовах навколишнього середовища, різних режимах харчування та з різними умовами здоров'я, такими як діабет. У людини метаболізм зазвичай вимірюється в калоріях на день. Харчова калорія (Калорійність) - одиниця енергії, яка використовується для кількісної оцінки кількості енергії, отриманої в результаті метаболізму продуктів; одна Калорія дорівнює 1000 калорій (1 ккал), кількість енергії, необхідної для нагрівання 1 кг води на 1° C.
У вашому повсякденному житті ви можете бути більш знайомі з енергією, яка надається в Калорії, або поживні калорії, які використовуються для кількісної оцінки кількості енергії в продуктах харчування. Одна калорія (кал) = рівно 4,184 джоуля, а одна Калорія (зверніть увагу на капіталізацію) = 1000 кал, або 1 ккал. (Це приблизно кількість енергії, необхідної для нагрівання 1 кг води на 1° C.)
Макроелементами в їжі є білки, вуглеводи, а також жири або олії. Білки забезпечують близько 4 калорій на грам, вуглеводи також забезпечують близько 4 калорій на грам, а жири і масла забезпечують близько 9 калорій/г. харчові етикетки на харчових упаковках показують калорійність однієї порції їжі, а також розбивку на Калорії з кожного з трьох макроелементів ( Малюнок\(\PageIndex{7}\)).

Для прикладу, показаного в (b), загальна енергія на порцію 228-г розраховується за допомогою:
\[\mathrm{(5\:g\: protein×4\:Calories/g)+(31\:g\: carb×4\:Calories/g)+(12\:g\: fat×9\:Calories/g)=252\:Calories} \label{5.3.X} \]
Таким чином, ви можете використовувати етикетки їжі для підрахунку калорій. Але звідки беруться цінності? І наскільки вони точні? Калорійність продуктів можна визначити за допомогою бомбової калориметрії; тобто шляхом спалювання їжі та вимірювання енергії, яку вона містить. Зразок їжі зважують, змішують в блендері, сушать ліофілізацією, подрібнюють в порошок і формують в гранулу. Гранула спалюється всередині калориметра бомби, а виміряна зміна температури перетворюється в енергію на грам їжі.
Сьогодні калорійність на етикетках харчових продуктів виводиться за допомогою методу, який називається системою Atwater, який використовує середню калорійність різних хімічних складових їжі, білків, вуглеводів та жирів. Середні суми - це ті, що наведені в рівнянні, і походять від різних результатів, отриманих бомбою калориметрії цільних продуктів. Кількість вуглеводів знижується на певну кількість для вмісту клітковини, яка є неперетравлюваним вуглеводом. Щоб визначити енергетичний вміст їжі, кількість вуглеводів, білків та жиру помножується на середню кількість калорій на грам для кожного та продуктів, підсумованих для отримання загальної енергії.
Резюме
Калориметрія використовується для вимірювання кількості теплової енергії, що передається в хімічному або фізичному процесі. Це вимагає ретельного вимірювання зміни температури, що відбувається в процесі і мас системи і оточення. Ці виміряні величини потім використовуються для обчислення кількості тепла, виробленого або спожитого в процесі, використовуючи відомі математичні відносини. Калориметри призначені для мінімізації енергообміну між досліджуваної системою і її оточенням. Вони варіюються від простих калориметрів кавових чашок, що використовуються вступними студентами хімії до складних калориметрів бомби, що використовуються для визначення енергетичного вмісту їжі.
Виноски
- 1 Френсіс Д. Рірдон та ін. «Людський калориметр Snellen переглянув, перероблений та модернізований: Дизайн та експлуатаційні характеристики». Медична та біологічна інженерія та обчислювальна техніка 8 (2006) 721—28, людський калориметр Snellen переглянуто, перероблено та модернізовано: дизайн та експлуатаційні характеристики [link.springer.com].
Глосарій
- бомба калориметр
- прилад, призначений для вимірювання зміни енергії для процесів, що відбуваються в умовах постійного об'єму; зазвичай використовується для реакцій із залученням твердих і газоподібних реагентів або продуктів
- калориметр
- пристрій, що використовується для вимірювання кількості тепла, поглиненого або виділеного в хімічному або фізичному процесі
- калориметрія
- процес вимірювання кількості тепла, що беруть участь в хімічному або фізичному процесі
- харчова калорійність (калорійність)
- одиниця, яка використовується для кількісного визначення енергії, що забезпечується перетравленням продуктів, визначається як 1000 кал або 1 ккал
- околицях
- всі питання, крім досліджуваної системи
- системи
- частина речовини, що зазнають хімічної або фізичної зміни вивчається
