14.6: Застосування термохімії
- Page ID
- 19031
Практично всі хімічні процеси припускають поглинання або виділення тепла, а значить і зміни внутрішньої енергії системи. У цьому розділі ми розглядаємо деякі з найбільш поширених застосувань ентальпії та першого закону, пов'язаних з хімією. Хоча перші два розділи стосуються головним чином хімії, решта впливають на повсякденне життя кожного.
Діаграми ентальпії та їх використання
Порівняння та інтерпретація змін ентальпії матеріально сприяє графічна конструкція, в якій відносні ентальпії різних речовин представлені горизонтальними лініями у вертикальній енергетичній шкалі. Нуль шкали можна розмістити де завгодно, оскільки енергії завжди довільні; як правило, найкориснішим є розташування елементів при нульовій енергії, що відображає умовність про те, що їх стандартні ентлапії утворення дорівнюють нулю.
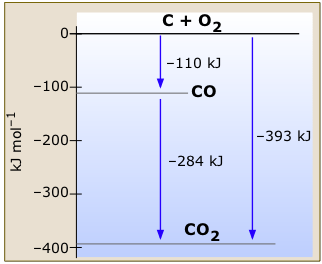
Ця дуже проста діаграма ентальпії вуглецю та кисню та двох його стабільних оксидів (рис.\(\PageIndex{1}\)) показує зміни ентальпії, пов'язані з різними реакціями, які може зазнати ця система. Зверніть увагу, як закон Гесса неявний на цій діаграмі; ми можемо обчислити зміну ентальпії для згоряння окису вуглецю до вуглекислого газу, наприклад, шляхом віднімання відповідних довжин стрілок, не виписуючи термохімічні рівняння формальним способом.
Опорні стани нульової ентальпії стосуються графіту, найбільш стабільної форми вуглецю та газоподібного кисню. Всі температури становлять 298 К.
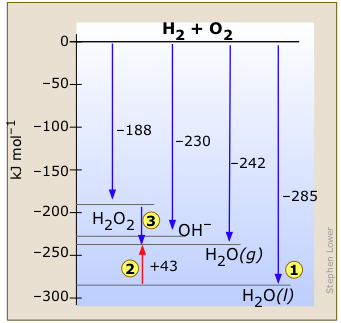
Ця ентальпійна діаграма для системи водень - кисень (рис.\(\PageIndex{2}\)) показує відомі стабільні конфігурації цих двох елементів. Реакція газоподібних Н 2 і О 2 на вихід одного моля рідкої води виділяє 285 кДж тепла . Якщо Н 2 О утворюється в газоподібному стані, виділення енергії буде менше. Зауважте також, що...
. Якщо Н 2 О утворюється в газоподібному стані, виділення енергії буде менше. Зауважте також, що...
- Теплота випаровування води
 (ендотермічний процес) наочно знаходиться по схемі.
(ендотермічний процес) наочно знаходиться по схемі. - Перекис водню Н 2 О 2, яка мимовільно розкладається на О 2 і Н 2 О, виділяє
 в цьому процесі деяку кількість тепла. Зазвичай ця реакція настільки повільна, що спека не помічається. Але використання відповідного каталізатора може зробити реакцію настільки швидкою, що вона була використана для палива гоночного автомобіля.
в цьому процесі деяку кількість тепла. Зазвичай ця реакція настільки повільна, що спека не помічається. Але використання відповідного каталізатора може зробити реакцію настільки швидкою, що вона була використана для палива гоночного автомобіля.
Чому не можна керувати автомобілем по воді
Можливо, ви чули поважну міську легенду, ймовірно, вже більше 80 років, що якийсь незрозумілий винахідник виявив процес для цього, але винахід був таємно скуплений нафтовими компаніями, щоб зберегти свою монополію. Діаграма ентальпії системи водень-кисень показує, чому це не може бути правдою - просто немає відомої сполуки H і O, яка знаходиться на нижчому рівні ентальпії.
Діаграми ентальпії особливо корисні для порівняння груп речовин, що мають певну загальну рису. На цьому показані молярні ентальпії видів, що відносяться до двох галогенідів водню, стосовно елементів. З цієї діаграми ми бачимо з першого погляду, що утворення HF з елементів значно екзотермічніше, ніж відповідне утворення HCl. У верхній частині цієї діаграми показані газоподібні атоми при позитивних ентальпіях по відношенню до елементів. Також показано, що ендотермічні процеси, в яких Н 2 і дигалоген дисоціюються на атоми, можна уявити як протікають у два етапи. Зі зміни ентальпії, пов'язаної з дисоціацією Н 2 (218 кДж моль —1), дисоціаційні ентальпії F 2 і Cl 2 можуть бути розраховані і розміщені на діаграмі.
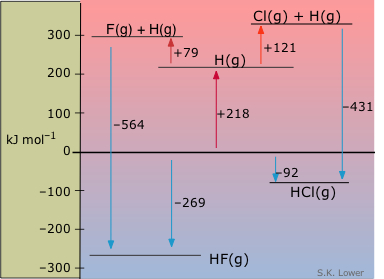
Ентальпії облігацій проти енергій облігацій
Зміна ентальпії, пов'язана з реакцією
\[\ce{HI(g) → H(g) + I(g)}\]
це ентальпія дисоціації\(\ce{HI}\) молекули; це також енергія зв'язку зв'язку воднево-йодового зв'язку в цій молекулі. За звичайних стандартних умов це виражається або як ентальпія зв'язку H° (HI,298K), або внутрішня енергія U° (HI, 298); в цьому випадку дві величини відрізняються один від одного на Δ PV = RT. Оскільки ця реакція не може бути вивчена безпосередньо, ентальпія зв'язку H—I розраховується з відповідних стандартних ентальпій освіти:
| ½ Н 2 (г) → Н (г) | + 218 кДж |
| ½ I 2 (г) → I (г) | +107 кДж |
| ½ Н 2 (г) + 1/2 I 2 (г) → HI (г) | -36 кДж |
| HI (г) → Н (г) + I (г) | +29 кДж |
Енергії зв'язку та ентальпії є важливими властивостями хімічних зв'язків, і дуже важливо вміти оцінювати їх значення за іншими термохімічними даними. Загальна ентальпія зв'язку більш складної молекули, такої як етан, можна знайти з наступної комбінації реакцій:
| С 2 Н 6 (г) → 2С (графіт) + 3 Н 2 (г) | 84,7 кДж |
| 3 Н 2 (г) → 6 Н (г) | 1308 кДж |
| 2 С (графіт) → 2 С (г) | 1430 кДж |
| С 2 Н 6 (г) → 2 С (г) + 6Н (г) | 2823 кДж |
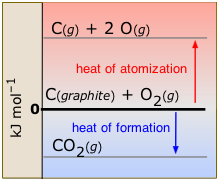
Коли молекула в звичайному стані розпадається на газоподібні атоми, процес відомий як атомізація (рис.\(\PageIndex{4}\)). Стандартна ентальпія атомізації відноситься до перетворення елемента в газоподібні атоми:
\[\ce{ C_{(graphite)} → C(g)} \;\;\;\; ΔH^o = 716.7\; kJ\]
Атомізація - це завжди ендотермічний процес. Тепла розпилення найчастіше використовуються для розрахунку енергій зв'язку. Їх зазвичай вимірюють спектроскопічно.
Правило Паулінга та середня енергія облігацій
Правило Полінга
Загальна енергія зв'язку молекули можна розглядати як суму енергій окремих зв'язків.
Правило Паулінга - це лише наближення, оскільки енергія даного типу зв'язку насправді не є постійною, а дещо залежить від конкретного хімічного середовища двох атомів. Іншими словами, все, про що ми можемо реально говорити, - це середня енергія певного виду зв'язку, наприклад, C—O, наприклад, середня береться за репрезентативний зразок сполук, що містять цей тип зв'язку, таких як CO, CO 2, CoCl 2, (CH 3) 2 CO, CH 3 СООН та ін.
Незважаючи на відсутність суворої адитивності енергій зв'язку, Правило Паулінга надзвичайно корисно, оскільки дозволяє оцінити теплоти утворення сполук, які не вивчалися або навіть не були підготовлені. Таким чином, у наведеному вище прикладі, якщо ми знаємо ентальпії зв'язків C - C і C—H з інших даних, ми могли б оцінити загальну ентальпію зв'язку етану, а потім працювати назад, щоб отримати деяку іншу кількість інтересу, наприклад ентальпія етану утворення. Зібравши велику кількість експериментальної інформації такого роду, можна отримати послідовний набір середніх енергій зв'язку. Енергії подвійних зв'язків більше, ніж у одиночних зв'язків, а енергії потрійних зв'язків все ще вище (табл.\(\PageIndex{1}\)).
| Ч | C | П | O | F | Cl | Br | Я | СІ | |
|---|---|---|---|---|---|---|---|---|---|
| Ч | 436 | 415 | 390 | 464 | 569 | 432 | 370 | 295 | 395 |
| C | 345 | 290 | 350 | 439 | 330 | 275 | 240 | 360 | |
| П | 160 | 200 | 270 | 200 | 270 | ||||
| O | 140 | 185 | 205 | 185 | 200 | 370 | |||
| F | 160 | 255 | 160 | 280 | 540 | ||||
| Cl | 243 | 220 | 210 | 359 | |||||
| Br | 190 | 180 | 290 | ||||||
| Я | 150 | 210 | |||||||
| СІ | 230 |
Енергетичний вміст палив
Паливо - це будь-яка речовина, здатна забезпечити корисну кількість енергії через процес, який може здійснюватися контрольованим способом за економічними витратами. Для більшості практичних видів палива процес згоряння на повітрі (при якому окислювач О 2 доступний за нульовою вартістю). Ентальпія згоряння, очевидно, є важливим критерієм придатності речовини як палива, але вона не є єдиною; корисне паливо також має легко запалюватися, а у випадку палива, призначеного для автомобілів, що працюють на власному двигуні, його енергетична щільність в перерахунку на обидві маси (кДж кг). —1) і об'єм (кДж м —3) повинні бути досить великими. Таким чином, такі речовини, як метан і пропан, які є газами при 1 атм, повинні зберігатися як рідини під тиском для транспортування та портативних застосувань.
|
|
|
|---|---|
| деревина (суха) | 15 |
| вугілля (бідний) | 15 |
| вугілля (преміум) | 27 |
| етанол а | 30 |
| продукти, отримані з нафти | 45 |
| метан, скраплений природний газ | 54 |
| водень б | 140 |
Примітки до наведеної вище таблиці
Етанол активно пропагується як моторне паливо сільськогосподарською промисловістю США. Відзначимо, однак, що за деякими оцінками, для отримання 1 кг етанолу з кукурудзи потрібно 46 МДж енергії. Деякі інші аналізи, які враховують оптимальні методи ведення сільського господарства та використання побічних продуктів, приходять до різних висновків; див., наприклад, це резюме з посиланнями на кілька звітів.
b Завдяки своїй низькій молярній масі та високій теплоті згоряння водень має надзвичайно високу щільність енергії і був би ідеальним паливом, якби його критична температура (33 К, температура вище якої він не може існувати як рідина) була не такою низькою. Потенційні переваги використання водню в якості палива мотивували багато досліджень інших методів отримання великої кількості Н 2 в малий обсяг простору. Просте стиснення газу до дуже високого тиску не є практичним, оскільки вага важкостінного сталевого судна, необхідного для витримки тиску, збільшить ефективну вагу палива до неприпустимо великого значення. Одна схема, яка показала деякі обіцянки, експлуатує здатність Н 2 «розчинятися» в певних перехідних металах. Водень може бути відновлений з отриманого твердого розчину (фактично нещільно пов'язаного з'єднання) шляхом нагрівання.
Енергетичний вміст харчових продуктів
Що саме мається на увазі під твердженням, що конкретна їжа «містить 1200 калорій» на порцію? Це просто відноситься до стандартної ентальпії згоряння харчових продуктів, як вимірюється в калориметрі бомби. Зверніть увагу, однак, що в харчовому вживанні калорія дійсно кілокалорія (іноді її називають «великою калорією»), тобто 4184 Дж. Хоча ця одиниця все ще використовується в популярній літературі, одиниця СІ зараз широко використовується в науковій та клінічній літературі, в якій вміст енергії продукти зазвичай котируються в кДж на одиницю ваги.
Хоча механізми окислення такого вуглеводу, як глюкоза, до вуглекислого газу і води в калориметрі бомби і в організмі складні і абсолютно різні, чиста реакція включає однакові початкові і кінцеві стани, і повинна бути однаковою для будь-якого можливого шляху:
\[C_6H_{12}O_6 + 6 O_2 → 6 CO_2 + 6 H_2O \;\;\;\; ΔH^o = – 20.8\; kJ \;mol^{–1}\]
Глюкоза - це цукор, продукт розпаду крохмалю і є найважливішим джерелом енергії на клітинному рівні; жири, білки та інші цукри легко перетворюються в глюкозу. Записуючи збалансовані рівняння для спалювання цукрів, жирів і білків, можна зробити порівняння їх відносного енергетичного вмісту. Стехіометрія кожної реакції дає кількість кисню, що приймається і виділяється, коли окислюється задана кількість кожного виду їжі; ці обсяги газу часто приймаються як непрямі заходи споживання енергії та метаболічної активності; загальноприйняте значення, яке, здається, застосовується до різних джерел їжі становить 20,1 Дж (4,8 ккал) на літр споживаного O 2.
Для деяких компонентів їжі, зокрема білків, окислення не завжди може бути повним в організмі, тому енергія, яка насправді доступна, буде меншою, ніж та, що дається теплотою згоряння. Наприклад, ссавці взагалі не в змозі розщеплювати целюлозу (полімер цукру); тварини, які отримують більшу частину свого харчування з трави та листя, повинні покладатися на дію симбіотичних бактерій, які колонізують їх травні тракти. Кількість енергії, доступної з їжі, можна знайти шляхом вимірювання теплоти згоряння відходів, що виділяються організмом, який був обмежений контрольованою дієтою, і віднімаючи це з теплоти згоряння їжі (табл.\(\PageIndex{3}\)).
| тип харчування | харчування |
ΔН° (кДж г —1) |
відсоток доступності |
|---|---|---|---|
| Протеїн | м'ясо | 22.4 | 92 |
| яйце | 23.4 | ||
| Жир | вершкове масло | 38.2 | |
| тваринний жир | 39.2 | 95 | |
| Вуглеводи | крохмаль | 17.2 | |
| глюкоза (цукор) | 15.5 | 99 | |
| етанолу | 29.7 | 100 |
Кількість енергії, яку вимагає тварина, залежить від віку, статі, площі поверхні тіла і звичайно від кількості фізичних навантажень. Швидкість, з якою витрачається енергія, виражається в ватах: 1 Вт = 1 Дж сек —1. Для людини це значення коливається приблизно від 200-800 Вт. Це означає, що щоденні споживання їжі мають енергетичні еквіваленти близько 10-15 МДж для більшості працюючих дорослих людей. Для того щоб просто підтримувати вагу при відсутності будь-яких фізичних навантажень, потрібно близько 6 МДж на добу.
| тварина | кДж год —1 | кДж кг —1 год —1 |
|---|---|---|
| миша | 82 | 17 |
| кішка | 34 | 6.8 |
| собака | 78 | 3.3 |
| овець | 193 | 2.2 |
| людські | 300 | 2.1 |
| кінь | 1430 | 1.1 |
| слона | 5380 | 0.7 |
Наведена вище таблиця повчальна тим, що хоча більші тварини споживають більше енергії, споживання енергії на одиницю маси тіла зменшується з розмірами. Це відображає той факт, що швидкість тепловтрат в навколишнє середовище багато в чому залежить від площі поверхні тварини, яка збільшується з масою з більшою швидкістю, ніж це робить обсяг тварини («розмір»).
Термодинаміка і погода
Водневі зв'язки на роботі
Загальновідомо, що великі водойми надають «помірне» вплив на місцеву погоду, знижуючи перепади температур, що виникають в інших районах. Температура води змінюється набагато повільніше, ніж температура ґрунту, гірських порід та рослинності, і цей ефект має тенденцію впливати на сусідні земельні маси. Це багато в чому пов'язано з високою теплоємністю води по відношенню до поверхні землі - і, отже, в кінцевому підсумку з впливом водневого зв'язку. Менший ККД води як поглинача і випромінювача інфрачервоної енергії також відіграє свою роль.
Питома теплоємність води приблизно в чотири рази більше, ніж у грунту. Це має прямий наслідок для тих, хто живе поблизу океану і знайомий з щоденними коливаннями в напрямку вітрів між сушею і водою. Навіть великі озера можуть надавати помірний вплив на місцеву погоду через відносну нечутливість води до зміни температури.
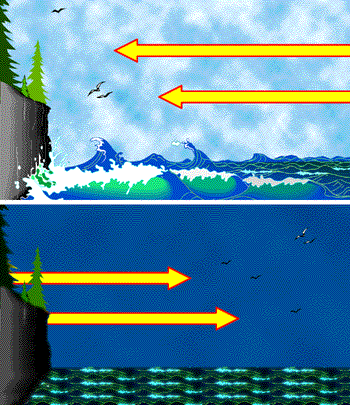
У денний час суша і море отримують приблизно рівну кількість тепла від Сонця, але набагато менша теплоємність суші змушує її температуру швидше підніматися. Це змушує повітря над землею нагріватися, зменшуючи його щільність і змушуючи його підніматися. Більш прохолодне океанічне повітря втягується, щоб заповнити порожнечу, тим самим породжуючи денний морський бриз. Увечері і земля, і океан втрачають тепло випромінюванням неба, але температура води падає менше, ніж у суші, продовжуючи подавати тепло океанічному повітрю і змушуючи його підніматися, тим самим змінюючи напрямок повітряного потоку і виробляючи вечірній сухопутний вітер.
Чому стає холодніше, коли ви йдете вище: адіабатична швидкість затримки
Повітря отримує своє тепло, поглинаючи далеке інфрачервоне випромінювання від землі, яке, звичайно, отримує своє тепло від сонця. Кількість тепла, що випромінюється в повітря безпосередньо над поверхнею, змінюється залежно від того, що на ньому (ліс, поля, вода, будівлі) і, звичайно, від часу та сезону. Коли посилка повітря над певним місцем буває прогріта більше, ніж повітря, що безпосередньо оточує його, це повітря розширюється і стає менш щільним. Тому він піднімається вгору через навколишнє повітря і піддається подальшому розширенню, оскільки стикається з меншим тиском на більшій висоті.
Всякий раз, коли газ розширюється проти протилежного тиску, він працює на навколишнє середовище. Згідно з Першим Законом Δ U = q + w, якщо ця робота не супроводжується компенсуючим потоком тепла в систему, її внутрішня енергія буде падати, а значить, і буде її температура. Виходить, що тепловий потік і змішування - це досить повільні процеси в атмосфері в порівнянні з описуваним нами конвективним рухом, тому Перший Закон можна записати як Δ U = w (нагадаємо, що w негативний, коли газ розширюється.) Таким чином, коли повітря піднімається над поверхнею землі, воно зазнає адіабатичного розширення і охолоджується. Фактична швидкість зниження температури з висотою залежить від складу повітря (основною змінною є його вологість) і від його теплоємності. Для сухого повітря це призводить до адіабатичної швидкості проміжку 9,8° C на км висоти.
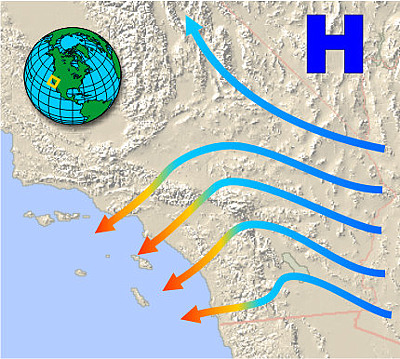
Санта-Анас і Чинукс
Якраз навпаки відбувається, коли вітри розвиваються у висотних районах і прямують вниз. У міру спуску повітря він піддається стисненню від тиску повітря над ним. Оточення зараз роблять роботу над системою, і оскільки процес відбувається занадто швидко, щоб збільшена внутрішня енергія була видалена як тепло, стиснення приблизно адіабатичне.
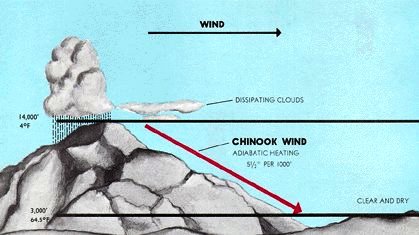
Утворені вітри теплі (а значить і сухі) і часто дуже дратують слизові оболонки. Вони загально відомі як вітри Föhn (це назва, дана тим, що походять в Альпах). У Північній Америці їх часто називають хінуками (або, взимку, «сніготанення»), коли вони беруть свій початок вздовж Скелястих гір. Серед найбільш горезвісних є Санта-Ана вітри Південної Каліфорнії, які підбирають додаткове тепло (і пил), коли вони проходять над пустелею Мохаве, перш ніж зануритися в басейн Лос-Анджелеса (рис. 13.5.X). Їх сухість і високі швидкості живлять багато згубних пожеж, які страждають на регіон.