8.3: Електрохімія - елементи та батареї
- Page ID
- 20548
- Визначте електрохімію.
- Опишіть основні компоненти електрохімічних клітин.
- Перерахуйте деякі характеристики, застосування та обмеження елементів та акумуляторів.
- Знайте різницю між гальванічними та електролітичними елементами.
- Визначте електроліз і перерахуйте кілька його застосувань.
Метал, що піддається впливу зовнішніх елементів, зазвичай піддається корозії, якщо не захищений. Процес корозії - це низка окислювально-відновних реакцій із залученням металу скульптури. У деяких ситуаціях метали навмисно залишають незахищеними, щоб поверхня зазнавала змін, які можуть підвищити естетичну цінність роботи.
Електрохімічні реакції
Хімічні реакції або поглинають, або виділяють енергію, яка може бути у вигляді електрики. Електрохімія - це галузь хімії, яка займається взаємоперетворенням хімічної енергії та електричної енергії. Електрохімія має багато поширених застосувань у повсякденному житті. Всілякі акумулятори, від тих, що використовуються для живлення ліхтарика до калькулятора до автомобіля, покладаються на хімічні реакції для вироблення електроенергії. Електрика використовується для пластинки предметів декоративними металами, такими як золото або хром. Електрохімія важлива при передачі нервових імпульсів в біологічних системах. За всіма електрохімічними процесами стоїть окислювально-відновна хімія, перенесення електронів.
Електрохімічна комірка - це будь-який пристрій, який перетворює хімічну енергію в електричну або електричну енергію в хімічну енергію. Існує три компоненти, які складають електрохімічну реакцію. Повинен бути розчин, де можуть виникнути окислювально-відновні реакції. Ці реакції зазвичай відбуваються у воді для полегшення руху електронів та іонів. Для передачі електронів повинен існувати провідник. Цей провідник зазвичай являє собою якийсь провід, щоб електрони могли переміщатися з однієї ділянки на іншу. Іони також повинні мати можливість рухатися через якусь форму соляного моста, що полегшує міграцію іонів.
Луїджі Гальвані (1737 - 1798) був італійським лікарем і вченим, який проводив дослідження нервової провідності у тварин. Його випадкове спостереження за посмикуванням жаб'ячих лапок при зіткненні з залізним скальпелем, поки ноги висіли на мідних гачках, призвело до досліджень електропровідності в м'язах і нервах. Він вважав, що тканини тварин містять «тваринну електрику», схожу на природну електрику, яка спричинила утворення блискавки.

Перший «вольтаїчний елемент» Алессандро Вольта розробив в 1800 році. Ця батарея складалася з чергуються дисків цинку і срібла зі шматочками картону, просоченого розсолом, що розділяють диски. Оскільки в той час не було вольтметрів (і поняття не було, що електричний струм обумовлений потоком електронів), Вольті довелося покладатися на інший показник міцності акумулятора: кількість виробленого удару (ніколи не буває гарною ідеєю перевірити речі на собі). Він виявив, що інтенсивність удару збільшувалася з кількістю металевих пластин в системі. Пристрої з двадцятьма пластинами видавали шок, який був досить болючим. Добре, що у нас сьогодні є вольтметри для вимірювання електричного струму замість методу «засунути палець на це і сказати мені, що ви відчуваєте».
Гальванічні (вольтаїчні) клітини
Гальванічні елементи, також відомі як вольтаїчні елементи, є електрохімічними елементами, в яких спонтанні окислювально-відновні реакції виробляють електричну енергію. При написанні рівнянь часто зручно розділяти окислювально-відновні реакції на напівреакції, щоб полегшити збалансування загального рівняння та підкреслити фактичні хімічні перетворення.
Розглянемо, що відбувається, коли чистий шматок мідного металу поміщають в розчин нітрату срібла (рис.\(\PageIndex{1}\)). Як тільки додається метал міді, починає утворюватися метал срібла і іони міді переходять в розчин. Синій колір розчину в крайньому правому куті свідчить про наявність іонів міді. Реакція може бути розщеплена на дві її напівреакції. Напівреакції відокремлюють окислення від відновлення, тому кожну можна розглядати індивідуально.
&\ textrm {окислення:}\ ce {Cu} (s) ⟶\ ce {Cu^2+} (aq) +\ ce {2e-}\\
&\ підкреслення {\ textrm {скорочення:} 2 × (\ ce {Ag+} (q) +\ ce {e-} ⟶\ ce {Ag} (s)\ hspace {40px}\ ce {або}\ hspace {40px}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (и)}\\
&\ textrm {загальний:}\ ce {2Ag+} (q) +\ ce {Cu} (s) ⟶ \ ce {2Ag} (и) +\ ce {Cu^2+} (aq)
\ кінець {вирівнювати*}\ номер\]
Рівняння відновної напівреакції довелося подвоїти, тому число електронів, «отриманих» у відновній напівреакції, дорівнювало кількості електронів, «втрачених» у напівреакції окислення.

Гальванічні або вольтаїчні елементи включають в себе спонтанні електрохімічні реакції, в яких напівреакції розділені (рис.\(\PageIndex{2}\)), щоб струм міг протікати через зовнішній провід. Стакан з лівого боку фігури називається полуосередковий, і містить 1 М розчин нітрату міді (II) [Cu (NO 3) 2] з частково зануреним в розчин шматком мідного металу. Мідний метал - це електрод. Мідь піддається окисленню; отже, мідний електрод є анодом. Анод з'єднується з вольтметром проводом, а інша клема вольтметра з'єднується з срібним електродом дротом. Срібло піддається відновленню; отже, срібний електрод є катодом. Полукомірка з правого боку фігури складається з срібного електрода в 1 М розчині нітрату срібла (AgNO 3). У цей момент струм не протікає - тобто не відбувається значного руху електронів через провід, оскільки ланцюг розімкнутий. Ланцюг замикається за допомогою соляного містка, який передає струм з рухомими іонами.
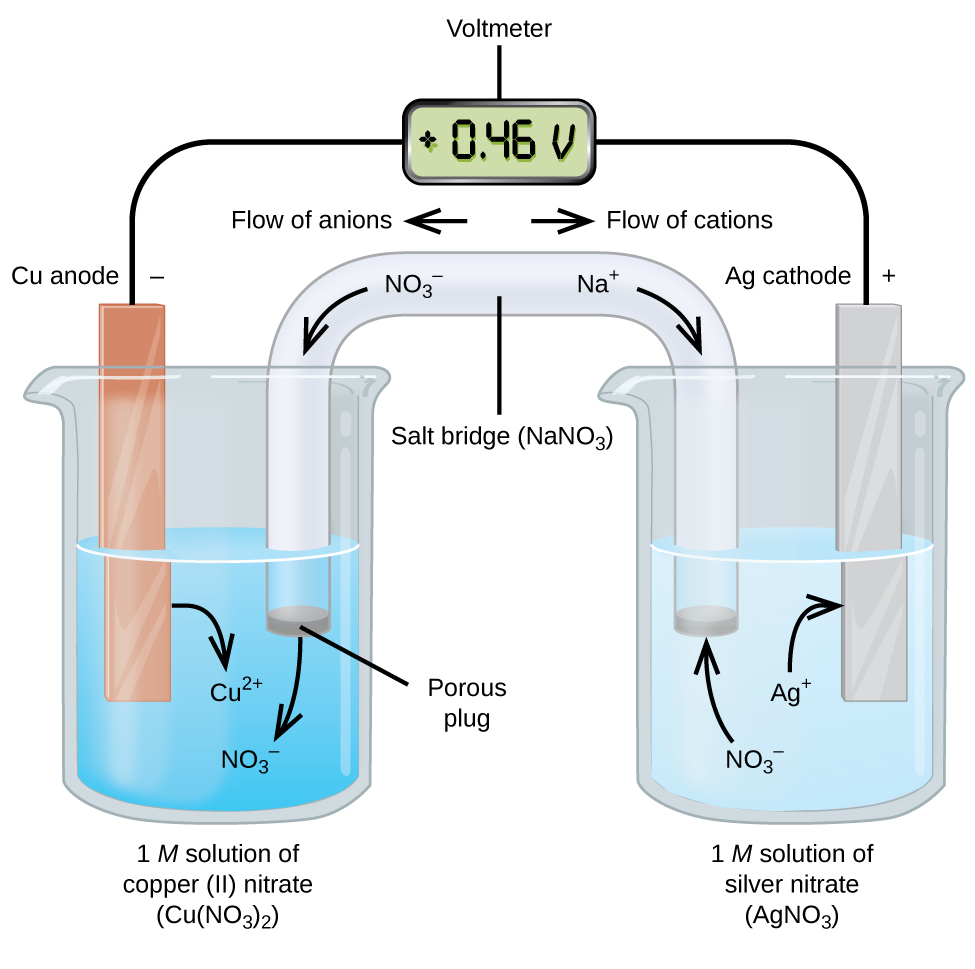
Сольовий міст складається з концентрованого, нереактивного розчину електроліту, такого як розчин нітрату натрію (NaNO 3), який використовується в цьому прикладі. Коли електрони протікають зліва направо через електрод і дріт, нітратні іони (аніони) проходять через пористу пробку зліва в розчин нітрату міді (II). Це тримає склянку зліва електрично нейтральною, нейтралізуючи заряд на іоні міді (II), які утворюються в розчині, коли метал міді окислюється. При цьому нітратні іони рухаються вліво, іони натрію (катіони) рухаються вправо, через пористу пробку, і в розчин нітрату срібла справа. Ці додані катіони «замінюють» іони срібла, які видаляються з розчину, оскільки вони були відновлені до срібного металу, зберігаючи склянку праворуч електрично нейтральною.
Коли електрохімічна комірка побудована таким чином, позитивний потенціал клітини (0,46 В) вказує на спонтанну реакцію і що електрони течуть зліва направо.
- Електрони течуть від анода до катода: зліва направо в стандартному гальванічному елементі.
- Електрод в лівій половині клітини є анодом, тому що тут відбувається окислення. Назва відноситься до потоку аніонів в соляному мосту до нього.
- Електрод в правій половині комірки є катодом, тому що тут відбувається зменшення. Назва відноситься до потоку катіонів в соляному мосту до нього.
- Окислення відбувається у анода (ліва половина осередку на малюнку).
- Зменшення відбувається у катода (права половина осередку на малюнку).
- Соляний міст повинен бути присутнім, щоб закрити (завершити) ланцюг, і для протікання струму повинні відбуватися як окислення, так і відновлення.
Розглянемо гальванічний елемент, що складається з
\(\ce{2Cr}(s)+\ce{3Cu^2+}(aq)⟶\ce{2Cr^3+}(aq)+\ce{3Cu}(s)\)
Напишіть напівреакції окислення і відновлення. Яка реакція відбувається на аноді? Катод?
Рішення
При огляді Cr окислюється, коли три електрони втрачаються, утворюючи Cr 3 +, і Cu 2 + зменшується, коли він отримує два електрони для утворення Cu. Балансування заряду дає
\ (\ почати {вирівнювати*}
&\ textrm {окислення:}\ ce {2Cr} (и) ⟶\ ce {2Cr^3+} (aq) +\ ce {6e-}\\
&\ textrm {скорочення:}\ ce {3Cu^2+} (q) +\ ce {6e-} ⟶\ ce {3Cu} (s)\\
& {\ текст {загальний:}\ ce {2Cr} (и) +\ ce {3Cu^2+} (aq) ⟶\ ce {2Cr^3+} (aq) +\ ce {3Cu} (s)}
\ кінець {вирівнювати*}\)
Позначення осередків використовує найпростішу форму кожного з рівнянь, і починається з реакції на аноді. Концентрації не були вказані так:
\(\ce{Cr}(s)│\ce{Cr^3+}(aq)║\ce{Cu^2+}(aq)│\ce{Cu}(s).\)
Окислення відбувається на аноді і відновлення на катоді.
Розглянемо гальванічний елемент, що складається з
\(\ce{Zn}(s)+\ce{Cu^2+}(aq)⟶\ce{Zn^2+}(aq)+\ce{Cu}(s)\)
Напишіть напівреакції окислення і відновлення. Яка реакція відбувається на аноді? Катод?
- Відповідь
-
З інформації, наведеної в задачі:
\ (\ почати {вирівнювати*}
&\ textrm {анод (окислення):}\ ce {Zn} (s) ⟶\ ce {Zn^2+} (aq) +\ ce {2e-}\\
&\ textrm {катод (редукція):}\ ce {Cu^2+} (q) +\ ce {2e-} ⟶\ ce {Cu} (s)\\ оверлайн {\ textrm {загальний:}\ ce {Zn} (
и) +\ ce {Cu^2+} (aq) ⟶\ ce {Zn^2+} (aq) +\ ce {Cu} (s)}
\ end {вирівнювати*}\)
Акумулятори
Акумулятор - це електрохімічний елемент або ряд елементів, що виробляють електричний струм. В принципі, в якості акумулятора можна було використовувати будь-який гальванічний елемент. Ідеальна батарея ніколи не розрядилася б, виробляла незмінну напругу і була здатна витримувати екстремальні екологічні перепади тепла та вологості. Справжні акумулятори дотримуються балансу між ідеальними характеристиками і практичними обмеженнями. Наприклад, маса автомобільного акумулятора становить близько 18 кг або близько 1% від маси середнього легкового автомобіля або малої вантажівки. Цей тип батареї забезпечував би майже необмежену енергію, якщо використовувати його в смартфоні, але буде відхилений для цієї програми через його масу. Таким чином, жодна батарея не є «найкращою», і батареї підбираються для конкретного застосування, зберігаючи такі речі, як маса акумулятора, її вартість, надійність та поточна ємність на увазі. Існує два основних типи акумуляторів: первинні і вторинні. Далі описано кілька акумуляторів кожного типу.
Відвідайте цей сайт, щоб дізнатися більше про акумулятори.
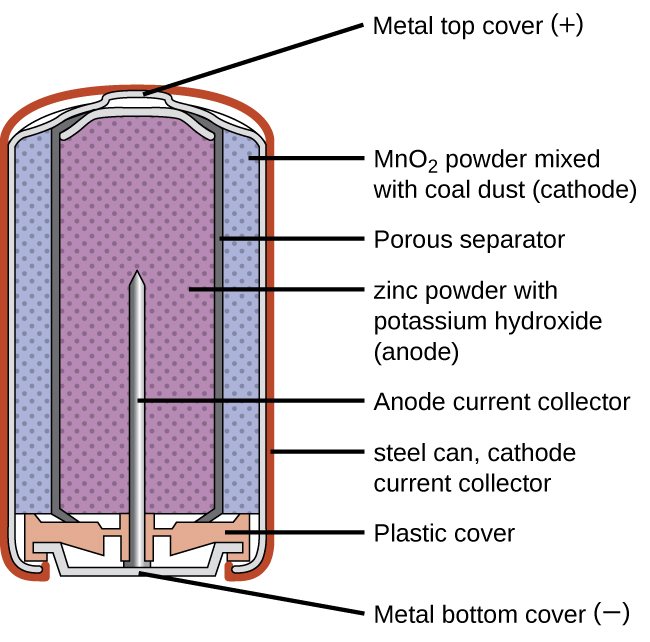
Сухі клітини (первинні батареї)
Первинні батареї - це одноразові батареї, оскільки їх неможливо зарядити. Звичайною первинною батареєю є суха батарея (рис.\(\PageIndex{1}\)). Сухий елемент являє собою цинк-вуглецеву батарею. Цинк може служити як ємністю, так і негативним електродом. Позитивний електрод являє собою стрижень, виготовлений з вуглецю, який оточений пастою оксиду марганцю (IV), хлориду цинку, хлориду амонію, порошку вуглецю та невеликої кількості води. Реакцію на аноді можна уявити як звичайне окислення цинку:
\[\ce{Zn}(s)⟶\ce{Zn^2+}(aq)+\ce{2e-} \nonumber \]

Реакція на катоді складніша, почасти тому, що відбувається не одна реакція. Ряд реакцій, що відбуваються на катоді, приблизно
\[\ce{2MnO2}(s)+\ce{2NH4Cl}(aq)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2NH3}(aq)+\ce{H2O}(l)+\ce{2Cl-} \nonumber \]
Загальну реакцію для цинк-вуглецевої батареї можна представити як
\[\ce{2MnO2}(s) + \ce{2NH4Cl}(aq) + \ce{Zn}(s) ⟶ \ce{Zn^2+}(aq) + \ce{Mn2O3}(s) + \ce{2NH3}(aq) + \ce{H2O}(l) + \ce{2Cl-} \nonumber \]
із загальним потенціалом осередку, який спочатку становить близько 1,5 В, але зменшується в міру використання акумулятора. Важливо пам'ятати, що напруга, що подається акумулятором, однакове незалежно від розміру батареї. З цієї причини батареї D, C, A, AA та AAA мають однаковий номінал напруги. Однак більші батареї можуть доставляти більше молів електронів.
Сухий елемент не дуже ефективний у виробництві електричної енергії, оскільки лише відносно невелика частка\(MnO_2\) того, що знаходиться поблизу катода, фактично зменшується, і лише невелика частка цинкового катода фактично споживається в міру розряду клітин. Крім того, сухі клітини мають обмежений термін зберігання, оскільки\(Zn\) анод спонтанно реагує з\(NH_4Cl\) електролітом, викликаючи корозію корпусу і дозволяючи вмісту витікати назовні (рис.\(\PageIndex{2}\)).

Лужні батареї (рис.\(\PageIndex{4}\)) були розроблені в 1950-х роках частково для вирішення деяких проблем продуктивності з цинк-вуглецевих сухих клітин. Вони виготовляються, щоб бути точними замінниками для цинк-вуглецевих сухих клітин. Як випливає з назви, ці типи акумуляторів використовують лужні електроліти, часто гідроксид калію е.
Лужна батарея може доставляти приблизно в три-п'ять разів більше енергії цинк-вуглецевої сухої клітини аналогічного розміру. Лужні батареї схильні до витоку гідроксиду калію, тому їх також слід видалити з пристроїв для тривалого зберігання. Хоча деякі лужні батареї перезаряджаються, більшість - ні.
Спроби перезарядити лужну батарею, яка не перезаряджається, часто призводить до розриву акумулятора і витоку електроліту гідроксиду калію.
Свинцеві акумуляторні батареї (вторинні батареї)
Свинцево-кислотний акумулятор (рис.\(\PageIndex{5}\)) - це тип вторинної батареї, що використовується у вашому автомобілі. Вторинні батареї є акумуляторними. Свинцево-кислотний акумулятор недорогий і здатний виробляти високий струм, необхідний автомобільним стартерним двигунам. Реакції на свинцево-кислотну батарею
\[\begin{align*} &\textrm{anode: }\ce{Pb}(s)+\ce{HSO4-}(aq)⟶\ce{PbSO4}(s)+\ce{H+}(aq)+\ce{2e-}\\ &\underline{\textrm{cathode: } \ce{PbO2}(s)+\ce{HSO4-}(aq)+\ce{3H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)}\\ &\textrm{overall: }\ce{Pb}(s)+\ce{PbO2}(s)+\ce{2H2SO4}(aq)⟶\ce{2PbSO4}(s)+\ce{2H2O}(l) \end{align*} \nonumber \]
Кожна комірка виробляє 2 В, тому шість осередків з'єднані послідовно для отримання автомобільного акумулятора на 12 В. Свинцево-кислотні батареї важкі і містять їдкий рідкий електроліт, але часто все ще є батареєю вибору через їх високу щільність струму. Свинцево-кислотна батарея у вашому автомобілі складається з шести осередків, з'єднаних послідовно, щоб дати 12 В. Їх низька вартість та високий вихідний струм роблять цих чудових кандидатів для забезпечення потужності автомобільних стартерних двигунів.
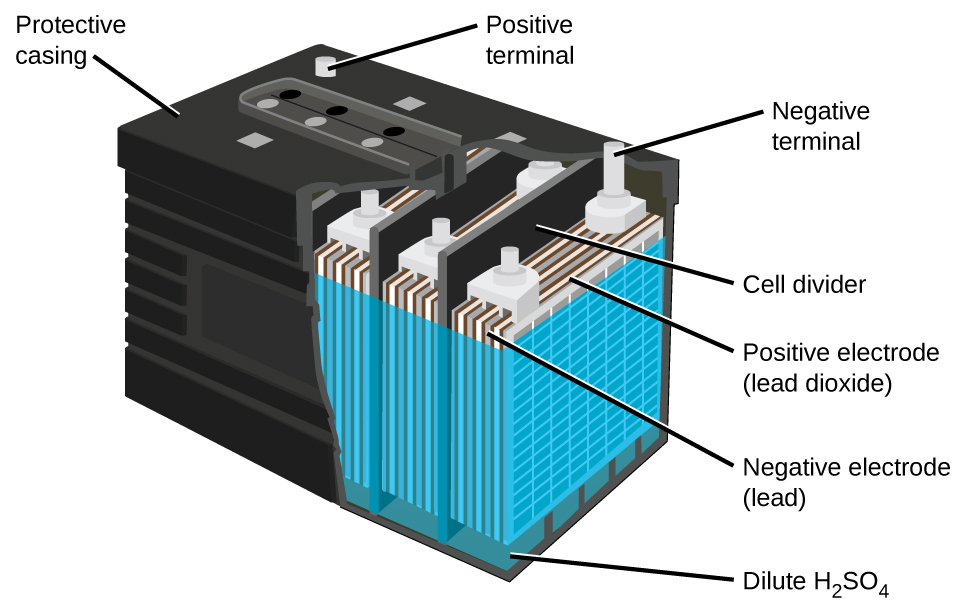
Як вже говорилося раніше, на відміну від сухопарника, свинцева акумуляторна батарея є акумуляторною. Зверніть увагу, що пряма окислювально-відновна реакція генерує твердий сульфат свинцю (II), який повільно накопичується на пластин. Додатково знижується концентрація сірчаної кислоти. Коли автомобіль працює нормально, його генератор заряджає акумулятор, змушуючи вищевказані реакції працювати в протилежному, або не спонтанному напрямку.
\[2 \ce{PbSO_4} \left( s \right) + 2 \ce{H_2O} \left( l \right) \rightarrow \ce{Pb} \left( s \right) + \ce{PbO_2} \left( s \right) + 4 \ce{H+} \left( aq \right) + 2 \ce{SO_4^{2-}} \left( aq \right) \nonumber \]
Ця реакція регенерує свинець, оксид свинцю (IV) та сірчану кислоту, необхідну для нормальної роботи акумулятора. Теоретично свинцева акумуляторна батарея повинна прослужити вічно. На практиці підзарядка не\(100\%\) ефективна, оскільки частина сульфату свинцю (II) падає з електродів і збирається на дні осередків.
Свинцеві акумуляторні батареї містять значну кількість свинцю, тому їх завжди потрібно утилізувати належним чином.
Інші акумулятори
Нікель-кадмієвий, або NiCad, акумулятор (рис.\(\PageIndex{6}\)) використовується в невеликих електроприладах і пристроях, таких як дрилі,
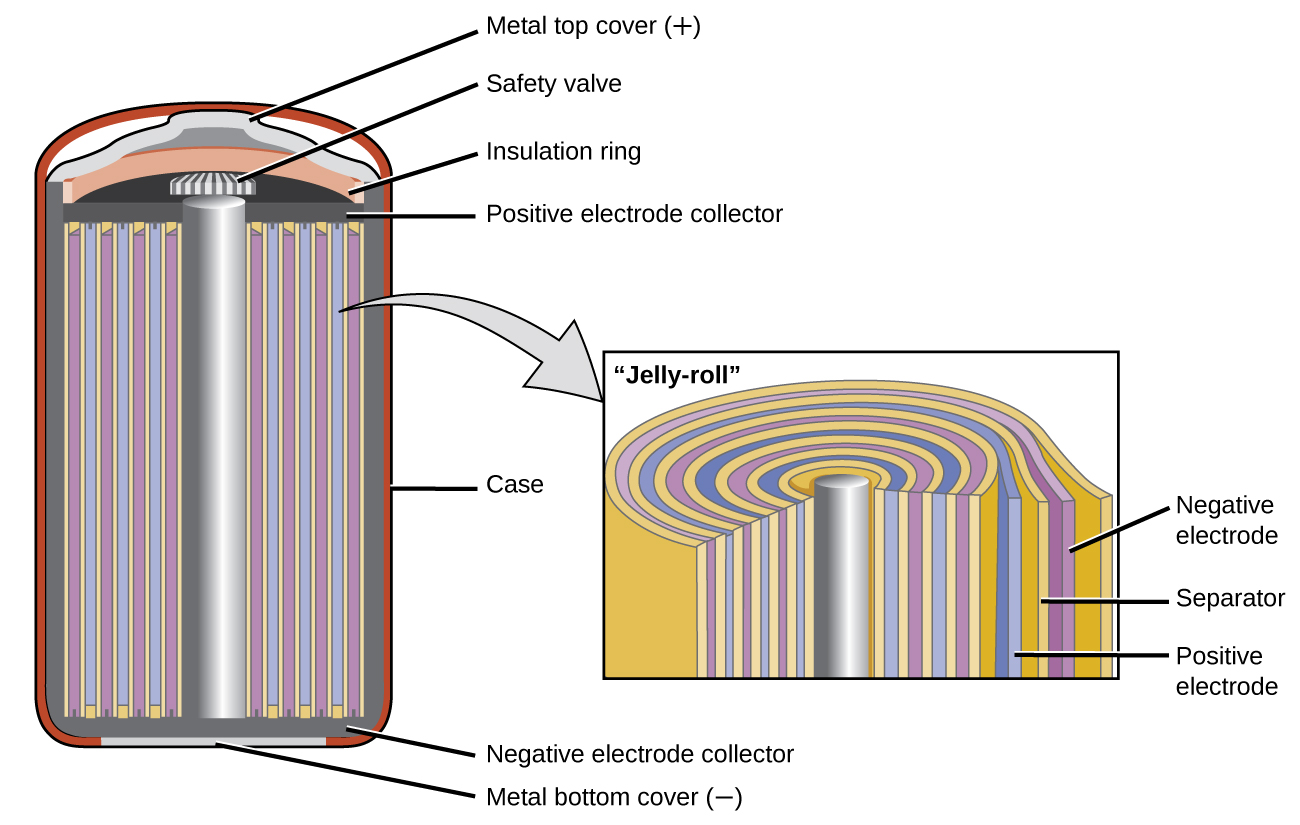
портативні пилососи та цифрові тюнери AM/FM. Він складається з нікельованого катода, кадмієвого анода та електрода гідроксиду калію. Позитивні і негативні пластини, які запобігають замикання сепаратором, згортаються між собою і заводяться в корпус. Це конструкція «желейного рулону» і дозволяє елементу NiCd доставляти набагато більше струму, ніж лужна батарея аналогічного розміру.
Напруга становить близько 1,2 В до 1,25 В в міру розрядки акумулятора. При правильній обробці акумулятор NiCd можна заряджати близько 1000 разів.
Кадмій є токсичним важким металом, тому NiCd батареї ніколи не слід відкривати або класти у звичайний сміття.
Літій-іонні батареї є одними з найпопулярніших акумуляторних батарей і використовуються в багатьох портативних електронних пристроях. Напруга акумулятора становить близько 3,7 В. Літієві батареї популярні, оскільки вони можуть забезпечити велику кількість струму, легші, ніж порівнянні батареї інших типів, виробляють майже постійну напругу при розряді і лише повільно втрачають заряд при зберіганні. Спеціалізовані літій-йодидні (полімерні) акумулятори знаходять застосування в багатьох довговічних критичних пристроях, таких як кардіостимулятори та інші імплантовані електронні медичні пристрої. Ці пристрої розраховані на прослужіння 15 і більше років.
Одноразові первинні літієві батареї необхідно відрізняти від вторинних літій-іонних або літій-полімерних. Термін «літієва батарея» відноситься до сімейства різних хімікатів літій-металів, що включає багато типів катодів та електролітів, але всі з металевим літієм як анодом. Літієві батареї широко використовуються в портативних споживчих електронних пристроях, а також в електромобілів, починаючи від повнорозмірних транспортних засобів до радіокерованих іграшок.

(0,197 до 0,984 дюйма) в діаметрі та висоті від 1 до 6 мм (від 0,039 до 0,236 дюйма) - як гудзик на одязі, звідси і назва. Металева може утворювати нижній корпус і позитивний термінал клітини. Ізольована верхня кришка - це негативна клема. Кнопкові клітини - це одиночні клітини, як правило, одноразові первинні клітини. Поширеними анодними матеріалами є цинк або літій. Загальні катодні матеріали - діоксид марганцю, оксид срібла, монофторид вуглецю, оксид міді або кисень з повітря. Кнопкові клітини оксиду ртуті раніше були поширеними, але більше не доступні через токсичність та вплив ртуті на навколишнє середовище.
Клітини гудзиків дуже небезпечні для маленьких дітей. Клітини гудзиків, які проковтнули, можуть спричинити важкі внутрішні опіки та значну травму або смерть.
Паливні елементи
Паливний елемент - це пристрій, який перетворює хімічну енергію в електричну. Паливні елементи схожі на
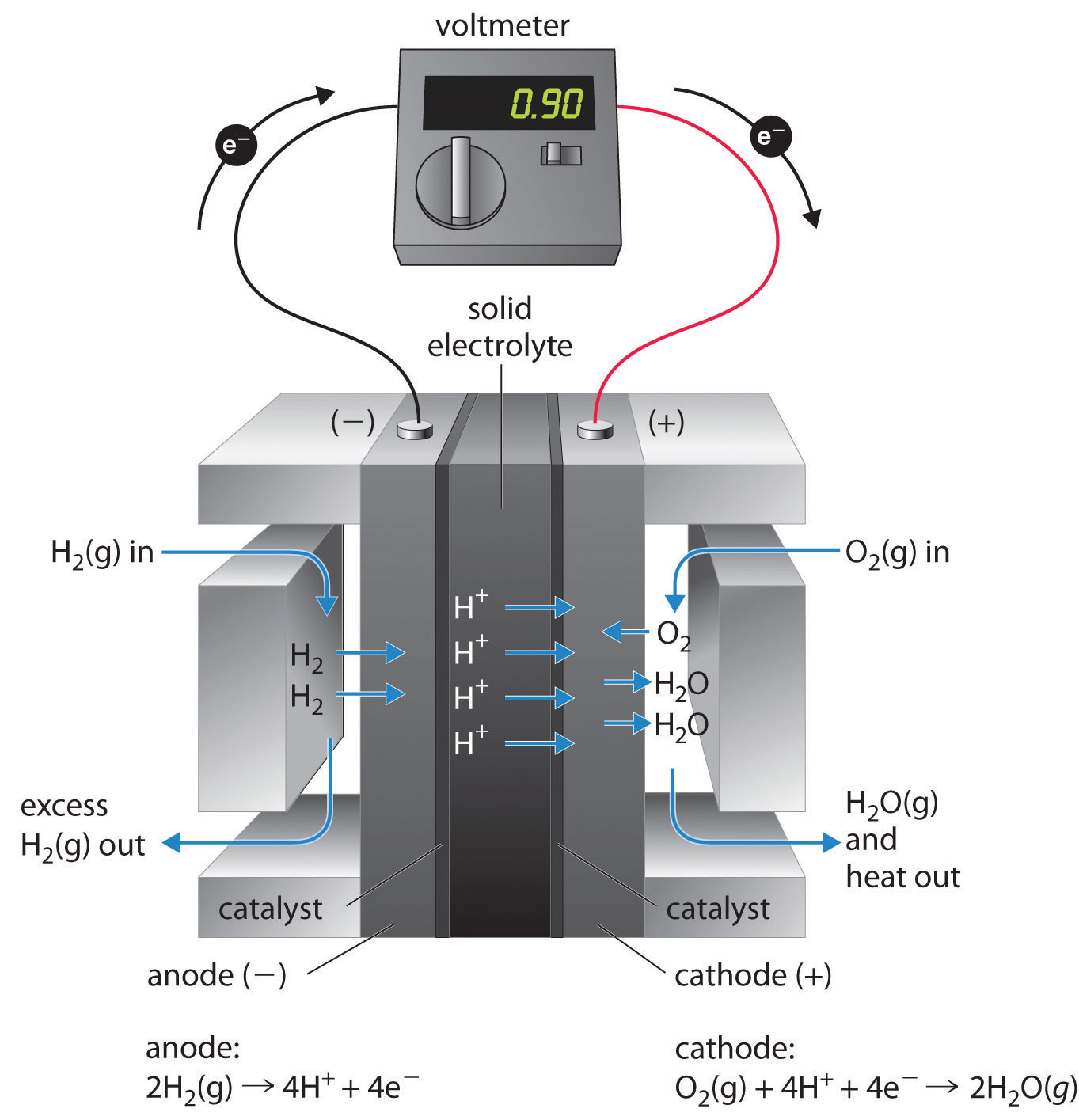
але акумулятори вимагають постійного джерела палива, часто водню. Вони продовжуватимуть виробляти електроенергію до тих пір, поки буде доступне паливо. Водневі паливні елементи використовувалися для живлення супутників, космічних капсул, автомобілів, човнів та підводних човнів (рис.\(\PageIndex{8}\)).
Напруга становить близько 0,9 В. ККД паливних елементів зазвичай становить близько 40% до 60%, що вище, ніж типовий двигун внутрішнього згоряння (від 25% до 35%) і, у випадку з водневим паливним елементом, виробляє тільки воду як вихлоп. Хоча паливні елементи є по суті екологічно безпечним засобом отримання електричної енергії, їх витрата та технологічна складність поки що обмежують їх застосування.
Електроліз
У цьому розділі ми описали різні гальванічні елементи, в яких для отримання електричної енергії використовується спонтанна хімічна реакція. Однак в електролітичному елементі відбувається зворотний процес, званий електролізом: подається зовнішня напруга для приводу неспонтанної реакції. Електроліз має багато комерційних та промислових застосувань. Електрометалургія - це процес відновлення металів з металевих сполук для отримання чистої форми металу за допомогою електролізу. Таким чином виробляються алюміній, літій, натрій, калій, магній, кальцій, а в деяких випадках мідь. Хлор і гідроксид натрію є основними продуктами електролізу розсолу, суміші вода/хлориду натрію. Електроліз води використовується для отримання кисню для космічних апаратів і атомних підводних човнів.
Електроліз також використовується при очищенні і збереженні старих артефактів. Оскільки процес відокремлює неметалеві частинки від металевих, він дуже корисний для очищення найрізноманітніших металевих предметів, від старих монет до ще більших предметів, включаючи іржаві чавунні блоки циліндрів та головки при відновленні автомобільних двигунів. Видалення іржі з дрібних залізних або сталевих предметів електролізом можна зробити в домашній майстерні, використовуючи прості матеріали, такі як пластикове відро, водопровідна вода, довжини арматури, промивна сода, пресування дріт та зарядний пристрій акумулятора.
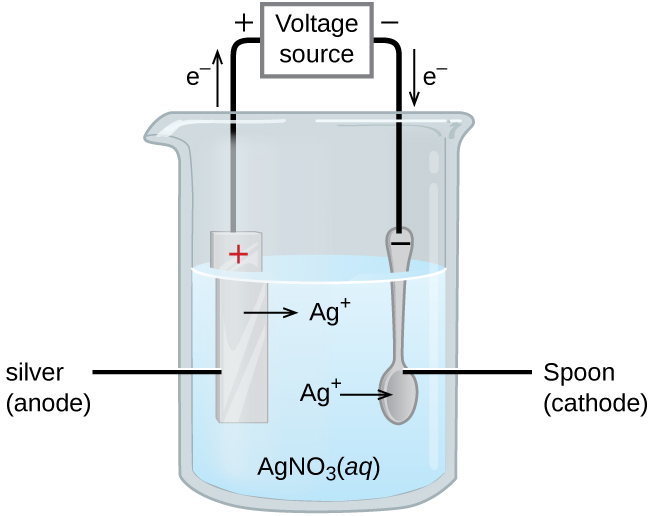
Важливе застосування для електролітичних елементів - гальванічне покриття. Гальванічне покриття призводить до тонкого покриття одного металу поверх провідної поверхні. Причини гальванічного покриття включають в себе зробити об'єкт більш стійким до корозії, зміцнення поверхні, отримання більш привабливої обробки або для очищення металу. Метали, які зазвичай використовуються в гальваніці, включають кадмій, хром, мідь, золото, нікель, срібло та олово. Поширені споживчі товари включають срібний або позолочений посуд, хромовані автомобільні деталі та ювелірні вироби. Ми можемо отримати уявлення про те, як це працює, досліджуючи, як виробляється посріблений посуд (рис.\(\PageIndex{9}\)).
Резюме
- Електрохімія - це галузь хімії, яка займається взаємоперетворенням хімічної енергії та електричної енергії.
- Батареї являють собою гальванічні елементи, або ряд елементів, які виробляють електричний струм.
- Існує два основних типи акумуляторів: первинні і вторинні.
- Первинні батареї є «одноразовими» і не підлягають зарядці. Сухі елементи і (більшість) лужних батарей є прикладами первинних батарей.
- Другий тип є акумуляторним і називається вторинним акумулятором. Приклади вторинних акумуляторів включають нікель-кадмієві (NiCd), свинцево-кислотні та літій-іонні батареї.
- Паливні елементи схожі на акумулятори тим, що генерують електричний струм, але вимагають безперервного додавання палива і окислювача. Водневий паливний елемент використовує водень і кисень з повітря для отримання води, і, як правило, є більш ефективним, ніж двигуни внутрішнього згоряння.
- Електроліз відбувається при подачі зовнішньої напруги для приводу неспонтанної реакції.
Дописувачі та атрибуція
- Template:ContribCK12
- Template:ContribOpenStax
- TextMap: Chemistry-The Central Science (Brown et al.)
- Template:ContribAgnewM
- Wikipedia