8.5: Кисень - рясний та ефірний окислювач
- Page ID
- 20539
- Знати виникнення і властивості кисню.
- Знайте реакції, що включають кисень як окислювач.
Елементарний кисень є сильним окислювачем. Він вступає в реакцію з більшістю інших елементів і багатьма сполуками. Кисень був виділений Майклом Сендівогіусом до 1604 року, але прийнято вважати, що елемент був відкритий самостійно Карлом Вільгельмом Шееле, в Уппсалі, в 1773 році або раніше, і Джозефом Прістлі в Вілтширі, в 1774 році. Назва кисень було придумано в 1777 році Антуаном Лавуазьє, який вперше визнав кисень хімічним елементом і правильно охарактеризував роль, яку він відіграє в горінні.
Кисень: виникнення та властивості
За масою кисень є третім за поширеністю елементом у Всесвіті, після водню і гелію. Кисень - найпоширеніший елемент на земній корі. Близько 50% маси земної кори складається з кисню (поєднаного з іншими елементами, головним чином кремнієм). Кисень виникає у вигляді молекул O 2 і, в обмеженій мірі, як молекули O 3 (озону) в повітрі. Вона утворює близько 20% маси повітря. Близько 89% води по масі складається з комбінованого кисню. У поєднанні з вуглецем, воднем і азотом кисень становить велику частину рослин і тварин.
Кисень - це безбарвний газ без запаху та смаку при звичайних температурах. Він трохи щільніше повітря. Хоча він лише слабо розчинний у воді (49 мл газу розчиняється в 1 л при STP), розчинність кисню дуже важлива для водної життєдіяльності.
Кисень необхідний в таких процесах горіння, як спалювання палива. Всі реакції горіння також є прикладами окислювально-відновних реакцій. Реакція горіння відбувається, коли речовина реагує з киснем для створення тепла. Одним із прикладів є згоряння октану, принципової складової бензину:
\[\ce{2 C_8H_{18} (l) + 25 O_2 (g) -> 16 CO_2 (g) + 18 H_2O (g) } \nonumber \]
Реакції горіння є основним джерелом енергії для сучасної промисловості. Рослини і тварини використовують кисень з повітря при диханні. Введення повітря, збагаченого киснем, є важливою медичною практикою, коли пацієнт отримує недостатнє надходження кисню через шок, пневмонію або якусь іншу хворобу.
Хімічна промисловість використовує кисень для окислення багатьох речовин. Значна кількість кисню, що виробляється комерційно, має важливе значення для видалення вуглецю з заліза під час виробництва сталі. Велика кількість чистого кисню також необхідна при виготовленні металів і при різанні та зварюванні металів киснево-водневими і киснево-ацетиленовими пальниками. Рідкий кисень важливий для космічної галузі. Є окислювачем в ракетних двигунів. Він також є джерелом газоподібного кисню для життєзабезпечення в космосі.
Як ми знаємо, кисень дуже важливий для життя. Енергія, необхідна для підтримки нормальних функцій організму у людини та інших організмів, надходить від повільного окислення хімічних сполук. Кисень є кінцевим окислювачем в цих реакціях. У людини кисень переходить з легких в кров, де з'єднується з гемоглобіном, виробляючи оксигемоглобін. У такому вигляді кров транспортує кисень до тканин, де передається тканинам. Кінцевими продуктами є вуглекислий газ і вода. Кров переносить вуглекислий газ по венах до легенів, де кров виділяє вуглекислий газ і збирає інший запас кисню. Травлення та засвоєння їжі регенерують матеріали, що споживаються окисленням в організмі; звільнена енергія така ж, як якщо б їжа спалювалася поза тілом.
Кисень: реакції з іншими елементами
Кисень реагує безпосередньо при кімнатній температурі або при підвищених температурах з усіма іншими елементами, крім благородних газів, галогенів і декількох перехідних металів другого і третього ряду з низькою реакційною здатністю (з більш високими відновними потенціалами, ніж мідь). Іржа - приклад реакції кисню з залізом. Більш активні метали утворюють пероксиди або супероксиди. Менш активні метали і неметали дають оксиди. Два приклади цих реакцій:
\[\ce{2Mg (s) + O2(g) -> 2MgO(s)} \nonumber \]
\[\ce{P4(s)+ 5O2 (g) -> P4O10(s)} \nonumber \]
Оксиди галогенів, принаймні одного з благородних газів, і металів з більш високими відновними потенціалами, ніж мідь, не утворюються при безпосередній дії елементів з киснем.
Кисень: реакція зі сполуками
Елементарний кисень також реагує з деякими сполуками. Якщо є можливість окислення будь-якого з елементів в даному з'єднанні, може статися подальше окислення киснем. Наприклад, сірководень H 2 S містить сірку зі ступенем окислення 2−. Оскільки сірка не проявляє свого максимального ступеня окислення, ми очікуємо, що H 2 S реагує з киснем. Це робить, даючи воду і діоксид сірки. Реакція така:
\[\ce{2H2S}(g)+\ce{3O2}(g)⟶\ce{2H2O}(l)+\ce{2SO2}(g) \nonumber \]
Також можливе окислення оксидів, таких як CO і P 4 O 6, які містять елемент з меншим ступенем окислення. Легкість, з якою елементарний кисень підхоплює електрони, відображається труднощами видалення електронів з кисню в більшості оксидів. З елементів тільки дуже реактивний фтор може окислювати оксиди з утворенням газоподібного кисню.
Більшість неметалів реагують з киснем з утворенням неметалевих оксидів. Залежно від наявних ступенів окислення елемента, можуть утворюватися різні оксиди. Фтор буде поєднуватися з киснем, утворюючи фториди, такі як OF 2, де кисень має ступінь окислення 2 +.
Сполуки кисню сірки
Двома поширеними оксидами сірки є діоксид сірки, SO 2 та триоксид сірки, SO 3. Запах пекучої сірки виходить від діоксиду сірки. Діоксид сірки, зустрічається в вулканічних газах малюнок\(\PageIndex{1}\) і в атмосфері поблизу промислових підприємств, які спалюють паливо, що містить сполуки сірки.

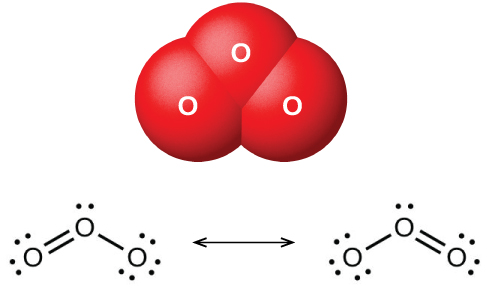
Озон: Інша форма кисню
При пропусканні сухого кисню між двома електрично зарядженими пластинами утворюється озон (О 3, проілюстрований на малюнку\(\PageIndex{2}\)), алотроп кисню, що володіє характерним запахом. Освіта озону з кисню - це ендотермічна реакція, при якій енергія надходить від електричного розряду, тепла або ультрафіолету:
\[\ce{3O2}(g)\xrightarrow{\ce{electric\: discharge}}\ce{2O3}(g) \nonumber \]
Різкий запах, пов'язаний з іскроутворення електрообладнання, обумовлений, частково, озоном.
Озон утворюється природним чином у верхній атмосфері під дією ультрафіолетового світла сонця на кисень там. Більшість атмосферного озону відбувається в стратосфері, шарі атмосфери, що простягається приблизно від 10 до 50 кілометрів над земною поверхнею. Цей озон діє як бар'єр для шкідливого ультрафіолетового світла від сонця, поглинаючи його за допомогою хімічної реакції розкладання:
\[\ce{O3}(g)\xrightarrow{\ce{ultraviolet\: light}}\ce{O}(g)+\ce{O2}(g) \nonumber \]
Реактивні атоми кисню рекомбінуються з молекулярним киснем для завершення циклу озону. Наявність стратосферного озону знижує частоту раку шкіри та інших шкідливих впливів ультрафіолетового випромінювання. Було чітко продемонстровано, що хлорфторуглеці, ХФУ (комерційно відомі як фреони), які були присутні як аерозольні пропелленти в балончиках і як холодоагенти, спричиняли виснаження озону в стратосфері. Це сталося тому, що ультрафіолетове світло також змушує CFC розкладатися, виробляючи атомний хлор. Атоми хлору реагують з молекулами озону, в результаті чого відбувається чисте видалення молекул O 3 зі стратосфери. Цей процес детально досліджується в нашому висвітленні хімічної кінетики. У всьому світі проводяться зусилля щодо зменшення кількості ХФУ, що використовуються в комерційних цілях, і озонова діра вже починає зменшуватися в розмірах, оскільки атмосферні концентрації атомного хлору зменшуються. Хоча озон у стратосфері допомагає захистити нас, озон у тропосфері є проблемою. Цей озон є токсичним компонентом фотохімічного смогу.
Використання озону залежить від його реакційної здатності з іншими речовинами. Його можна використовувати як відбілюючий засіб для масел, восків, тканин та крохмалю: Він окислює кольорові сполуки в цих речовині до безбарвних сполук. Це альтернатива хлору як дезінфікуючого засобу для води.
Низький рівень озону (або тропосферний озон) є забруднювачем атмосфери. [42] Він не виділяється безпосередньо двигунами автомобілів або промисловими операціями, а утворюється в результаті реакції сонячного світла на повітря, що містить вуглеводні та оксиди азоту, які реагують на утворення озону безпосередньо біля джерела забруднення або багатьох кілометрів вниз вітер.
Озон реагує безпосередньо з деякими вуглеводнями, такими як альдегіди, і таким чином починає їх видалення з повітря, але продукти самі по собі є ключовими компонентами смогу.
Озон можна використовувати для видалення заліза і марганцю з води, утворюючи осад, який можна фільтрувати:
\[2 Fe^{2+} + O_3 + 5 H_2O → 2 Fe(OH)_3(s) + O_2 + 4 H^+ \nonumber \]
\[2 Mn^{2+} + 2 O_3 + 4 H_2O → 2 MnO(OH)_2(s) + 2 O_2 + 4 H^+ \nonumber \]
Озон також буде окислювати розчинений сірководень у воді до сірчистої кислоти:
\[3 O_3 + H_2S → H_2SO_3 + 3 O_2 \nonumber \]
Ці три реакції є центральними у використанні озону на основі очищення води свердловини.
Озон також детоксикує ціаніди шляхом перетворення їх в ціанати.
\[CN^− + O_3 → CNO^− + O_2 \nonumber \]
Озон також повністю розкладатиме сечовину:
\[(NH_2)_2CO + O_3 → N_2 + CO_2 + 2 H_2O \nonumber \]
Інші поширені окислювачі
Хлор зазвичай використовується (у вигляді хлорноватистої кислоти) для знищення бактерій та інших мікробів в джерелах питної води та громадських басейнів. У більшості приватних басейнів не використовується сам хлор, а скоріше гіпохлорит натрію, що утворюється з хлору і гідроксиду натрію, або твердих таблеток хлорованих ізоціануратів. Недоліком використання хлору в басейні є те, що хлор вступає в реакцію з білками в людському волоссі і шкірі. Відмінний «аромат хлору», пов'язаний з басейнами, є не результатом самого хлору, а хлораміну, хімічної сполуки, що утворюється в результаті реакції вільного розчиненого хлору з амінами в органічних речовині. Як дезінфікуючий засіб у воді хлор більш ніж в три рази ефективніший проти кишкової палички, ніж бром, і більш ніж в шість разів ефективніший, ніж йод. Все частіше сам хлорамін безпосередньо додають у питну воду з метою дезінфекції - процес, відомий як хлорамінування.
Зберігати і використовувати отруйний хлорний газ для очищення води часто недоцільно, тому використовуються альтернативні методи додавання хлору. До них відносяться розчини гіпохлориту, які поступово виділяють хлор у воду, і такі сполуки, як дихлор-с-триазінетріон натрію (дигідрат або безводний), іноді називають «дихлором», і трихлор-с-триазінетріон, іноді називають «трихлором». Ці сполуки є стабільними, поки тверді і можуть бути використані в порошкоподібній, гранульованої або таблетованій формі. При додаванні в невеликих кількостях у воду басейну або промислові водні системи атоми хлору гідролізуються з решти молекули, утворюючи хлорноватисту кислоту (HOCl), яка діє як загальний біоцид, вбиваючи мікроби, мікроорганізми, водорості тощо.
Дихаталізатори
Алкотестер - це окислювально-відновна реакція. Коли дихромат калію реагує з етанолом, він втрачає атом кисню (зменшується), переходячи від оранжевого дихромату до зеленого сульфату хрому. При цьому дихромат відновлюється, етанол набирає атом кисню (окислюється), утворюючи оцтову кислоту. Сірчана кислота сприяє видаленню етанолу з повітря, що видихається в тестовий розчин, а також забезпечує необхідні кислі умови.
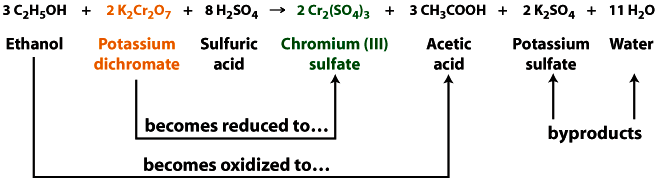
У цій реакції атом хрому відновлюється від\(Cr^{6+}\) до\(Cr^{3+}\), а етанол окислюється до оцтової кислоти.
Перекис водню може використовуватися для стерилізації різних поверхонь, в тому числі хірургічних інструментів і може бути розгорнутий у вигляді пари (VHP) для кімнатної стерилізації. \(\ce{H2O2}\)демонструє ефективність широкого спектру дії проти вірусів, бактерій, дріжджів та суперечок бактерій. Загалом, більша активність спостерігається проти грампозитивних, ніж грамнегативних бактерій; однак наявність каталази або інших пероксидаз у цих організмах може підвищити толерантність при наявності менших концентрацій. Для спорицидної активності потрібні більш високі концентрації\(\ce{H2O2}\) (від 10 до 30%) і більш тривалий час контакту.
Перекис водню розглядається як екологічно безпечна альтернатива хлору на основі відбілювачів, оскільки вона руйнується з утворенням кисню та води, і вона, як правило, визнана безпечною як протимікробний засіб Управлінням з контролю за продуктами та ліками США (FDA).
Історично перекис водню використовувався для дезінфекції ран, частково через її низьку вартість і швидку доступність в порівнянні з іншими антисептиками. Зараз вважається, що він гальмує загоєння і викликає рубці, оскільки він руйнує новоутворені клітини шкіри. Тільки дуже низька концентрація
\(\ce{H2O2}\)може викликати загоєння, і тільки в тому випадку, якщо не застосовувати повторно. Хірургічне використання може призвести до утворення газової емболії. Незважаючи на це, він все ще використовується для обробки ран у багатьох країнах, але також поширений як основний антисептик першої допомоги в Сполучених Штатах.
Розбавлений\(\ce{H2O2}\) (від 1,9% до 12%) змішаний з водним аміаком використовується для знебарвлення людського волосся. Відбілююча властивість хімічної речовини дає свою назву словосполученню «перекисна блондинка». Перекис водню також використовується для відбілювання зубів. Його можна знайти в більшості відбілюючих зубних паст.
Майже всі сфери застосування марганцівки (\(\ce{KMnO4}\)) використовують його окислювальні властивості. Як сильний окислювач, який не генерує токсичних побічних продуктів,\(\ce{KMnO4}\) має багато нішевих застосувань. Перманганат калію використовується при ряді шкірних захворювань. Сюди входять грибкові інфекції стопи, імпетиго, пухирчатка, поверхневі рани, дерматит, тропічні виразки. Він входить до Типового переліку основних лікарських засобів ВООЗ, найважливіших ліків, необхідних в базовій системі охорони здоров'я. Перманганат калію широко використовується в галузі водопідготовки.
Пероксид бензоїлу (BPO) є медикаментозним і промисловим хімічним засобом. Як медикаментозний засіб, його використовують для лікування вугрової висипки легкого та середнього ступеня тяжкості. Для більш важких випадків його можна використовувати з іншими методами лікування. Деякі версії продаються змішаними з антибіотиками, такими як кліндаміцин. Інші види використання включають відбілювання борошна, відбілювання волосся, відбілювання зубів та відбілювання текстилю. [5] Він також використовується в пластмасовій промисловості
Гіпохлорит натрію найчастіше зустрічається у вигляді блідо-зеленувато-жовтого розведеного розчину, широко відомого як рідкий відбілювач або просто відбілювач, побутова хімія, широко використовувана (починаючи з 18 століття) як дезінфікуючий засіб або відбілюючий засіб. З'єднання в розчині нестійке і легко розкладається, виділяючи хлор, що є активним принципом таких продуктів. Дійсно, гіпохлорит натрію є найстарішим і досі найважливішим відбілювачем на основі хлору.
Хоча гіпохлорит натрію нетоксичний, його корозійні властивості, загальна доступність та продукти реакції роблять його значним ризиком для безпеки. Зокрема, змішування рідкого відбілювача з іншими миючими засобами, такими як кислоти або аміак, може виробляти токсичні пари.
Резюме
- Кисень - один з найбільш реактивних елементів. Ця реакційна здатність укупі з її великою кількістю робить хімію кисню дуже багатою і добре зрозумілою.
- Багато сполук представницьких металів і неметалів реагують з киснем з утворенням оксидів.
- Крім кисню, озону, хлору, біхромату калію, пероксиду водню, перекису калію, пероксиду бензоїлу, гіпохлориту натрію є загальними окислювачами, згаданими в цьому розділі, які мають багато корисних застосувань.