14.E: Окислювально-відновна реакція (вправи)
14.2: Окислювально-відновні реакції
- Чи є ця реакція окислювально-відновною реакцією? Поясніть свою відповідь. 2К (и) + Бр 2 (од) → 2кБр (и)
- Чи є ця реакція окислювально-відновною реакцією? Поясніть свою відповідь. 2NaCl (ак) + Pb (НІ 3) 2 (ак) → 2нано 3 (aq) + ПБКЛ 2 (с)
- Яка речовина втрачає електрони, а яка речовина отримує електрони в цій реакції? 2 Мг (и) + О 2 (г) → 2Мго
- Яка речовина втрачає електрони, а яка речовина отримує електрони в цій реакції? 16Фе (и) + 3С 8 (и) → 8Фе 2 З 3 (и)
- Яка речовина окислюється і яка речовина відновлюється в цій реакції? 2Лі (и) + О 2 (г) → Лі 2 О 2 (и)
- Яка речовина окислюється і яка речовина відновлюється в цій реакції? 2Фе (и) + 3І 2 (и) → 2FeI 3 (и)
- Які два різних визначення окислення?
- Які два різних визначення скорочення?
- Призначте числа окислення атомам в кожній речовині.
- П 4
- ТАК 3
- ТАК 3 2 −
- Са 3 (РО 32)
- Призначте числа окислення атомам в кожній речовині.
- ПКл 5
- (NH 42 ) Сер
- Ag
- Лі 2 О 2
- Призначте числа окислення атомам в кожній речовині.
- НІ
- НІ 2
- CrCl 2
- CrCl 3
- Призначте числа окислення атомам в кожній речовині.
- Нах
- N 2 З 3
- НЕМАЄ 2 −
- КуНо 3
- Призначте числа окислення атомам в кожній речовині.
- СН 2 О
- NH 3
- Рб 2 СО 4
- Зн (С 2 Н 3 О 2) 2
- Призначте числа окислення атомам в кожній речовині.
- С 6 Ч 6
- Б (ОН) 3
- Лі 2 S
- Au
- Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції, присвоюючи атомам числа окислення. 2NO + Сл 2 → 2nOCl
- Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції, присвоюючи атомам числа окислення. Ср + СО 3 → СРСО 3
- Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції, присвоюючи атомам числа окислення. 2кРФ 2 + 2Н 2 О → 2Кр + 4ВЧ + О 2
- Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції, присвоюючи атомам числа окислення. СО 3 + СЛ 2 → СоЦЛ 2 + СО 2
- Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції, присвоюючи атомам числа окислення. 2Рб+ МгСл 2 → 2рБКл+ Мг
- Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції, присвоюючи атомам числа окислення. 2С 8 Н 18 + 25О 2 → 16СО 2 + 18Н 2 О
Відповіді
- так тому що числа окислення змінюються
-
втрата: Mg; посилення: O
-
окислений: Li; відновлений: O
- збільшення числа окислення; втрата електронів
-
- Р: 0
- S: +6; O: −2
- S: +4; O: −2
- Са: +2; П: +3; О: −2
-
- П: +2; О: −2
- П: +4; О: −2
- Кр: +2; Кл: −1
- Кр: +3; Кл: −1
-
- C: 0; Ч: +1; О: −2
- П: −3; Ч: +1
- Рб: +1; С: +6; О: −2
- Зн: +2; С: 0; Н: +1; О: −2
- окислений: N; відновлений: Cl
- окислений: O; відновлений: Kr
- окислений: Rb; відновлений: Mg
14.3: Балансування окислювально-відновних реакцій
- Збалансувати ці окислювально-відновні реакції шляхом огляду.
- На+Ф 2 → НаФ
- Ал 2 О 3 + Н 2 → Ал + Н 2 О
- Збалансувати ці окислювально-відновні реакції шляхом огляду.
- Фе 2 С 3 + О 2 → Фе 2 О 3 + С
- Су 2 О+ Н 2 → С+Н 2 О
- Збалансувати ці окислювально-відновні реакції шляхом огляду.
- СН 4 + О 2 → СО 2 + Н 2 О
- П 2 О 5 + Сл 2 → ПКл 3 + О 2
- Збалансувати ці окислювально-відновні реакції шляхом огляду.
- ПБКЛ 2 + FeCl 3 → ПБКЛ 4 + FeCl 2
- СО 2 + Ф 2 → СФ 4 + З 2
- Збалансувати ці окислювально-відновні реакції методом половини реакції.
- Са + Н + → Са 2 + Н 2
- Sn 2 + → Sn + Sn 4 + (Підказка: обидві половинні реакції почнуться з одного і того ж реагенту.)
- Збалансувати ці окислювально-відновні реакції методом половини реакції.
- Фт 3 + Сн 2 + → Сб + Сн 4 +
- Pb 2 + → Pb + Pb 4 + (Підказка: обидві половинні реакції почнуться з одного і того ж реагенту.)
- Збалансувати ці окислювально-відновні реакції методом половини реакції.
- Na+ Hg 2 Сл 2 → NaCl+ Hg
- Ал 2 О 3 + С → Аль + СО 2
- Збалансувати ці окислювально-відновні реакції методом половини реакції.
- Br − + I 2 → I − + Br 2
- КрСл 3 + Ф 2 → КрФ 3 + Сл 2
- Збалансувати ці окислювально-відновні реакції, які відбуваються у водному розчині. Використовуйте будь-які види, отримані з води, необхідні; може бути більше одного правильного збалансованого рівняння.
- Cu + НІ 3 − → Су 2 + + НІ 2
- Фе + МН 4 − → Фе 3 + Мп
- Збалансувати ці окислювально-відновні реакції, які відбуваються у водному розчині. Використовуйте будь-які види, отримані з води, необхідні; може бути більше одного правильного збалансованого рівняння.
- Кро 3 + Ні 2 + → Кр 3 + Ni 3 +
- СО 4 + С 2 Н 4 → Ос + СО 2
- Збалансувати ці окислювально-відновні реакції, які відбуваються у водному розчині. Використовуйте будь-які види, отримані з води, необхідні; може бути більше одного правильного збалансованого рівняння.
- КЛО − + Ti 2 + → Ti 4 + + Сл −
- рН 3 − + вік → Аг + + рН 2
- Збалансувати ці окислювально-відновні реакції, які відбуваються у водному розчині. Використовуйте будь-які види, отримані з води, необхідні; може бути більше одного правильного збалансованого рівняння.
- Н 2 О 2 + НІ → Н 2 О 3 + Н 2 О
- ВО 2 + НІ → V 3+ НІ 2
- Поясніть, чому це хімічне рівняння не збалансоване, і збалансуйте його, якщо його можна врівноважити: Cr 2 + Cl 2 → Cr 3 + 2Cl −
- Поясніть, чому це рівняння не збалансовано, і збалансуйте його, якщо його можна врівноважити: O 2 + 2H 2 O + Br 2 → 4OH − + 2Br −
Відповіді
-
- 2Н+ Ф 2 → 2НаФ
- Всі 2 О 3 + 3Н 2 → 2Ал + 3Н 2 О
-
- СН 4 + 2О 2 → СО 2 + 2Н 2 О
- 2П 2 О 5 + 6Сл 2 → 4ПКл 3 + 5О 2
-
- Са + 2Н + → Са 2 + Н 2
- 2Сн 2 + → Сн + Сн 4 +
-
- 2Na+ Hg 2 Сл 2 → 2NaCl + 2Hg
- 2Ал 2 О 3 + 3С → 4Ал + 3СО 2
-
- 4H + Cu + 2NO 3 − → Cu 2 + 2NO 2 + 2H 2 O в кислому розчині; 2H 2 O + Cu + 2NO 3 − → Cu 2 + 2NO 2 + 4OH − у базовому розчині
- 24H + 3MnO 4 − + 7Fe → 7Fe 3 + 3Mn + 12H 2 O в кислому розчині; 12H 2 O + 3MnO 4 − + 7Fe → 7Fe 3 + 3Mn + 24OH − у базовому розчині
-
- 2H + ClO − + Ti 2 + → Cl − + H 2 O + Ti 4+ в кислому розчині; Н 2 O + ClO − + Ti 2 + → Cl − + Ti 4 + 2OH − у базовому розчині
- 2H + + BrO 3 − + Ag → BrO 2 + H 2 O + Ag + в кислому розчині; H 2 O + BrO 3 − + Ag → BrO 2 + Ag + 2OH − у базовому розчині
- Заряди не збалансовані належним чином. Правильне збалансоване рівняння 2Cr 2 + Cl 2 → 2Cr 3 + 2Cl −.
14.4: Застосування окислювально-відновних реакцій - вольтаїчні клітини
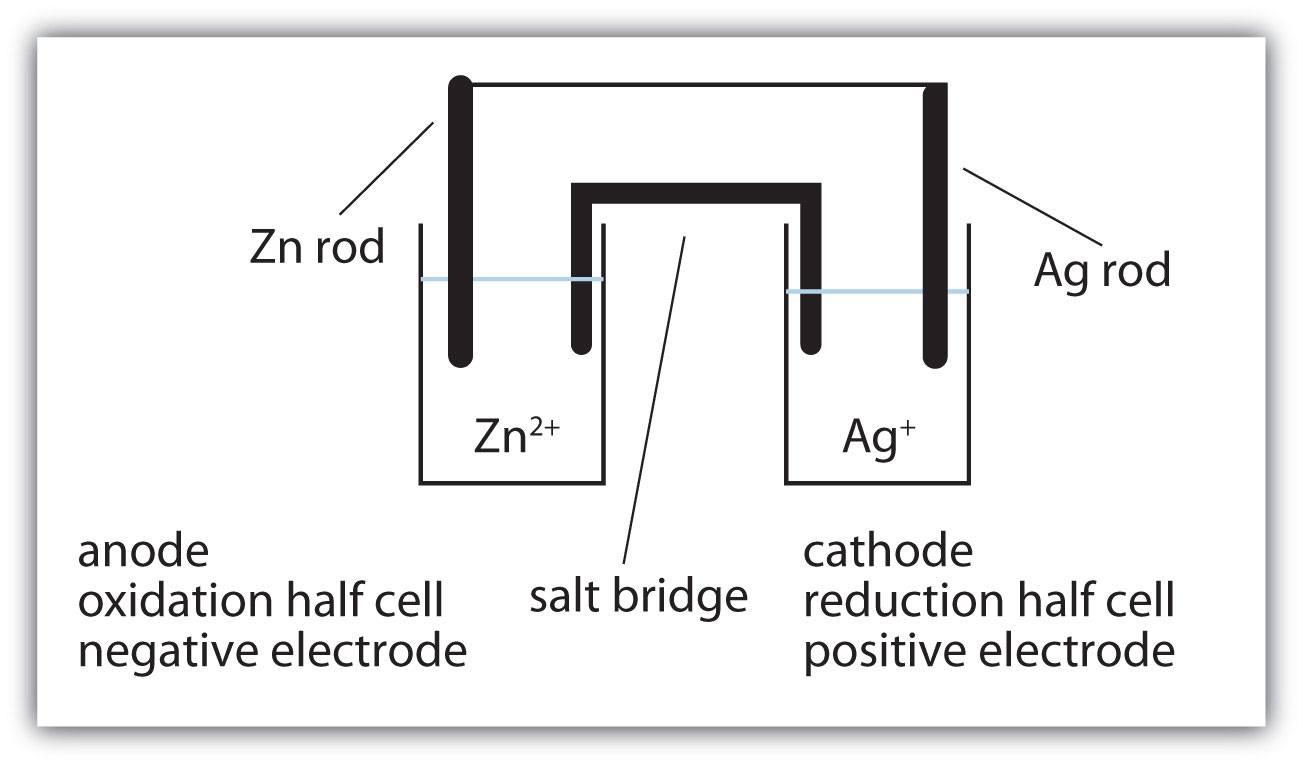
- Намалюйте вольтаїчну комірку, представлену цією реакцією, і позначте катод, анод, сольовий міст, половину осередку окислення, половину комірки відновлення, позитивний електрод та негативний електрод. Використовуйте рис.14.4.1 як орієнтир. Зн + 2Аг + → Зн 2 + 2Аг
- Намалюйте вольтаїчну комірку, представлену цією реакцією, і позначте катод, анод, сольовий міст, половину осередку окислення, половину комірки відновлення, позитивний електрод та негативний електрод. Використовуйте рис.14.4.1 як орієнтир. 3Мг + 2Cr 3 + → 3Мг 2 + 2Cr
- Яке напруга цієї половинної реакції? 2F − → Ф 2 + 2е −
- Яке напруга цієї половинної реакції? Na → Na + е −
- Яка напруга вольтаїчного елемента у вправі 1? Зверніться до таблиці 14.4.1.
- Яка напруга вольтаїчної клітини у вправі 2? Зверніться до таблиці 14.4.1.
- Збалансуйте цю окислювально-відновну реакцію і визначте її напругу. Це спонтанно? Лі + Аль → Лі + Ал 3 +
- Збалансуйте цю окислювально-відновну реакцію і визначте її напругу. Це спонтанно? Пб 2 + Ні → Пб + Ні 2 +
- Збалансуйте цю окислювально-відновну реакцію і визначте її напругу. Це спонтанно? Су 2 + Аг + Сл − → Су + AgCl
- Збалансуйте цю окислювально-відновну реакцію і визначте її напругу. Це спонтанно? Мн 2 + Br 2 → МnO 4 − + Br −
- Яка реакція являє собою реакцію катода у вправі 7? Реакція анода?
- Яка реакція являє собою реакцію катода у вправі 8? Реакція анода?
- Яка реакція являє собою реакцію катода у вправі 9? Реакція анода?
- Яка реакція являє собою реакцію катода у вправі 10? Реакція анода?
- Вольтаїчна комірка заснована на цій реакції: Ni + 2Au + → Ni 2 + 2Au; Якщо напруга комірки дорівнює 0,33 В, який стандартний потенціал відновлення Au + + e − → Au половина реакції?
- Вольтаїчна комірка заснована на цій реакції: 3Pb+ 2V 3 + → 3Pb 2 + 2V; Якщо напруга комірки −0,72 В, який стандартний потенціал відновлення V 3+ + 3e − → V половинна реакція?
- Які види окислюються і які види відновлюються в сухокамері?
- Які види окислюються і які види відновлюються в лужній батареї?
- Які види окислюються і які види зменшуються в акумуляторі з оксидом срібла?
- Які види окислюються і які види зменшуються в свинцевому акумуляторі?
- Виходячи з даних таблиці 14.4.1, яку батарею найвищої напруги ви можете сконструювати?
- Виходячи з даних таблиці 14.4.1, яку батарею найнижчої напруги ви можете сконструювати? (Це може бути складніше відповісти, ніж вправа 21.)
Відповіді
- −2.87 В
-
1.56 В
-
3Li + Al → 3Li + Al 3 +; −1,39 В; не спонтанно
-
Cu 2 + 2Аг + 2Сл − → Cu + 2AgCl; 0,12 В; спонтанний
-
катодна реакція: Li + e − → Li; анодна реакція: Al → Al 3 + 3e −
-
реакція катода: Cu 2 + + 2e − → Cu; реакція анода: Ag + Cl − → AgCl + e −
-
0,08 В
-
окислений: Zn; відновлений: Mn
-
окислений: Zn; відновлений: Ag
-
5,92 В від реакції F 2 і Li
14.5: Електроліз
- Визначте електролітичну комірку.
- Чим робота електролітичного елемента відрізняється від вольтаїчного елемента?
- Перерахуйте не менше трьох елементів, які виробляються електролізом.
- Напишіть половинні реакції на електроліз елементів, перерахованих у вправі 3.
- Виходячи з таблиці 14.4.1, яку напругу потрібно подавати на електролітичний елемент для гальванізації міді від Cu 2 +?
- Виходячи з таблиці 14.4.1, яку напругу потрібно подавати на електролітичний елемент для гальванізації алюмінію з Al 3 +?
Відповіді
- електрохімічна комірка, в якій заряд змушений через і відбувається неспонтанна реакція
-
будь-які три з наступних: Al, K, Li, Na, Cl 2 або Mg
-
0.34 В
Додаткові вправи
- Окислення колись визначалося як хімічне додавання кисню до речовини. Використовуйте цю реакцію, щоб стверджувати, що це визначення відповідає сучасному визначенню окислення: 2Mg+ O 2 → 2MgO
- Редукція колись визначалася як хімічне додавання водню до речовини. Використовуйте цю реакцію, щоб стверджувати, що це визначення узгоджується з сучасним визначенням редукції: C 2 H 2 + 2H 2 → C 2 H 6
- Призначте числа окислення атомам в кожній речовині.
- Кр (криптон)
- тетрафторид криптону (KrF 4)
- диоксиген дифторид (O 2 F 2)
- Призначте числа окислення атомам в кожній речовині.
- гідрид літію (LiH)
- перекис калію (К 2 О 2)
- фторид калію (KF)
- Атоми N можуть мати широкий діапазон чисел окислення. Призначте числа окислення для атома N в кожному з'єднанні, всі з яких є відомими сполуками.
- N 2 З 5
- N 2 З 4
- НІ 2
- НІ
- Н 2 Ч 4
- NH 3
- Атоми Cr можуть мати широкий діапазон чисел окислення. Призначте числа окислення атома Cr в кожному з'єднанні, всі з яких є відомими сполуками.
- Na 2 Кро 4
- Na 2 Кр 2 О 7
- CrF 5
- CrCl 3
- CrCl 2
- Збалансувати цю окислювально-відновну реакцію шляхом перевірки: S 8 + O 2 → SO 2
- Збалансувати цю окислювально-відновну реакцію шляхом огляду: C 18 H 38+ O 2 → CO 2 + H 2 O
- Збалансувати цю окислювально-відновну реакцію методом половини реакції, припускаючи кислий розчин: Cr 2 O 7 2 − + Fe → Cr 3 + Fe 3 +
- Збалансуйте окислювально-відновну реакцію у вправі 9 методом половини реакції, припускаючи базове рішення.
- Іон уранілу (UO 2 2 +) є досить стабільним іоном урану, який вимагає сильних редукторів для подальшого зменшення числа окислення урану. Збалансуйте цю окислювально-відновну реакцію, використовуючи метод половини реакції, припускаючи кислий розчин. УО 2 2+ ХН 3 → У + Н 2
- Збалансуйте окислювально-відновну реакцію у вправі 11 методом половини реакції, припускаючи базове рішення.
- Метал цинку можна розчиняти кислотою, яка містить іони Н +. Продемонструйте, що це узгоджується з тим, що дана реакція має спонтанне напруга: Zn + 2H + → Zn 2 + H 2
- Метал міді не може бути розчинений кислотою, яка містить іони Н +. Продемонструйте, що це узгоджується з тим, що дана реакція має неспонтанне напруга: Cu + 2H + → Cu 2 + H 2
- Реакція диспропорції виникає, коли один реагент одночасно окислюється і відновлюється. Збалансувати і визначити напругу цієї реакції диспропорції. Скористайтеся даними таблиці 14.4.1 - Стандартні відновні потенціали напівреакцій: Cr 2 + → Cr + Cr 3 +
- Реакція диспропорції виникає, коли один реагент одночасно окислюється і відновлюється. Збалансувати і визначити напругу цієї реакції диспропорції. Скористайтеся даними таблиці 14.4.1 - Стандартні відновні потенціали напівреакцій: Fe 2 + → Fe + Fe 3 +
- Якою буде загальна реакція на паливний елемент, який використовує CH 4 як паливо?
- Якою буде загальна реакція на паливний елемент, який використовує бензин (загальна формула C 8 H 18) як паливо?
- Коли NaCl піддається електролізу, на катоді з'являється натрій. Чи є визначення катода таким же для електролітичного елемента, як і для вольтаїчного елемента?
- Коли NaCl піддається електролізу, на аноді з'являється хлор. Чи є визначення анода таким же для електролітичного елемента, як і для вольтаїчного елемента?
- Нагорода покривається чистим золотом перед тим, як вручається одержувачу. Якщо площа нагороди становить 55,0 см 2 і буде покрита 3,00 мкм Au, яка маса Au буде нанесена на нагороду? Щільність Au становить 19,3 г/см 3.
- Одиниця електричного заряду називається кулоном (С). Потрібно 96 500 кулонів заряду, щоб зменшити 27,0 г Al з Al 3 + до металу Al. При 1,040 см 3, скільки кулонів заряду було потрібно для зменшення алюмінію в кришці вашингтонського монумента, припускаючи, що шапка чиста Аль? Щільність Al становить 2,70 г/см 3.
Відповідь
Оскільки кисень додається до магнію, він окислюється. У сучасних умовах атоми Mg втрачають електрони і окислюються, тоді як електрони йдуть до атомів O.
- Кр: 0
- Кр: +4; Ф: −1
- O: +1; F: −1
- +5
- +4
- +4
- +2
- −2
- −3
С 8 + 8О 2 → 8СО 214Н + Кр 2 О 7 2 − + 2Фе → 2Кр 3 + 7Н 2 О + 2Фе 3 +
6ХН 3 + УО 2 2 + → У + 2Н 2 О + 9Н 2 + 2Н +
Напруга реакції становить +0,76 В, що має на увазі спонтанну реакцію.
3Кр 2 + → Кр + 2Кр 3 +; −0,50 В
СН 4 + 2О 2 → СО 2 + 2Н 2 О
так тому що зниження відбувається на катоді
0,318 г