18.7: Структура вторинного білка
- Завдання 1
- Завдання 2
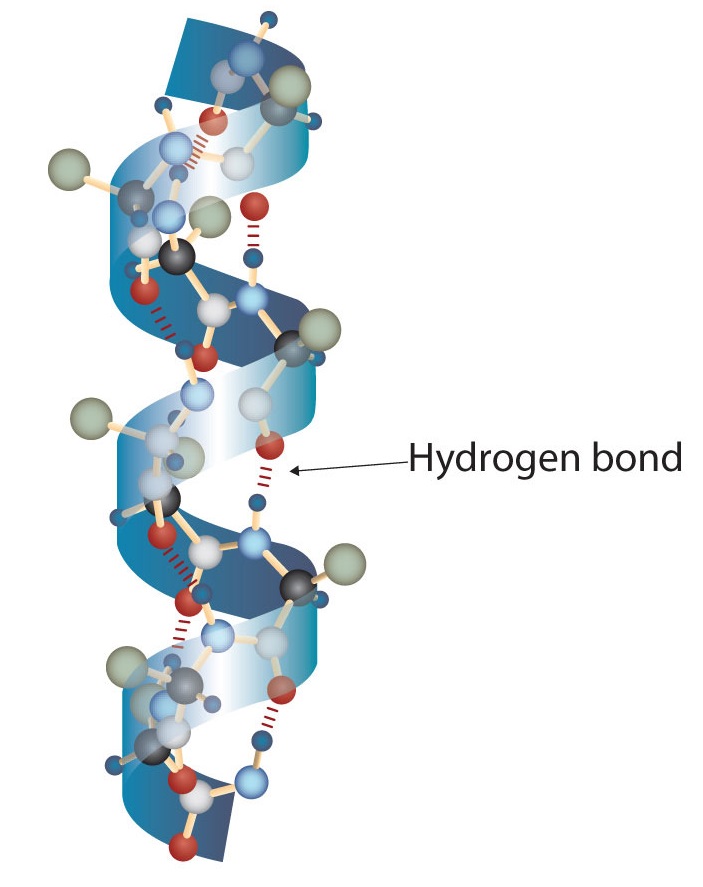
Молекула білка - це не випадковий клубок поліпептидних ланцюгів. Натомість ланцюги розташовані в унікальних, але специфічних конформаціях. Термін вторинна структура відноситься до фіксованого розташування поліпептидного хребта. На підставі рентгенівських досліджень Лінус Полінг і Роберт Корі постулювали, що певні білки або порції білків скручуються в спіраль або спіраль. Ця спіраль стабілізується внутрішньоланцюговим водневим зв'язком між атомом карбонільного кисню однієї амінокислоти і амідним атомом водню чотирма амінокислотами вгору по ланцюгу (розташований на наступному витку спіралі) і відома як правостороння α-спіраль. Дані рентгенівського випромінювання вказують на те, що ця спіраль робить один оборот на кожні 3,6 амінокислоти, і бічні ланцюги цих амінокислот проектують назовні від згорнутого хребта (рис.18.7.1). α-кератини, що містяться у волоссі та шерсті, є виключно α-спіральними в конформації. Деякі білки, такі як гамма-глобулін, хімотрипсин і цитохром с, мають мало або взагалі не мають спіральної структури. Інші, такі як гемоглобін і міоглобін, є спіральними в певних регіонах, але не в інших.
Іншим поширеним типом вторинної структури, званої β-плісированою конформацією листа, є листоподібне розташування, в якому дві або більше розширених поліпептидних ланцюгів (або окремих областей на одному ланцюзі) вирівнюються поруч. Вирівняні сегменти можуть працювати як паралельно, так і антипаралельно - тобто N-клеми можуть стикатися в одному напрямку на сусідніх ланцюгах або в різних напрямках - і з'єднані міжланцюговим водневим зв'язком (Рисунок18.7.3). β-плісировані лист особливо важливий в структурних білків, таких як фіброин шовку. Він також спостерігається в порціях багатьох ферментів, таких як карбоксипептидаза А та лізоцим.
