18.10: Хімічні властивості білків
- Page ID
- 21846
- Завдання 1
- Завдання 2
Гідроліз білка
денатурація білка
Високоорганізовані структури білків - воістину шедеври хімічної архітектури. Але високоорганізовані структури, як правило, мають певну делікатність, і це стосується білків. Денатурація - термін, який використовується для будь-якої зміни тривимірної структури білка, що робить його нездатним виконувати покладену йому функцію. Денатурований білок не може виконати свою роботу. (Іноді денатурацію прирівнюють до осадження або згортання білка; наше визначення трохи ширше.) Найрізноманітніші реагенти та умови, такі як тепло, органічні сполуки, зміни рН та іони важких металів можуть спричинити денатурацію білка (рис.\(\PageIndex{1}\)).
| Метод | Вплив на білкову структуру |
|---|---|
| Тепло вище 50° C або ультрафіолетове (УФ) випромінювання | Тепло або УФ-випромінювання постачає кінетичну енергію молекулам білка, змушуючи їх атоми швидше вібрувати і порушуючи відносно слабкі сили водневого зв'язку та дисперсії. |
| Використання органічних сполук, таких як етиловий спирт | Ці сполуки здатні вступати в міжмолекулярний водневий зв'язок з білковими молекулами, порушуючи внутрішньомолекулярний водневий зв'язок всередині білка. |
| Солі іонів важких металів, таких як ртуть, срібло та свинець | Ці іони утворюють міцні зв'язки з карбоксилатними аніонами кислих амінокислот або SH груп цистеїну, порушуючи іонні зв'язки і дисульфідні зв'язки. |
| Алкалоїдні реагенти, такі як дубильна кислота (використовується в дубильній шкірі) | Ці реагенти поєднуються з позитивно зарядженими аміногрупами в білках, щоб порушити іонні зв'язки. |
Той, хто смажив яйце, спостерігав денатурацію. Прозорий яєчний білок стає непрозорим, коли альбумін денатурує і згортається. Ніхто ще не змінив цей процес. Однак, враховуючи належні обставини і достатню кількість часу, білок, який розгорнувся в досить щадних умовах, може знову розгортатися і може знову проявити біологічну активність (рис.\(\PageIndex{8}\)). Такі дані говорять про те, що принаймні для цих білків первинна структура визначає вторинну і третинну структуру. Дана послідовність амінокислот, здається, приймає своє особливе тривимірне розташування природно, якщо умови правильні.
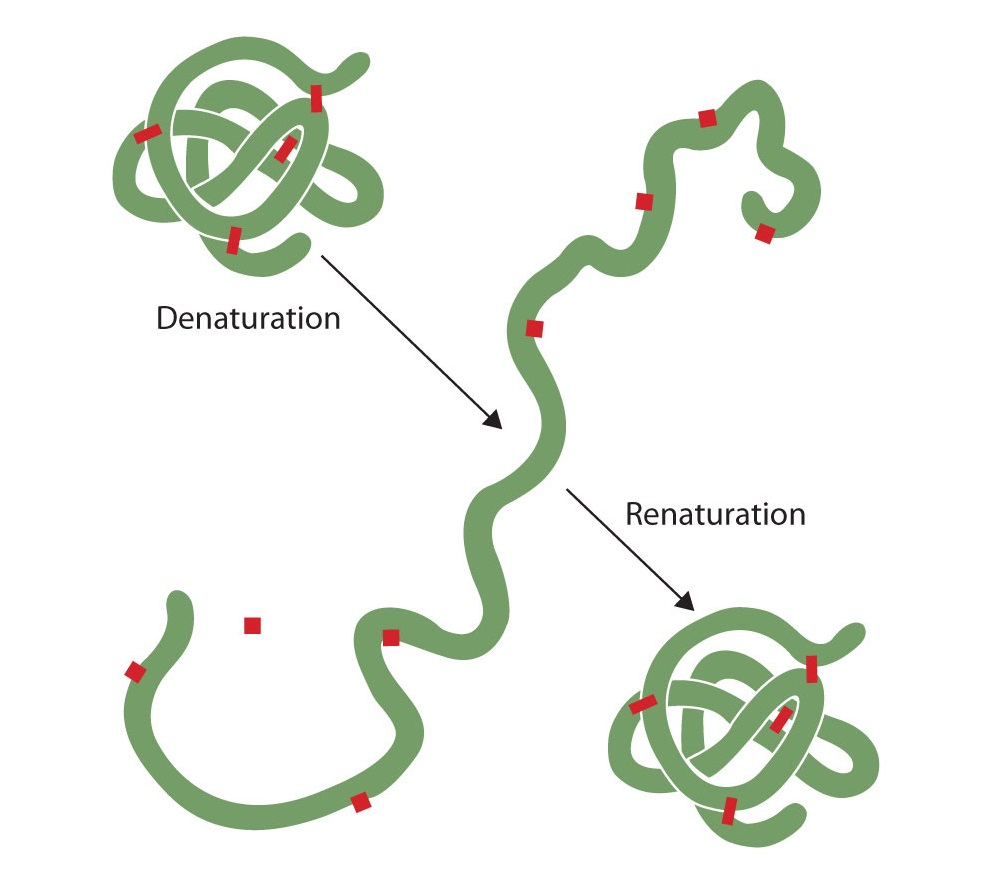
Первинні структури білків досить міцні. Взагалі для гідролізу пептидних зв'язків потрібні досить енергійні умови. Однак на вторинному через четвертинний рівні білки досить вразливі до атаки, хоча вони різняться своєю вразливістю до денатурації. Делікатно складені кулясті білки набагато легше денатурувати, ніж жорсткі волокнисті протеїни волосся і шкіри.