18,8: третинна білкова структура
- Page ID
- 21851
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \) \( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)\(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\) \(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\)
- Завдання 1
- Завдання 2
Третинна структура відноситься до унікальної тривимірної форми білка в цілому, яка виникає в результаті згортання і згинання білкового хребта. Третинна структура тісно пов'язана з правильним біохімічним функціонуванням білка. \(\PageIndex{1}\)На малюнку показано зображення тривимірної структури інсуліну.

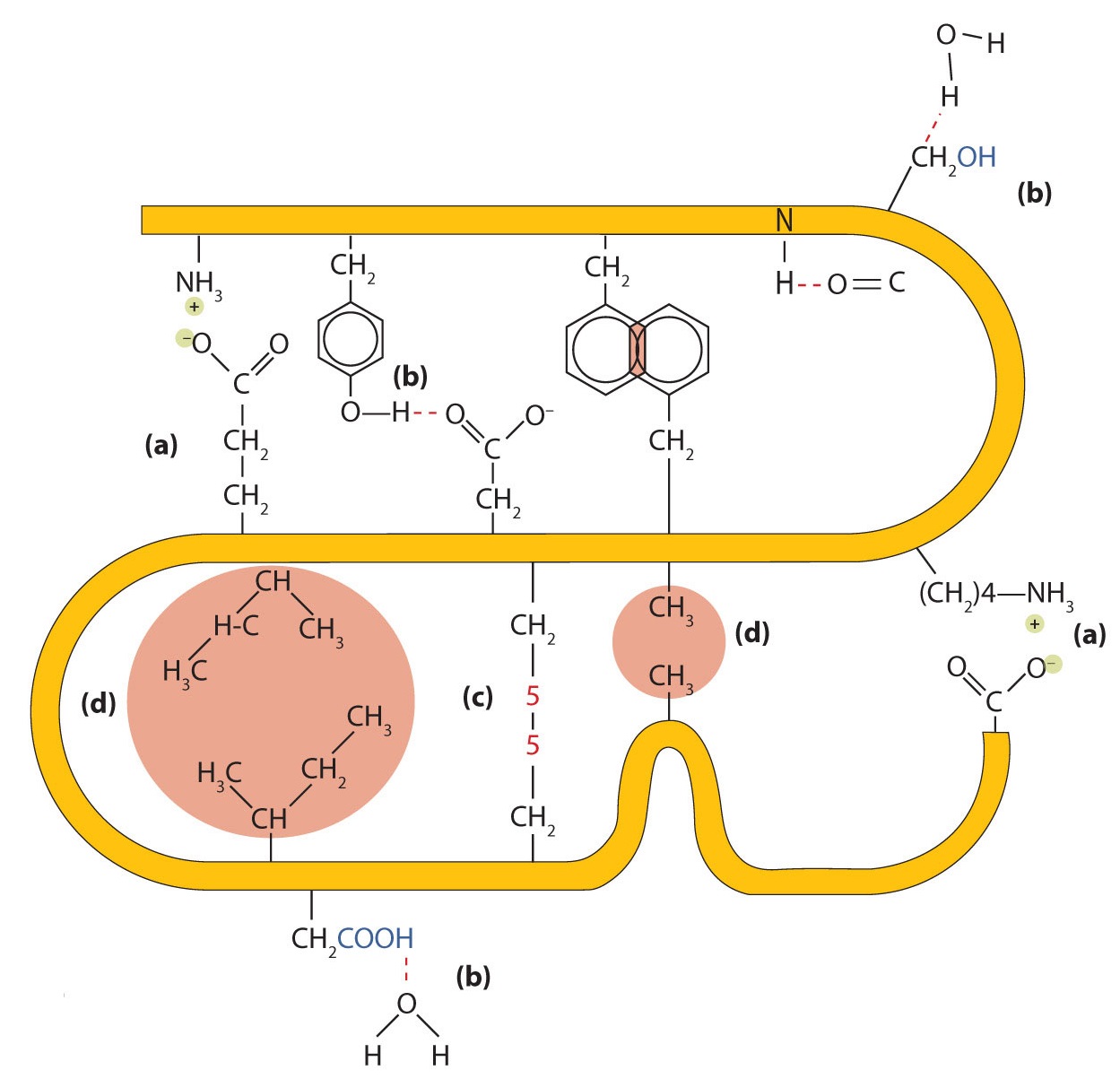
Чотири основні типи привабливих взаємодій визначають форму і стабільність третинної структури білків. Ви вивчали кілька з них раніше.
- Іонне склеювання. Іонні зв'язки виникають внаслідок електростатичних атракціонів між позитивно і негативно зарядженими бічними ланцюгами амінокислот. Наприклад, взаємне тяжіння між іоном карбоксилату аспарагінової кислоти та іоном амонію лізину допомагає підтримувати певну складчасту площу білка (частина (а) малюнка\(\PageIndex{5}\)).
- Водневе зв'язування. Водневий зв'язок утворюється між високоелектронегативним атомом кисню або атомом азоту та атомом водню, приєднаним до іншого атома кисню або атомом азоту, таким як ті, що знаходяться в бічних ланцюгах полярних амінокислот. Водневе зв'язування (а також іонні атракціони) надзвичайно важливо як у внутрішньо-, так і в міжмолекулярних взаємодіях білків (частина (b) рисунка\(\PageIndex{5}\)).
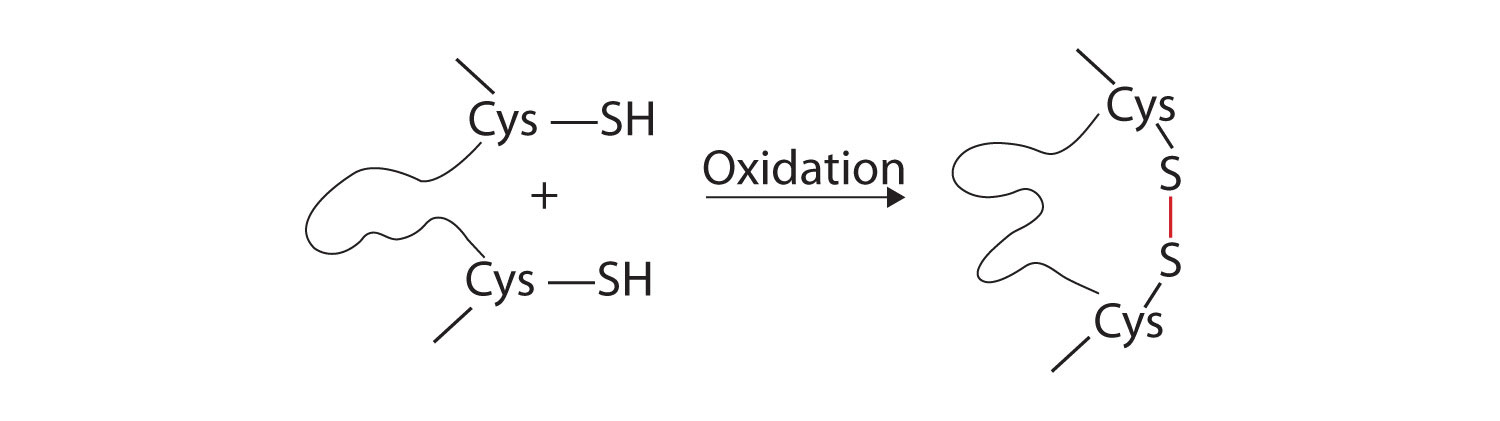
- Дисульфідні зв'язки. Дві одиниці амінокислоти цистеїну можуть бути зведені близько один до одного, коли молекула білка складається. Подальше окислення і зчеплення атомів сірки в високореактивних сульфгідрильних (SH) групах призводить до утворення цистину (частина (с) рис.\(\PageIndex{2}\)). Внутрішньоланцюгові дисульфідні зв'язки знаходяться в багатьох білках, включаючи інсулін (жовті батончики на малюнку\(\PageIndex{1}\)) і надають сильну стабілізуючу дію на третинну структуру.
- Сили дисперсії. Сили дисперсії виникають, коли нормально неполярний атом стає на мить полярним через нерівномірний розподіл електронів, що призводить до миттєвого диполя, який індукує зсув електронів в сусідньому неполярному атомі. Сили дисперсії слабкі, але можуть бути важливими, коли інші типи взаємодій або відсутні, або мінімальні (частина (d) малюнка\(\PageIndex{2}\)). Це стосується фіброїну, основного білка в шовку, в якому висока частка амінокислот в білку мають неполярні бічні ланцюги. Термін гідрофобна взаємодія часто використовується як синонім сил дисперсії. Гідрофобні взаємодії виникають через те, що молекули води беруть участь у зв'язку водню з іншими молекулами води (або групами в білках, здатних до водневого зв'язку). Оскільки неполярні групи не можуть займатися водневим зв'язком, білок складається таким чином, що ці групи закопуються у внутрішню частину білкової структури, мінімізуючи їх контакт з водою.