2.5: Деякі характеристики різних груп
Цілі навчання
- Опишіть, як деякі характеристики елементів співвідносяться з їх позиціями в таблиці Менделєєва.
Періодична таблиця корисна для розуміння атомних властивостей, які показують періодичні тенденції. Періодичні тенденції - це специфічні закономірності, які присутні в періодичній таблиці, які ілюструють різні аспекти певного елемента, включаючи його розмір та його електронні властивості. Основні періодичні тенденції включають атомний радіус, температуру плавлення, серед багатьох інших властивостей, як ми обговоримо. Періодичні тенденції, що виникають при розташуванні таблиці Менделєєва, надають хімікам безцінний інструмент для швидкого прогнозування властивостей елемента. Ці тенденції існують через подібну атомну структуру елементів у межах відповідних сімейств груп або періодів, а також через періодичну природу елементів.
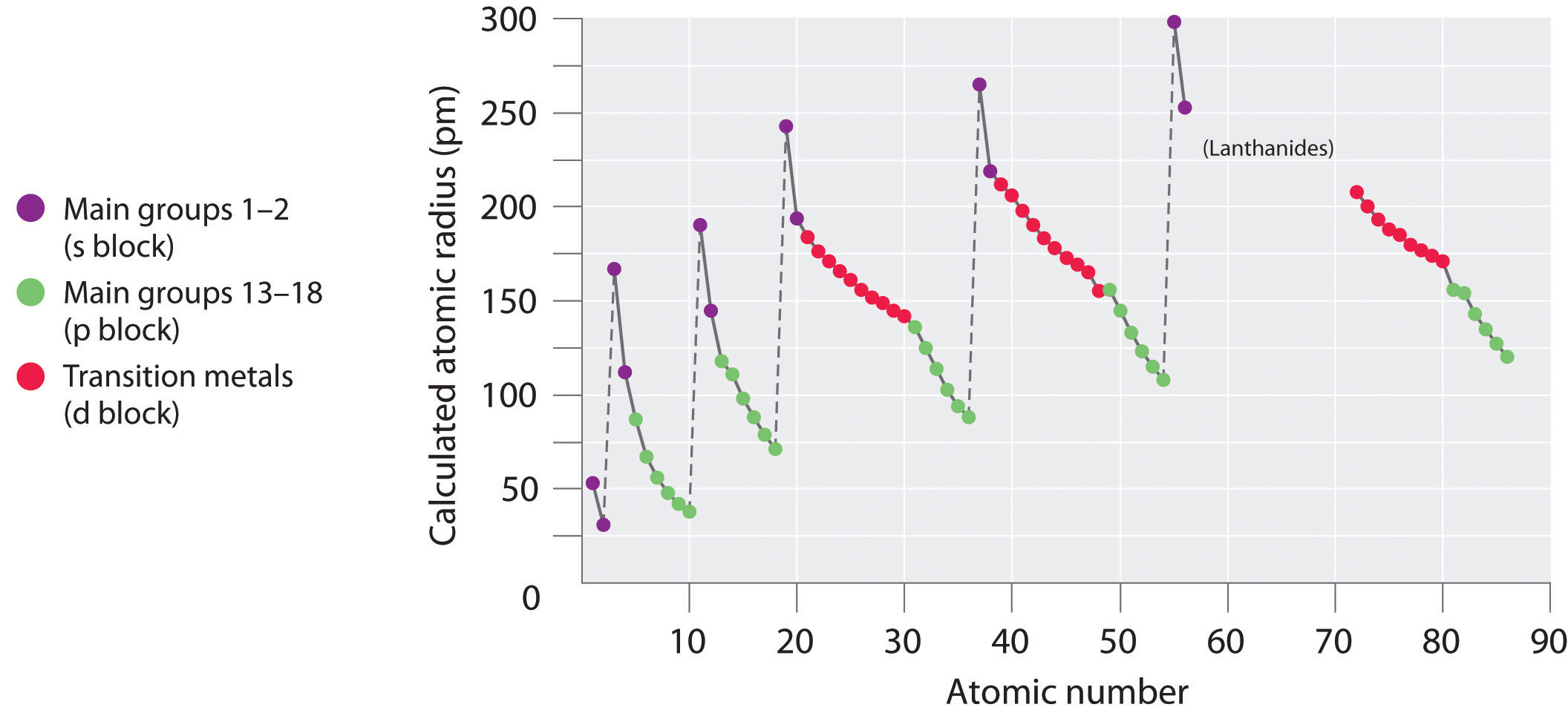
Одним з важливих атомних властивостей є атомний радіус, який є мірою розміру атома, зазвичай відстані від ядра до вихідної електронної оболонки. Однак, оскільки ця межа не є чітко визначеною, існує безліч визначень атомного радіуса. Незалежно від використовуваного визначення, чітка періодична тенденція може спостерігатися при нанесенні атомного радіуса проти атомного номера (рис.2.5.1). Радіуси, як правило, зменшуються вздовж кожного рядка таблиці і збільшуються вниз кожної групи. Радіус різко збільшується між благородним газом в кінці кожного періоду і лужним металом на початку наступного періоду. Найбільші атоми знаходяться в лівому нижньому кутку таблиці Менделєєва, а найменші - у верхньому правому куті.
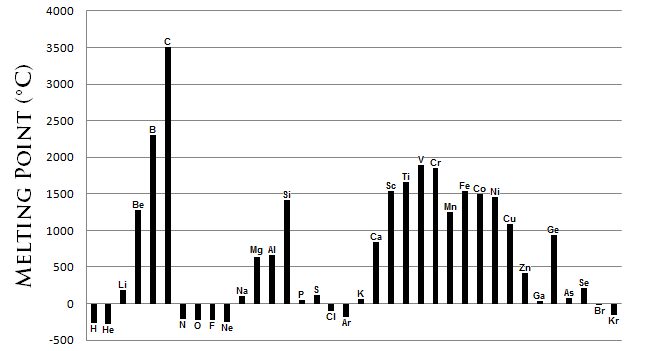
Температура плавлення - це метрика енергії, необхідної для перетворення твердої фази речовини в рідину. Як правило, чим міцніше зв'язок між атомами елемента, тим більше енергії потрібно для розриву цього зв'язку. Точки плавлення демонструють порівнянні, хоча і більш складні, періодичні тенденції, що спостерігаються в атомних радіусах (рис.2.5.2). Ключовою особливістю цих тенденцій є:
- Метали, як правило, мають високу температуру плавлення.
- Більшість неметалів мають низькими температурами плавлення.
- Неметалевий вуглець має найвищу температуру плавлення всіх елементів. Напівметалевий бор також має високу температуру плавлення.
Тенденції атомних радіусів і температур плавлення (та інших хімічних і фізичних властивостей елементів) можна пояснити теорією електронної оболонки атома, розглянутою в наступних розділах.
Характеристика елементів за групами
Таблиця Менделєєва влаштована так, що елементи з подібною хімічною поведінкою знаходяться в одній групі. Хіміки часто роблять загальні твердження про властивості елементів в групі, використовуючи описові назви з історичним походженням. Наприклад, елементи групи 1 відомі як лужні метали, група 2 - лужноземельні метали, група 17 - галогени, а група 18 - благородні гази.
- Група 1: Лужні метали - літій (Li), натрій (Na), калій (K), рубідій (Rb), цезій (Cs) та францій (Fr) є м'якими, блискучими та високореактивними металами. Сполуки лужних металів поширені в природі та повсякденному житті. Одним із прикладів є кухонна сіль (хлорид натрію); сполуки літію використовуються в мастилах, в батареях та як ліки для лікування пацієнтів, які проявляють маніакально-депресивну або біполярну поведінку. Хоча літій, рубідій і цезій порівняно рідкісні в природі, а францій настільки нестабільний і високорадіоактивний, що існує лише в слідових кількостях, натрій і калій є сьомим і восьмим за кількістю елементів земної корі відповідно. Водень унікальний тим, що він, як правило, поміщений в групу 1, але це не метал.
- Група 2: Лужноземельні метали - берилій (Be), магній (Mg), кальцій (Ca), стронцій (Sr), барій (Ba) та радій (Ra) - блискучі, блідо-білі, дещо реактивні метали. Берилій, стронцій і барій зустрічаються рідко, а радій нестійкий і високорадіоактивний. На відміну від цього, кальцій і магній є п'ятим і шостим за поширеністю елементів на Землі відповідно; вони знаходяться у величезних родовищах вапняку та інших мінералів.
- Група 17: Галогени - фтор (F), хлор (Cl), бром (Br), йод (I) та астатин (At) є неметалами. Назва галогену походить від грецьких слів «формування солі», що відображає, що всі галогени легко реагують з металами, утворюючи сполуки, такі як хлорид натрію та хлорид кальцію (використовується в деяких областях як дорожня сіль).
- Група 18: Благородні гази - гелій (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) та радон (Rn) - це гази кімнатної температури та тиску. Оскільки благородні гази складаються лише з одиночних атомів, їх називають одноатомними. Через відсутність у них реактивності протягом багатьох років їх називали інертними газами або рідкісними газами. Однак перші хімічні сполуки, що містять благородні гази, були підготовлені в 1962 році. Хоча благородні гази є відносно незначними складовими атмосфери, природний газ містить значну кількість гелію. Через низьку реакційну здатність аргон часто використовується як нереактивна (інертна) атмосфера для зварювання і в лампочках. Червоне світло, що випромінюється неоном в газорозрядній трубці, використовується в неонових вогнях.
До вашого здоров'я: Радон
Радон - це невидимий благородний газ без запаху, який повільно виділяється з землі, особливо з гірських порід і ґрунтів, вміст урану яких високий. Оскільки це благородний газ, радон не хімічно реагує. На жаль, він радіоактивний, і підвищений вплив на нього корелює з підвищеним ризиком раку легенів.
Оскільки радон надходить із землі, ми не можемо його повністю уникнути. Більше того, оскільки він щільніший за повітря, радон має тенденцію накопичуватися в підвалах, що при неправильній вентиляції може бути небезпечним для мешканців будівлі. На щастя, спеціалізована вентиляція мінімізує кількість радону, який може збиратися. Доступні спеціальні вентиляторно-вентиляційні системи, які витягують повітря знизу цокольного поверху, перш ніж він зможе потрапити в житловий простір, і вентиляції його над дахом будинку.
Після куріння радон вважається другою за величиною причиною раку легенів у Сполучених Штатах. Американське товариство раку підраховує, що 10% всіх видів раку легенів пов'язані з впливом радону. Існує невизначеність щодо того, які рівні впливу викликають рак, а також яким точним причинним агентом може бути (або радон, або один з його продуктів розпаду, багато з яких також є радіоактивними і, на відміну від радону, не газами). Агентство з охорони навколишнього середовища США рекомендує тестувати кожен поверх нижче третього поверху на рівень радону, щоб захистити від довгострокових наслідків для здоров'я.
Приклад2.5.1: Групи
Надайте назви сімейства/груп та номери періодів (горизонтальні значення) кожного елемента.
- Лі
- Ар
- Ра
Рішення:
- Літій - лужний метал. Він розташований в періоді два.
- Аргон - благородний газ. Він розташований в періоді третій.
- Радій - лужний метал. Він розташований в періоді сьомий.
Приклад2.5.2: Класифікація елементів
Надайте імена елементів для наступних комбінацій:
- Лужний метал в періоді три.
- Галоген в період два
- Металоїд в період четвертий
- Перехідний метал у третій період
Рішення:
- Натрій
- Фтор
- Германій або миш'як
- У третьому періоді немає перехідних металів (gotcha!)
Ключові виноси
- Хімічні елементи розташовані в діаграмі, яка називається періодичною таблицею.
- Деякі характеристики елементів пов'язані з їх положенням на таблиці Менделєєва.
- Кількість валентних електронів елемента можна визначити за груповим (вертикальним стовпчиком) номером в Періодичній таблиці. Елементи з однаковою кількістю валентних електронів мають схожі хімічні властивості.