2.7: Конфігурації електронів
- Page ID
- 21968
Цілі навчання
- Опишіть, як електрони розташовані в атомі за допомогою електронних конфігурацій.
Раніше ми обговорювали поняття електронних оболонок, підоболонок, орбіталей та електронного спіна. Саме розташування електронів в оболонках і підоболонках найбільше стосується нас тут, тому ми зосередимося на цьому.
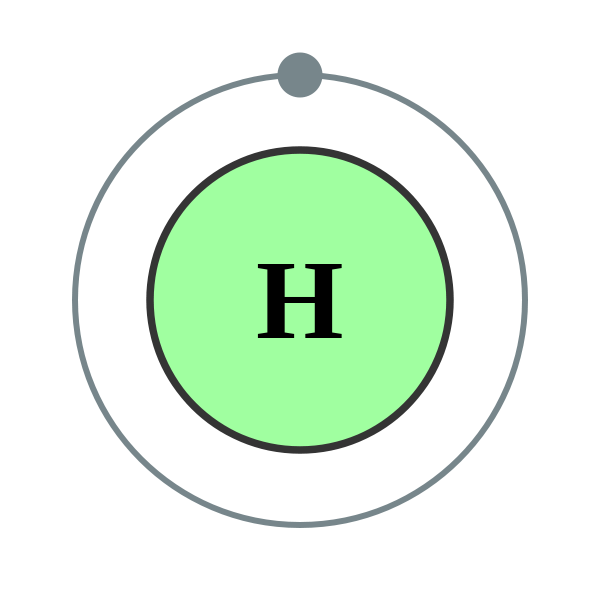
Ми використовуємо цифри, щоб вказати, в якій оболонці знаходиться електрон. Перша оболонка, найближча до ядра і з електронами найнижчої енергії, - оболонка 1. Ця перша оболонка має тільки одну підоболонку, яка маркується 1 с і може утримувати максимум 2 електронів. Ми поєднуємо мітки оболонки та підоболонки при посиланні на організацію електронів про ядро і використовуємо верхній індекс, щоб вказати, скільки електронів знаходиться в підоболонці. Таким чином, оскільки атом водню має свій єдиний електрон у підоболонці першої оболонки, ми використовуємо 1 s 1 (говорять як «один-ес-один») для опису електронного розташування або розподілу електронів у водні. Ця структура називається електронною конфігурацією і є унікальною для водню.
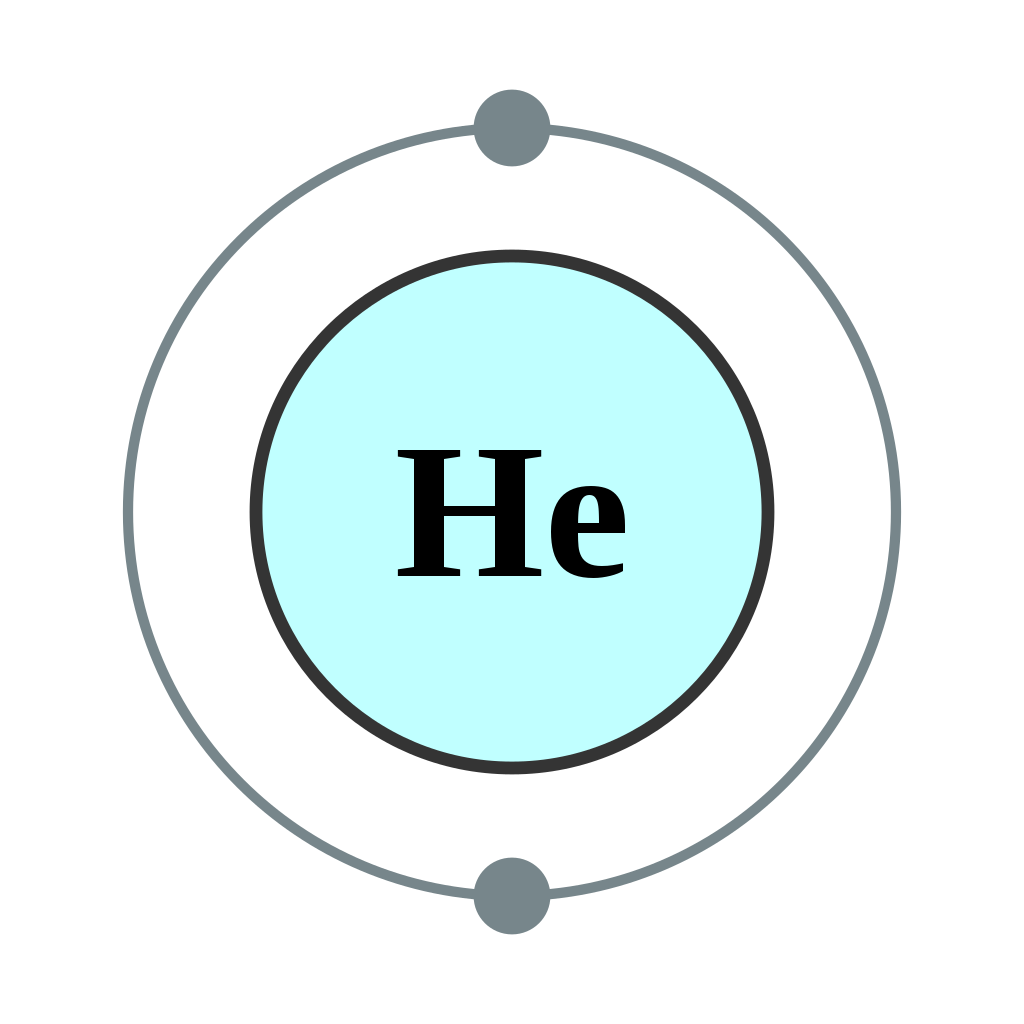
Атоми гелію мають 2 електрона. Обидва електрони вписуються в підоболонку 1 s , оскільки s підоболонки містять одну s орбітальну, яка може вмістити до 2 електронів; отже, електронна конфігурація для атомів гелію становить 1 с 2 (говорять як «один-ес-два»).
Підоболонка 1 s може містити максимум 2 електронів, тому електронна конфігурація атома літію, який має три електрони, не може бути 1 с 3. Два електрона літію можуть поміститися в підоболонку 1 с, але третій електрон повинен перейти в другу оболонку і нижчу енергетичну орбіталь, яка є орбіталлю 2 с. Тому ми запишемо електронну конфігурацію атома літію як 1 s 2 2 s 1 (говорять як «один-ес-два два ес-один»).
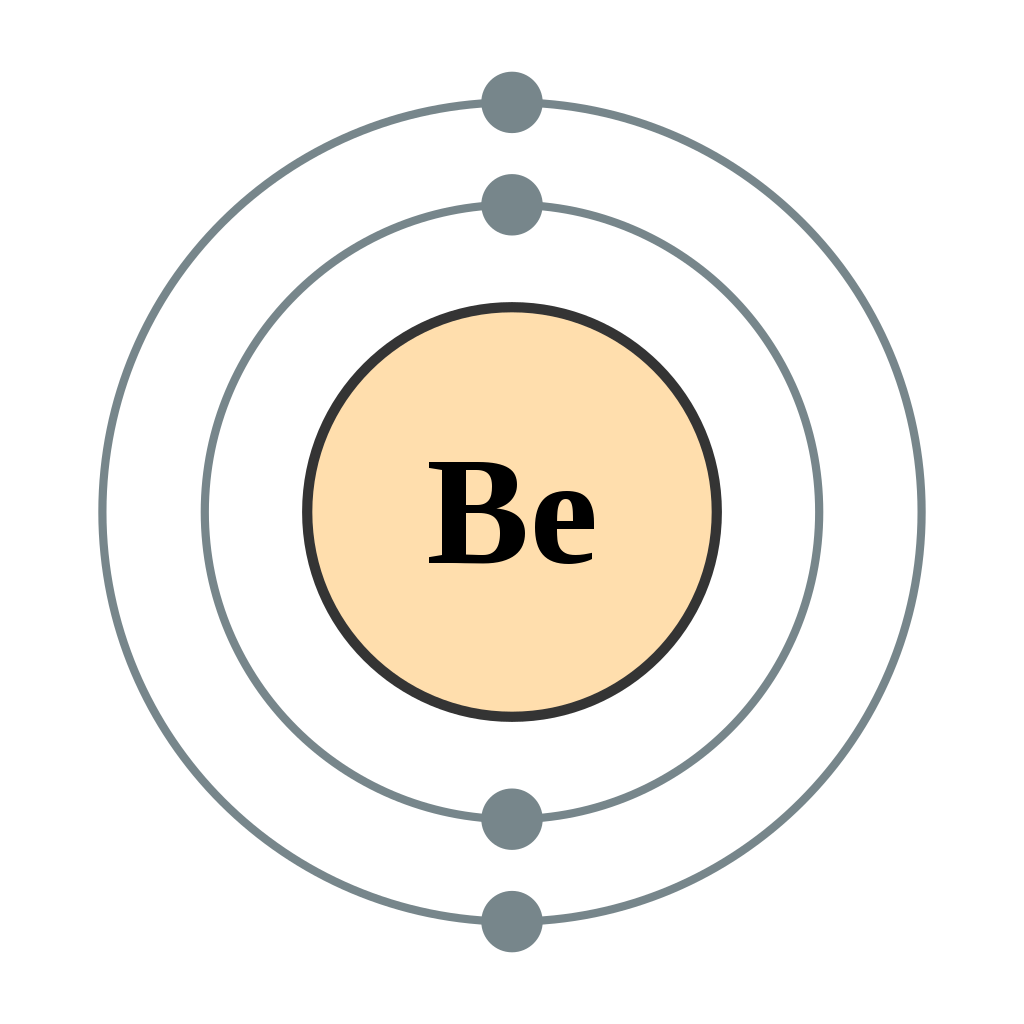
Схема оболонки для атома літію (рис.\(\PageIndex{1}\)). Найближча до ядра оболонка (перша оболонка) має 2 точки, що представляють 2 електрони за 1 с, тоді як зовнішня оболонка (2 с) має 1 електрон.

Існує набір загальних правил, які використовуються для з'ясування електронної конфігурації атомного виду: Принцип Ауфбау, Правило Гунда та Принцип виключення Паулі.
- Правило 1 (Принцип Ауфбау): Електрони займають найнижчі енергетичні орбіталі (найближчі до ядра) можливі, починаючи з 1 с, потім 2 с, 2 р і продовжуючи далі до вищої енергії (далі від ядра). Оболонки збільшуються в енергії в порядку від 1 до 2 до 3 і так далі. Усередині цих оболонок s підоболонки - найнижча енергія, за якою слідують p, потім d, потім f.
- Правило 2 (Правило Гунда): Коли електрони займають вироджені орбіталі (тобто ту саму оболонку та підоболонку), вони повинні спочатку поодинці займати (наполовину заповнити) кожну порожню орбіту в підоболонці, перш ніж двічі зайняти (повністю заповнити) їх. Крім того, найбільш стабільні результати конфігурації, коли спини паралельні (тобто всі спина вгору або всі спина вниз). Наприклад, всі три p орбіталі в p підоболонці матимуть один електрон, перш ніж одна орбітальна p містить два електрони.
- Правило 3 (Принцип виключення Паулі): Кожен електрон описується унікальним набором з чотирьох квантових чисел (унікальна адреса). Тому, якщо два електрона займають одну орбіталь, вони повинні мати різні спини. Саме тому всі орбіталі можуть утримувати максимум два електрони.
Продовжуючи по таблиці Менделєєва до наступного найбільшого атома, берилію, з 4 електронами, електронна конфігурація становить 1 с 2 2 с 2. Тепер, коли підоболонка 2 s заповнена, електрони в більших атомах, починаючи з бору, починають заповнювати підоболонку 2 р, яка може утримувати максимум шість електронів. Наступні шість елементів поступово заповнюють підоболонку 2p:
- Б: 1с 2 2с 2 2р 1
- С: 1с 2 2с 2 2р 2
- Н: 1с 2 2с 2 2р 3
- О: 1с 2 2с 2 2р 4
- Ф: 1с 2 2с 2 2р 5
- Новий: 1с 2 2 2 2 2р 6
В кінці періоду елемент неон, заповнив 2 с, і 2 р підоболонок, що завершує другу оболонку. Тепер атоми з більшою кількістю електронів тепер повинні почати третю оболонку, починаючи з підоболонки 3 s. Перші дві підоболонки третьої оболонки заповнені по порядку - наприклад, електронна конфігурація алюмінію, з 13 електронами, становить 1 с 2, 2 s 2, 2 p 6 3 s. 2 3 р 1. Однак цікава річ трапляється після заповнення підоболонки 3 p: підоболонка 4 s починає заповнюватися раніше, ніж це зробить підоболонка 3 d. Насправді точне впорядкування підоболонок ускладнюється в цей момент (після аргону, з його 18 електронами), тому ми не будемо розглядати електронні конфігурації більших атомів.
| Атомний номер | Символ елемента | Зовнішня оболонка | Конфігурація електрона | Конфігурація благородного газу |
|---|---|---|---|---|
| 1 | Ч | 1 | 1 с 1 | 1 с 1 |
| 2 | Він | 1 | 1 с 2 | 1 с 2 |
| 3 | Лі | 2 | 1 с 2 2 с 1 | [Він] 2 s 1 |
| 4 | Бути | 2 | 1 с 2 2 с 2 | [Він] 2 s 2 |
| 5 | Б | 2 | 1 с 2 2 с 2 2 п 1 | [Він] 2 с 2 2 р 1 |
| 6 | C | 2 | 1 с 2 2 с 2 2 р 2 | [Він] 2 s 2 2 р 2 |
| 7 | П | 2 | 1 с 2 2 с 2 2 п 3 | [Він] 2 s 2 2 р 3 |
| 8 | O | 2 | 1 с 2 2 с 2 2 п 4 | [Він] 2 с 2 2 р 4 |
| 9 | F | 2 | 1 с 2 2 с 2 2 п 5 | [Він] 2 s 2 2 p 5 |
| 10 | Ne | 2 | 1 с 2 2 с 2 2 п 6 | [Він] 2 s 2 2 р 6 |
| 11 | Na | 3 | 1 с 2 2 с 2 2 п 6 3 с 1 | [Нео] 3 с 1 |
| 12 | Мг | 3 | 1 с 2 2 с 2 2 п 6 3 с 2 | [Нео] 3 с 2 |
| 13 | Аль | 3 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 1 | [Нео] 3 s 2 3 р 1 |
| 14 | СІ | 3 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 2 | [Нео] 3 s 2 3 р 2 |
| 15 | Р | 3 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 3 | [Нео] 3 s 2 3 р 3 |
| 16 | S | 3 | 1 с 2 2 с 2 2 р 6 3 с 2 3 п 4 | [Нео] 3 s 2 3 р 4 |
| 17 | Cl | 3 | 1 с 2 2 с 2 2 р 6 3 с 2 3 п 5 | [Нео] 3 s 2 3 п 5 |
| 18 | Ар | 3 | 1 с 2 2 с 2 2 р 6 3 с 2 3 п 6 | [Нео] 3 s 2 3 п 6 |
| 19 | К | 4 | 1 с 2 2 с 2 2 р 6 3 с 2 3 п 6 4 с 1 | [Ар] 4 с 1 |
| 20 | Ca | 4 | 1 с 2 2 с 2 2 р 6 3 с 2 3 п 6 4 с 2 | [Ар] 4 х 2 |
Конфігурація благородного газу
Електронна конфігурація натрію становить\(1s^2 2s^2 2p^6 3s^1\) (табл.\(\PageIndex{1}\)). Перші десять електронів атома натрію - це електрони внутрішньої оболонки і конфігурація якраз цих десяти електронів точно така ж, як конфігурація елемента неон\(\left( Z=10 \right)\). Це забезпечує основу для скороченого позначення електронних конфігурацій, які називаються конфігурацією благородного газу, атом якої складається з елементарного символу останнього благородного газу до цього атома, а потім конфігурація решти електронів. Так що для натрію, ми робимо заміну\(\left[ \ce{Ne} \right]\) для\(1s^2 2s^2 2p^6\) частини конфігурації. Конфігурація благородного газу натрію стає\(\left[ \ce{Ne} \right] 3s^1\).
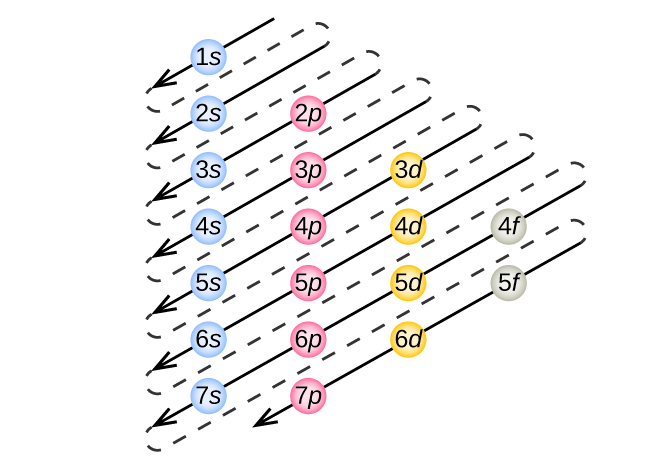
Діаграма заповнення електронів, показана нижче на малюнку,\(\PageIndex{2}\) корисна для запам'ятовування порядку, коли електрони займають оболонки та підоболонки. Хоча набагато простіше використовувати таблицю Менделєєва як орієнтир для заповнення електронів, як ви побачите в наступному розділі.
Приклад\(\PageIndex{1}\): Електронна конфігурація атомів фосфору
Використовуючи Figure\(\PageIndex{2}\) як орієнтир, напишіть електронну конфігурацію нейтрального атома фосфору. Атомний номер P дорівнює 15.
Рішення
Нейтральний атом фосфору має 15 електронів. Два електрони можуть переходити в підоболонку 1 s, 2 можуть перейти в підоболонку 2 s, а 6 - в підоболонку 2 р. Це залишає 5 електронів. З цих 5 електронів 2 можуть перейти в підоболонку 3 s, а інші 3 електрони можуть перейти в 3 p підоболонки. Таким чином, електронна конфігурація нейтральних атомів фосфору становить 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3.
Вправа\(\PageIndex{1}\): Електронна конфігурація атомів хлору
Використовуючи Рисунок\(\PageIndex{2}\) як орієнтир, напишіть електронну конфігурацію нейтрального атома хлору. Атомний номер Cl дорівнює 17.
- Відповідь
-
Нейтральний атом хлору має 17 електронів. Два електрони можуть переходити в підоболонку 1 s, 2 можуть перейти в підоболонку 2 s, а 6 - в підоболонку 2 р. Це залишає 7 електронів. З цих 7 електронів 2 можуть перейти в підоболонку 3 s, а решта 5 електронів можуть перейти в підоболонку 3 р. Таким чином, електронна конфігурація нейтральних атомів хлору становить 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5.
Орбітальні діаграми
Орбітальна діаграма - це більш наочний спосіб представити розташування всіх електронів в конкретному атомі. На орбітальній діаграмі окремі орбіталі показані у вигляді квадратів, а орбіталі в межах підрівня малюються поруч один з одним горизонтально. Кожен підрівень маркується своєю оболонкою і підрівнем. Електрони позначаються стрілками всередині квадратів. Стрілка, спрямована вгору, вказує на один напрямок обертання, а стрілка вниз вказує на інший напрямок. Діаграми заповнення орбіти водню, гелію та літію наведені на малюнку нижче.
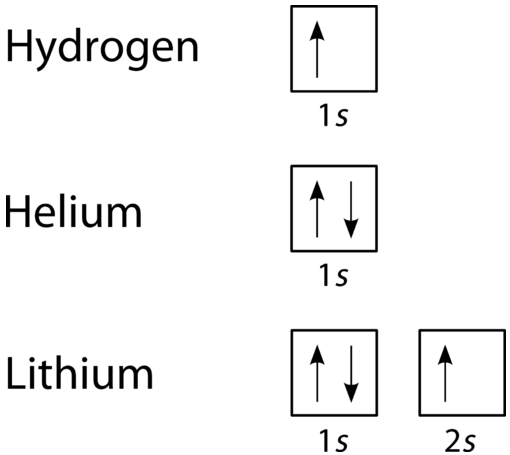
Згідно з принципом Ауфбау, підрівні та орбіталі заповнюються електронами в порядку збільшення енергії. Оскільки\(s\) підрівень складається всього з однієї орбіти, другий електрон просто з'єднується з першим електроном, як у гелію. Наступний елемент є літієм і обумовлює необхідність використання наступного наявного підрівня, тобто\(2s\).
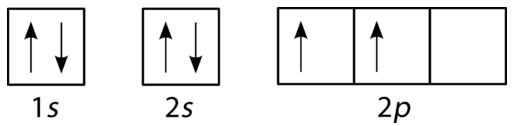
Орбітальна діаграма для вуглецю показана на рис\(\PageIndex{10}\). Є два\(2p\) електрони для вуглецю, і кожен займає свою\(2p\) орбіту (Правило Гунда).
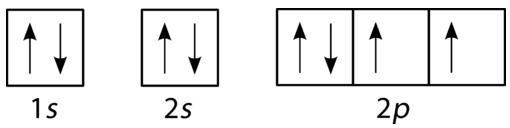
Кисень має чотири\(2p\) електрони. Після того, як кожна\(2p\) орбіталь має один електрон, четвертий електрон може бути розміщений в першій\(2p\) орбіталі зі спіном, протилежним тому, що інший електрон на цій орбіті.
Якщо ви зберігаєте свої папери в папках маніли, ви можете підібрати папку і подивитися, скільки вона важить. Якщо ви хочете знати, скільки різних паперів (статей, банківських записів або що-небудь ще ви зберігаєте в папці), вам доведеться все вийняти і порахувати. Комп'ютерний каталог, з іншого боку, говорить вам точно, скільки у вас є в кожному файлі. Ми можемо отримати таку ж інформацію про атоми. Якщо ми використовуємо діаграму орбітального заповнення, нам доведеться рахувати стрілки. Коли ми дивимося на дані електронної конфігурації, ми просто складаємо числа.
Намалюйте орбітальну діаграму заповнення вуглецю та напишіть його електронну конфігурацію.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- Атомний номер вуглецю, Z = 6
Використовуйте діаграму порядку заповнення, щоб намалювати діаграму орбітального заповнення із загальною кількістю шести електронів. Дотримуйтесь правила Гунда. Запишіть електронну конфігурацію.
Крок 2: Побудуйте діаграму.
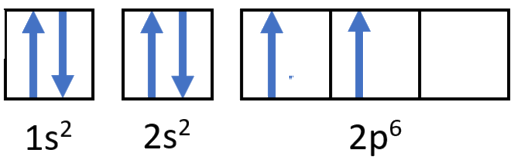
Діаграма орбітального наповнення для вуглецю.
Конфігурація електронів 1s 2 2s 2 2p 2
Крок 3: Подумайте про свій результат.
Слідом за 2s підрівнем йде 2p, а p підрівні завжди складаються з трьох орбіталей. Всі три орбіталі потрібно намалювати, навіть якщо одна або кілька незайняті. Згідно з правилом Гунда, шостий електрон входить на другий з цих p орбіталей і має такий же спін, як і п'ятий електрон.