2.1: Атомна теорія та будова атомів
Цілі навчання
- Створіть сучасну атомну теорію.
- Опишіть, як будуються атоми.
Найменший шматок елемента, який підтримує ідентичність цього елемента, називається атомом. Окремі атоми вкрай малі. Було б потрібно близько п'ятдесяти мільйонів атомів поспіль, щоб зробити лінію довжиною 1 см. Період в кінці друкованого речення має в ньому кілька мільйонів атомів. Атоми настільки малі, що важко повірити, що вся матерія зроблена з атомів - але це так.
Сучасна атомна теорія, запропонована приблизно в 1803 році англійським хіміком Джоном Далтоном, є фундаментальною концепцією, яка стверджує, що всі елементи складаються з атомів. Раніше ми визначали атом як найменшу частину елемента, який підтримує ідентичність цього елемента. Окремі атоми надзвичайно малі; навіть найбільший атом має приблизний діаметр всього 5,4 × 10 −10 м, при цьому розмір займає понад 18 мільйонів цих атомів, вишикувалися поруч, щоб дорівнювати ширині вашого мізинця (близько 1 см).
Дальтон вивчав ваги різних елементів і з'єднань. Він помітив, що матерія завжди поєднується у фіксованих співвідношеннях на основі ваги або обсягу у випадку газів. Хімічні сполуки завжди містять однакову частку елементів по масі, незалежно від кількості, що забезпечило подальшу підтримку закону Пруста певних пропорцій. Дальтон також зауважив, що може бути більше однієї комбінації двох елементів.
Зі своїх експериментів і спостережень, а також роботи однолітків свого часу Далтон запропонував нову теорію атома. Пізніше це стало відомо як атомна теорія Дальтона. Загальні принципи цієї теорії полягали в наступному:
- Вся матерія складається з надзвичайно дрібних частинок, званих атомами.
- Атоми даного елемента ідентичні за розміром, масі та іншим властивостям. Атоми різних елементів відрізняються розмірами, масою, іншими властивостями.
- Атоми не можуть бути поділені, створені або знищені.
- Атоми різних елементів можуть поєднуватися в простих цілих числових співвідношеннях, утворюючи хімічні сполуки.
- У хімічних реакціях атоми об'єднуються, відокремлюються або переставляються.
Атомна теорія Далтона була значною мірою прийнята науковим співтовариством, за винятком трьох змін. Тепер ми знаємо, що (1) атом можна розділити далі, (2) всі атоми елемента не ідентичні за масою, і (3) використовуючи методи ядерного поділу та синтезу, ми можемо створювати або руйнувати атоми, змінюючи їх на інші атоми.
Ці поняття складають основу хімії. Хоча слово атом походить від грецького слова, що означає «неподільний», ми тепер розуміємо, що самі атоми складаються з менших частин, званих субатомними частинками. Першою частиною, яку потрібно було відкрити, був електрон, крихітна субатомна частка з негативним зарядом. Його часто представляють як e −, а правий верхній індекс показує негативний заряд. Пізніше були виявлені дві більші частинки. Протон, субатомна частка з позитивним зарядом. це більш масивна (але все ж крихітна) субатомна частка з позитивним зарядом, представлена у вигляді p +. Нейтрон - це субатомна частка з приблизно тією ж масою, що і протон, але без заряду. Він представлений у вигляді n або n 0. Тепер ми знаємо, що всі атоми всіх елементів складаються з електронів, протонів і (за одним винятком) нейтронів. Таблиця2.1.1 узагальнює властивості цих трьох субатомних частинок.
| Ім'я | Символ | Маса (прибл.; г) | Маса (прибл.; аму) | Заряджати |
|---|---|---|---|---|
| Протон | р + | 1,673 × 10 −24 | 1,0073 | +1 |
| Нейтронний | п, п 0 | 1,675 × 10 −24 | 1.0087 | жоден |
| Електрон | е − | 9,19 × 10 −28 | 5,486 × 10 −4 | —1 |
Атоми і субатомні частинки настільки малі, що вимірювати їх маси в грамах не зовсім має сенсу. Більш корисною одиницею вимірювання атомної маси є одиниця атомної маси (amu), де 1 аму = 1,660539 × 10 −24 г або одна дванадцята від маси атома вуглецю-12. Як видно з таблиці вище, маса 1 протона і 1 нейтрона становить кожен 1 аму в цій системі. Вуглець-12 містить шість протонів і шість нейтронів і йому присвоюється маса рівно 12 аму.

Як влаштовані ці субатомні частинки в атомах? Вони не влаштовані навмання. Експерименти Ернеста Резерфорда в Англії в 1910-х роках вказували на ядерну модель з at oms, яка має протони та нейтрони в центральному ядрі з електронами на орбіті навколо ядра. Щодо масивні протони та нейтрони збираються в центрі атома, в області, яка називається ядром атома (множинні ядра). Електрони знаходяться поза ядром і проводять свій час на орбіті в просторі навколо ядра. (Малюнок2.1.2). Оскільки протони і нейтрони настільки масивні в порівнянні з електронами2.1.1, таблиця, майже вся маса атома міститься в ядрі.
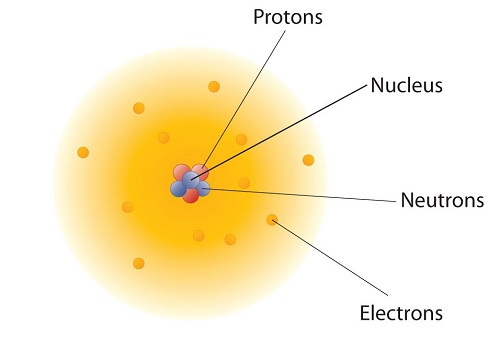
Докази атомів настільки великі, що мало хто сумнівається в їх існуванні. Насправді окремі атоми зараз регулярно спостерігаються за допомогою найсучасніших технологій. Більше того, вони навіть можуть бути використані для створення красивих зображень або, як показують дослідження IBM у відео2.1.1, управління окремими атомами може бути використано для створення анімації.
Відео2.1.1: Хлопчик і його атом - найменший у світі фільм. Хлопчик і його атом - це анімаційний короткометражний фільм із зупинкою руху 2012 року, випущений IBM Research. Фільм розповідає історію хлопчика і норовливого атома, які зустрічаються і стають друзями. На ній зображений хлопчик, який грає з атомом, який приймає різні форми. Це було зроблено шляхом переміщення молекул окису вуглецю, розглянутих за допомогою скануючого тунельного мікроскопа, пристрою, який збільшує їх у 100 мільйонів разів. Ці молекули були переміщені для створення зображень, які потім зберігалися як окремі кадри для створення фільму.
Ключові виноси
- Хімія заснована на сучасній атомній теорії, яка стверджує, що вся матерія складається з атомів.
- Самі атоми складаються з протонів, нейтронів і електронів.
- Кожен елемент має свій атомний номер, який дорівнює кількості протонів в його ядрі.
