2.3: Ізотопи та атомна вага
- Page ID
- 21981
Цілі навчання
- Поясніть, чим ізотопи відрізняються один від одного.
- Обчисліть атомну масу елемента з мас і відносних відсотків ізотопів елемента.
Ізотопи
Як було введено раніше, атоми конкретного елемента відрізняються від інших елементів їх атомним номером, (кількістю протонів). Атоми одного і того ж елемента завжди мають однакову кількість протонів, однак, кількість нейтронів може варіюватися. Ізотопи - це атоми одного і того ж елемента, які містять різну кількість нейтронів. Ця різниця в кількості нейтронів впливає на масове число (A), але не на атомний номер (Z). У хімічній лабораторії ізотопи елемента з'являються і вступають в реакцію однаково. З цієї причини важко розрізнити різні ізотопи. Навпаки, ядерники можуть ідентифікувати та відокремлювати різні типи атомних ядер. Технологія, необхідна для цього процесу, є більш складною, ніж те, що можна знайти в типовій хімічній лабораторії.
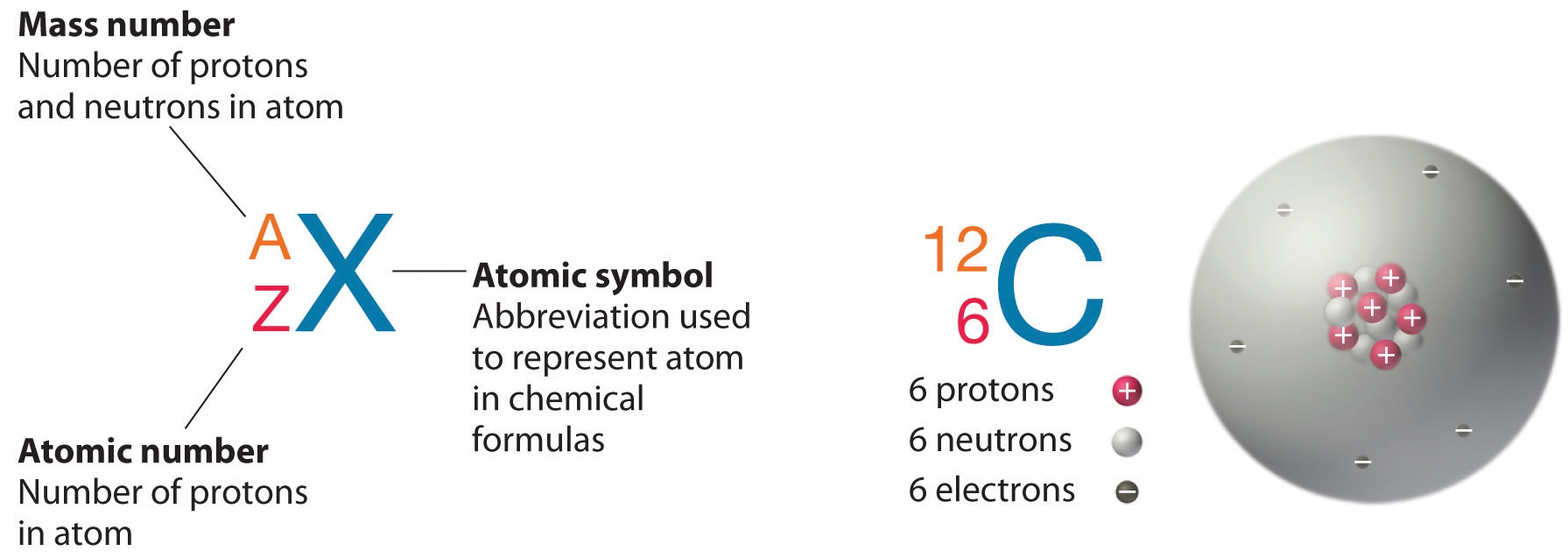
\(\PageIndex{1}\)На малюнку показано простий спосіб представлення ізотопів ядерним символом, який включає символ атома або елемента (представлений\(X\))\(A\), масове число та атомний номер\(Z\). Таким чином, для ізотопу вуглецю, який має 6 протонів і 6 нейтронів, символом є:
\[\ce{_{6}^{12}C} \nonumber\]
де\(C\) - символ вуглецю, 6 представляє атомний номер, а 12 - число маси.
Також прийнято вказувати масове число після назви елемента для позначення певного ізотопу. Вуглець-12 являє собою ізотоп вуглецю з 6 протонами і 6 нейтронами, тоді як уран-238 - ізотоп урану, який має 92 протона і 146 нейтронів.
Більшість елементів таблиці Менделєєва мають не менше двох стабільних ізотопів. Наприклад, на додаток до\(\ce{^{12}C}\), типовий зразок вуглецю містить 1,11%\(\ce{_6^{13}C}\), з 7 нейтронами і 6 протонами, і слід\(\ce{_6^{14}C}\), з 8 нейтронами і 6 протонами. Однак ядро не\(\ce{_6^{14}C}\) є стабільним, але зазнає повільного радіоактивного розпаду, що є основою техніки датування вуглецю 14, що використовується в археології. Багато елементів, крім вуглецю, мають більше одного стабільного ізотопу; олово, наприклад, має 10 ізотопів. Існує близько двадцяти елементів, які існують лише в одній ізотопній формі (натрій і фтор - приклади таких).
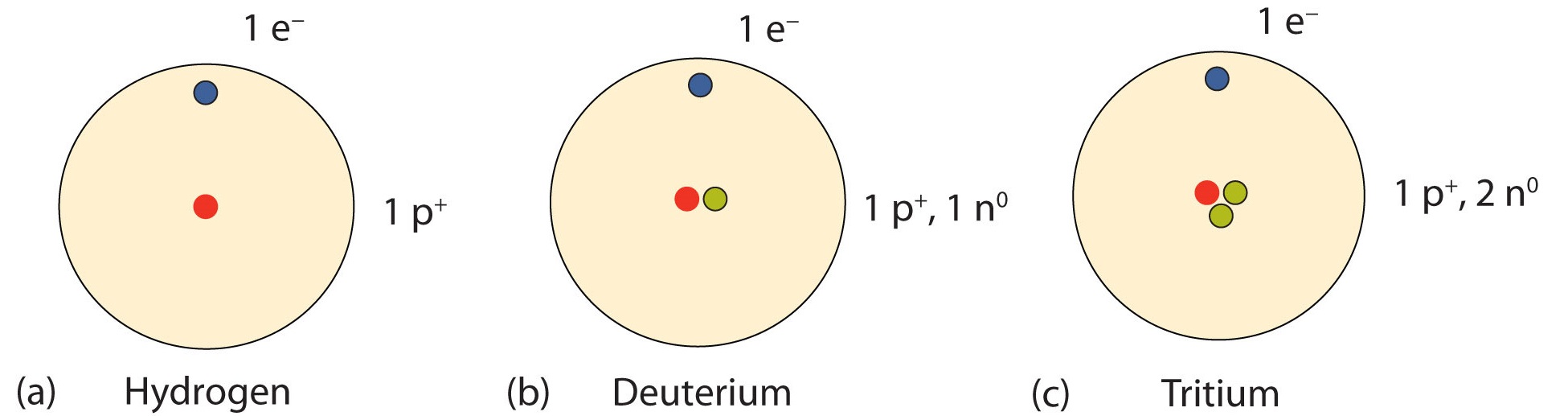
Важлива серія ізотопів виявлена з атомами водню. Більшість атомів водню мають ядро тільки з одним протоном. Близько 1 з 10 000 ядер водню, однак, також має нейтрон; цей особливий ізотоп називається дейтерієм. Вкрай рідкісний ізотоп водню, тритій, має в своєму ядрі 1 протон і 2 нейтрона. На малюнку\(\PageIndex{2}\) порівнюються три ізотопи водню.
В даний час існує понад 3,500 ізотопів, відомих для всіх елементів. Коли вчені обговорюють окремі ізотопи, їм потрібен ефективний спосіб вказати кількість нейтронів в якомусь конкретному ядрі. A/Z і символічно-масові формати можуть бути використані для відображення інформації періодичної таблиці. При перегляді будь-якого з цих двох позначень можна отримати ізотопні відмінності.
Відкриття ізотопів вимагало незначної зміни атомної теорії Дальтона. Дальтон вважав, що всі атоми одного елемента абсолютно однакові.
Подивіться на формати A/Z для трьох ізотопів водню в табл\(\PageIndex{1}\). Зверніть увагу, як атомний номер (нижнє значення) залишається незмінним, тоді як атомні маси (верхнє число) змінюються. Всі ізотопи того чи іншого елемента будуть відрізнятися по нейтронам і масі. Ця дисперсія в масі буде видно і у форматі символьної маси тих самих ізотопів.
| Загальна назва | Формати A/Z | символ-масовий формат | Розширена назва |
|---|---|---|---|
| Водень | \(\mathrm{^{1}_{1}H}\) | \(\text{H-1}\) | водень-1 |
| дейтерій | \(\mathrm{^{2}_{1}H}\) | \(\text{H-2}\) | водень-2 |
| Тритій | \(\mathrm{^{3}_{1}H}\) | \(\text{H-3}\) | водень-3 |
Обидва формати A/Z або символьної маси можуть бути використані для визначення кількості субатомних частинок (протонів, нейтронів та електронів), що містяться всередині ізотопу. Якщо задано будь-який формат, ці значення маси слід використовувати для обчислення кількості нейтронів в ядрі.
Атомна вага
Оскільки більшість зразків природних елементів є сумішами ізотопів, корисно використовувати середню вагу елемента. Атомна маса елемента - це зважена маса всіх природно представлених ізотопів (на землі). Щоб визначити найбільш поширену ізотопну форму елемента, порівняйте дані ізотопи з середньозваженим по таблиці Менделєєва. Наприклад, три ізотопи водню на малюнку\(\PageIndex{2}\) є H-1, H-2 та H-3. Атомна маса або середньозважене водню становить близько 1.008 amu (знову зверніться до періодичної таблиці). З трьох ізотопів водню Н-1 найбільш близький за масою до середньозважених; отже, він є найбільш поширеним. Два інших ізотопи водню досить рідкісні, але дуже захоплюючі в світі ядерної науки.
Ви можете обчислити атомну масу (або середню масу) елемента за умови, що ви знаєте відносні достатки (частка елемента, який є заданим ізотопом), природні ізотопи елемента та маси цих різних ізотопів. Ми можемо обчислити це за наступним рівнянням:
\[\text{Atomic mass} = \left( \%_1 \right) \left( \text{mass}_1 \right) + \left( \%_2 \right) \left( \text{mass}_2 \right) + \cdots \label{eq1}\]
Середні, такі як рівняння 1, відомі як середньозважені. Атомну масу елемента можна обчислити за умови відносної кількості природних ізотопів елемента і маси цих ізотопів відомі. Якщо все достатку не передбачено, можна з упевненістю вважати, що всі цифри повинні складати до 100%.
Наприклад, Бор має два природних ізотопи. У зразку бору,\(20\%\) з атомів знаходяться\(\text{B-10}\), що є ізотопом бору з 5 нейтронами і масою\(10 \: \text{amu}\). Інший\(80\%\) з атомів\(\text{B-11}\), який є ізотопом бору з 6 нейтронами і масою\(11 \: \text{amu}\). Як обчислити атомну масу бору?
Бор має два ізотопи, тому ми будемо використовувати Equation\ ref {eq1} і замінимо відносні величини та атомні маси бору на рівняння\ ref {eq1}:
\[\begin{align} \text{Atomic mass} &= \left( 0.20 \right) \left( 10 \right) + \left( 0.80 \right) \left( 11 \right) \nonumber \\ &= 10.8 \: \text{amu}\nonumber \end{align}\nonumber \]
Маса середнього атома бору, і, отже, атомної маси бору, становить\(10.8 \: \text{amu}\).
Приклад\(\PageIndex{1}\): атомна вага неону
Неон має три природні ізотопи. У зразку неону\(90.92\%\) з атомів\(\ce{Ne}\) -20, що є ізотопом неону з 10 нейтронами і масою\(19.99 \: \text{amu}\). Інший\(0.3\%\) з атомів\(\ce{Ne}\) -21, який є ізотопом неону з 11 нейтронами і масою\(20.99 \: \text{amu}\). Кінцевими\(8.85\%\) з атомів є\(\ce{Ne}\) -22, що є ізотопом неону з 12 нейтронами і масою\(21.99 \: \text{amu}\). Що таке атомна маса неону?
Рішення
Неон має три ізотопи. Ми будемо використовувати рівняння:
\[\text{Atomic mass} = \left( \%_1 \right) \left( \text{mass}_1 \right) + \left( \%_2 \right) \left( \text{mass}_2 \right) + \cdots \nonumber\]
Підставляємо їх в рівняння, і ми отримуємо:
\[\begin{align*} \text{Atomic mass} &= \left( 0.9092 \right) \left( 19.99 \right) + \left( 0.003 \right) \left( 20.99 \right) + \left( 0.0885 \right) \left( 21.99 \right) \\ &= 20.17 \: \text{amu} \end{align*}\]
Маса середнього атома неону дорівнює\(20.17 \: \text{amu}\)
Вправа\(\PageIndex{1}\)
Магній має три ізотопи, перераховані в наступній таблиці:
| Ізотоп | Точна маса (аму) | Відсоток достатку (%) |
|---|---|---|
| 24 Мг | 23.98504 | 78.70 |
| 25 мг | 24.98584 | 10.13 |
| 26 Мг | 25.98259 | 11.17 |
Використовуйте ці дані для обчислення атомної маси магнію.
- Відповідь
-
24.31 грн.
Застосування ізотопів
Під час Манхеттенського проекту більша частина федерального фінансування була присвячена поділу ізотопів урану. Два найпоширеніших ізотопи урану - U-238 і U-235. Близько 99,3% урану відноситься до різновиду U-238, ця форма не ділиться і не буде працювати в ядерній зброї або реакції. Решта 0,7% - це U-235, який ділиться, але спочатку довелося відокремити від U-238. Цей процес поділу називається збагаченням. Під час Другої світової війни ядерний об'єкт був побудований в Оук-Рідж, штат Теннессі, для виконання цього проекту. У той час процес збагачення виробляв лише достатньо U-235 для однієї ядерної зброї. Це паливо було поміщено всередині меншої з двох атомних бомб (Little Boy), скинутих над Японією.

Уран - природний елемент, який можна зустріти в декількох різних країнах. Країнам, які не мають постачання природного урану, потрібно буде отримати його з однієї з наведених нижче країн. Більшість ядерних реакторів, що забезпечують енергією, спираються на U-235 як джерело палива. На щастя, реакторам потрібно лише 2-5% U-235 для виробництва мегават або навіть гігават потужності. Якщо процес очищення перевищує цей рівень, то, швидше за все, країна зосереджується на виготовленні ядерної зброї. Наприклад, науковці Manhattan Project збагатили U-235 до 90% з метою виробництва зброї «Маленький хлопчик».
Скорочення, такі як ВОУ (високозбагачений уран) та НОУ (низькозбагачений уран), часто використовуються ядерними вченими та групами. HEU визначається як більш ніж 20% чистого U-235 і не буде використовуватися в більшості комерційних ядерних реакторів. Цей тип матеріалу використовується для заправки більших підводних човнів і авіаносців. Якщо очищення U-235 досягає 90%, то ВОУ додатково класифікується як матеріал збройового класу. Цей тип U-235 може бути використаний для виготовлення ядерної зброї (на основі поділу або навіть синтезу). Що стосується НОУ, то його рівень U-235 був би нижче цієї позначки 20%. LEU буде використовуватися для комерційних ядерних реакторів і менших, атомних підводних човнів. НОУ недостатньо чистий для використання в звичайній ядерній зброї, але може бути використаний у брудній бомбі. Цей тип зброї використовує звичайні вибухові речовини, такі як динаміт, для поширення ядерного матеріалу. На відміну від ядерної зброї, брудні бомби недостатньо потужні, щоб впливати на великі групи будівель або людей. На жаль, поширення ядерного матеріалу призведе до масового хаосу для громади і призведе до жертв.
Резюме
- Ізотопи елемента мають різну масу і ідентифікуються за їх масовими номерами.
- Атомна маса елемента - це середньозважена маса ізотопів елемента
- Атомну масу елемента можна обчислити за умови відносної кількості природних ізотопів елемента і маси цих ізотопів відомі. Якщо все достатку не передбачено, можна з упевненістю вважати, що всі цифри повинні складати до 100%.
Концепція Огляд вправи
- Чому атомний номер так важливий для ідентичності атома?
- Яка залежність між кількістю протонів і кількістю електронів в атомі?
- Чим ізотопи елемента відрізняються один від одного?
- Що таке масове число елемента?
Відповіді
- Атомний номер визначає ідентичність елемента. Вона описує кількість протонів в ядрі.
- У електрично нейтральному атомі кількість протонів дорівнює кількості електронів.
- Ізотопи елемента мають однакову кількість протонів, але мають різну кількість нейтронів у своїх ядрах.
- Масове число - це сума чисел протонів і нейтронів в ядрі атома.