4.6: Енергетика хімічних реакцій
Енергетика займається енергіями, які беруть участь в хімічних реакціях. Існує два типи енергій: перша пов'язана з термодинамікою, яка є енергією, що виділяється або поглинається, коли реагенти перетворюються в продукти, а другий пов'язаний з кінетикою реакції, тобто енергією, якою повинні володіти реагуючі молекули, щоб перевершити енергетичний бар'єр для перетворення на продукцію.
Діаграма координат реакції
Прогрес реакції в порівнянні з енергетичним графіком наведено на рис.4.7.1.
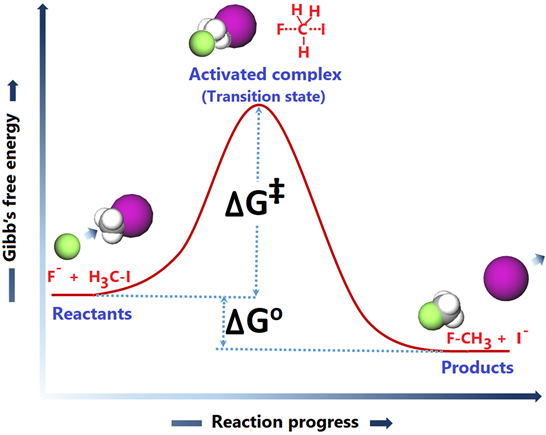
Відправна точка показує енергетичний рівень реагентів. Пам'ятайте, що кожна речовина має внутрішню енергію, яка проявляється як температура. Молекули рухаються за рахунок внутрішньої енергії і стикаються з іншими молекулами. Зіткнення між реагентами, як правило, є першою вимогою для продовження реакції.
F - іон в даному прикладі стикається з мішенню H 3 C-I з боку, протилежної C-I зв'язку. Зіткнення під кутом, відмінним від 180 o до зв'язку C-I, менш ефективно або неефективно при ініціюванні розриву C-I зв'язку. Отже, правильна орієнтація реагуючих молекул в момент зіткнення - друга вимога.
Після правильно орієнтованого зіткнення зв'язок C-I починає руйнуватися, зв'язок F-C починає робити, і енергія системи піднімається до максимального рівня, де розрив і виготовлення зв'язку знаходяться приблизно на півдорозі. Вид на максимумах енергетичної кривої називається активованим комплексним або перехідним станом. Різниця в енергії між реагентами і перехідним станом називається енергією активації (ΔG ‡). Реагенти повинні мати достатньо кінетичної енергії, щоб перевершити енергетичний бар'єр активації, що є третьою вимогою для реакції. Короткий зміст основних вимог хімічної реакції, щоб відбутися, є наступним.
- Реагуючі молекули стикаються один з одним - чим частіше зіткнення, тим швидше реакція.
- Молекули повинні мати належну орієнтацію під час зіткнення — цей фактор змінюється від реакції до реакції.
- Молекули, що стикаються, повинні мати енергію, крім потенційної хімічної енергії, рівну або вище енергії активації - нижча енергія активації, тим швидше реакція.
Активований комплекс формується, якщо виконуються основні вимоги. Активований комплекс скочується по гірці по енергетичній шкалі і осідає на енергетичному рівні продуктів, де старі зв'язки повністю розриваються, а нові зв'язки повністю формуються. Графік прогресу реакції проти енергії, як на рис. 4.7.1, називається діаграмою координат реакції.
Екзотермічні та ендотермічні реакції
Енергія, що поглинається або виділяється у вигляді тепла при постійних умовах тиску, називається зміною ентальпії (ΔH), яка майже така ж, як внутрішня енергія, що поглинається або вивільняється (ΔG) у більшості реакцій.
Хімічна реакція, яка виділяє тепло, є екзотермічною. Хімічна реакція, яка поглинає тепло, - це ендотермічна реакція.
Утворення зв'язків завжди екзотермічне, а розрив зв'язків - протилежне, тобто ендотермічне, як показано на рис. 4.7.2.


При хімічній реакції деякі зв'язки розриваються, і утворюються деякі зв'язки. Якщо розрив зв'язку поглинає менше тепла, ніж тепло, що виділяється при створенні нового зв'язку, реакція екзотермічна. Продукти мають меншу енергію, ніж реагенти, а ΔH є негативним для екзотермічних реакцій. Протилежне вірно для ендотермічної реакції, тобто розрив зв'язку поглинає більше тепла, ніж утворює зв'язок; продукти більш високі за енергією, ніж реагенти, і ΔH позитивний, як показано на рис. 4.8.3.

Прикладом екзотермічної реакції є спалювання метану, який виділяє тепло, що використовується для приготування їжі.
CH4+2O2⟶CO2+2H2OΔHo=−891kJ
Прикладом ендотермічної реакції є фотосинтез.
6CO2+6H2O⟶C6H12O6+6O2ΔHo=+2800kJ
Зверніть увагу, що ознакою ΔH є —ve для екзотермічної та +ve для ендотермічної реакції. Іноді енергія показана як продукт екзотермічної реакції, і як реагент для едотермічної реакції. Наприклад, два вищевказаних творіння можуть бути записані як:
CH4+2O2⟶CO2+2H2O+891kJ
6CO2+6H2O+2800kJ⟶C6H12O6+6O2

Використовувані в лікарнях швидкорозчинні гарячі або холодні пакети засновані на теплоті розчинення солей у воді, як показано на рис.4.7.4. Сіль і вода знаходяться в окремих кишенях в пачці. При розриві ущільнення сіль розчиняється у воді і виділяє або поглинає тепло. Розчинення солі CaCl 2 у воді є екзотермічним процесом, який є джерелом тепла в гарячій упаковці:
CaCl2(s)⟶CaCl2(aq)ΔHo=−82kJ
Розчинення солі NH 4 NO 3 у воді - це ендотермічний процес, який використовується для поглинання тепла в холодній упаковці.
NH4NO3(s)⟶NH4NO3(aq)ΔHo=−26kJ
Фактори, що впливають на швидкість хімічної реакції
Швидкість хімічної реакції, тобто кількість споживаного реагенту або кількість продукту, що утворюється за одиницю часу, залежить від енергії активації реакції - чим вище енергія активації, тим повільніше швидкість реакції і навпаки. Реакція вимагає зіткнення між молекулами реагенту з належною орієнтацією та достатньою енергією, щоб перевершити енергетичний бар'єр активації.
Будь-який фактор, що збільшує швидкість зіткнень, підсилює правильну орієнтацію або збільшує кінетичну енергію молекул, викликає збільшення швидкості реакції. Фактори включають концентрацію, температуру та каталізатори.
Вплив концентрації реагентів
Чим вище концентрація, тим частіші зіткнення, і тим швидше реакція, як показано на рис.4.7.5.
В процесі дихання кисень (О 2) зв'язується з гемоглобіном (Hb) в легенях.
Нб (ак) + О 2 (г) → ГБО 2 (ак)
Пацієнтам, які мають проблеми з диханням, дають дихальні маски з більшою концентрацією кисню, ніж в атмосфері, щоб збільшити швидкість зв'язування кисню з гемоглобіном.

вплив температури
Кінетична енергія молекул при заданій температурі слідує за розподілом Больцмана, як показано на рис. 4.8.6. Підвищена температура збільшує середню кінетичну енергію молекул, що збільшує частку молекул з більшою енергією активації.
Збільшення температури збільшує швидкість хімічних реакцій - як правило, збільшення температури на 10 o C подвоює швидкість хімічної реакції.

Деякі практичні приклади використання цього принципу наступні. Зберігання продуктів у холодильниках при більш низьких температурах зменшує швидкість реакцій, що призводить до більш тривалого терміну служби продуктів. Приготування продуктів у скороварці збільшує температуру, що призводить до більш швидкого приготування, ніж у відкритій каструлі. У деяких кардіологічних операціях температура тіла знижується до 28 o C, щоб зменшити швидкість метаболізму, що зменшує потребу в кисні, так що серце може бути тимчасово зупинено для операції.
Вплив каталізаторів і ферментів
Каталізатори і ферменти збільшують швидкість реакції за рахунок зменшення енергії активації реакції по альтернативному шляху, як показано на рис. 4.7.7.
Каталізатори і ферменти не споживають в реакції -вони регенерують і повторюють дію. Ферменти є каталізаторами біохімічних реакцій. Ферменти також збільшують швидкість реакції шляхом зв'язування з реагентами і правильної орієнтації їх на реакцію.

