4.3: Хімічна реакція
- Page ID
- 25349
Що таке хімічна реакція?
Хімічна реакція - це поєднання, поділ або перестановка атомів у речовині.
Атоми зцілюються разом у речовині хімічними зв'язками. Комбінація робить зв'язки, поділ розриває зв'язки, а перестановка розриває деякі старі зв'язки і робить деякі нові зв'язки в речовині під час хімічної реакції. В результаті з'являються нові речовини з іншим складом елементів, ніж вихідні речовини. Вихідні речовини називаються реагентами, а нові речовини, що утворюються, називаються продуктами.
Коли хімічний зв'язок розривається енергія потрібна і коли утворюється хімічний зв'язок енергія вивільняється. Кількість енергії залежала від хімічного зв'язку, але для того ж зв'язку енергія, яку потрібно розірвати, - це та сама енергія, що виділяється для створення зв'язку. Тому енергія виділяється в одних хімічних реакціях і всмоктується в інших.
Прикладами хімічних реакцій є фотосинтез, який перетворює вуглекислий газ і воду в глюкозу в зеленому листі рослин, використовуючи енергію сонячного світла. Перетравлення їжі - це хімічна реакція, яка вивільняє енергію, необхідну для функціонування живих істот. Горіння свічки - це хімічна реакція, яка перетворює органічні сполуки в паливі в вуглекислий газ, воду та теплову енергію. Іржавіння заліза - ще одна хімічна реакція, яка перетворює елемент заліза в з'єднання оксиду заліза.
Показання до хімічної реакції
Хімічна реакція зазвичай супроводжується деякими фізичними змінами, які можуть спостерігатися. До змін відносяться зміна кольору, полум'я, тепла, світла, виділення газу, утворення осаду і т.д., як показано на рис. 4.3.1




Представляючи собою хімічну реакцію- хімічне рівняння
Хімічне рівняння являє собою хімічну реакцію.
- Формули реагентів пишуться з лівого боку, розділених знаком +.
- Формули виробів пишуться з правого боку, розділених знаком +.
- Стрілка, що вказує в напрямку продуктів, відокремлює реагенти від продуктів.
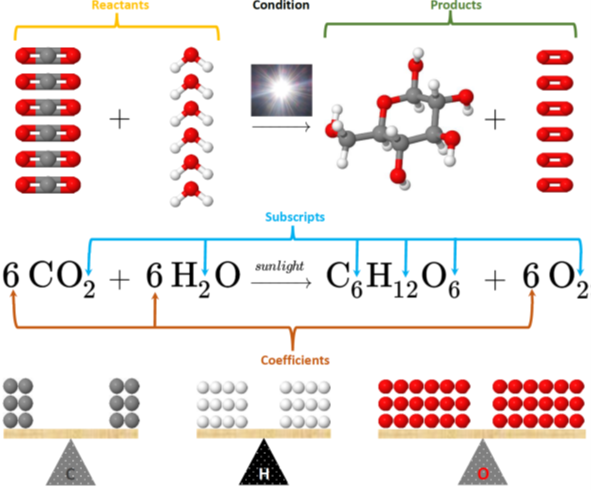
Рис. 4.3.2 ілюструє реакцію фотосинтезу між вуглекислим газом (\(\ce{CO2}\)і водою) (\(\ce{H2O}\)виробляє глюкозу (\(\ce{C6H12O6}\)і кисень) (\(\ce{O2}\):
\[\ce{6CO2 + 6H2O ->[sun light] C6H12O6 + 6O2}\nonumber\]
- Спочатку пишуться правильні формули реагентів і продуктів, розділені плюсовими знаками і стрілками.
- Потім кількість видів коригується шляхом додавання числа, званого коефіцієнтом, на початку формули. Коефіцієнти необхідні для того, щоб атоми кожного елемента були рівними по обидва боки рівняння, оскільки атоми не створюються і не руйнуються в хімічній реакції.
- Індекси всередині формул не можуть бути змінені, оскільки вони представляють склад речовини, яке є постійним.
- Коефіцієнт не пишеться, якщо він один.
Наприклад, на рис. 4.3.2 показані коефіцієнти 6 для вуглекислого газу, води та кисню, але жоден коефіцієнт для глюкози не означає, що коефіцієнт фактично один для глюкози в збалансованому хімічному рівнянні реакції фотосинтезу.
Іноді фізичний стан речовин відображається символами в маленьких дужках поруч з формулою.
- Символами фізичного стану є: (s) для твердого тіла, (l) для рідини, (g) для газу та (aq) для речовини, розчиненої у воді. Символ (aq) розшифровується як водний, тобто вода.
- Якщо газ розвивається, він може бути показаний стрілкою вгору (↑), а якщо утворюється осад, це показано стрілкою вниз (↓).
Наприклад, горіння\(ce{C4H10}\) бутану (в запальничці показано на рис. 4.3.1. можна представити у вигляді:
\[\ce{2C4H10(g) + 13O2(g) -> 8CO2(g) + 10H26O(g)}\nonumber\]
, Де всі реагенти і продукти знаходяться в газовій фазі. Реакція NaCl і AgNO 3 у воді, що призводить до утворення осаду, як показано на рис. 4.3.1, становить:
\[\ce{NaCl(aq) + AgNO3(aq) -> AgCl(s) (v) + NaNO3(aq)}\nonumber\]
, де NaCl, AgNO 3 та NaNO 3 знаходяться у воді, а AgCl випадає у вигляді білого твердого речовини. Реакція вапняку з HCl, показана на рис. 4.3.1, становить:
\[\ce{CaCO3(s) + 2HCl(aq) -> CaCl2(aq) + H2O(l) + CO2(g) ^}\nonumber\]
Умови реакції, каталізатори або тепло можуть бути написані вище або під стрілкою. Тепло також може бути представлено символом, наприклад,
\[\ce{CaCO3(s) + CaO(s) ->[\Delta] CO2(g)^}\nonumber\]
Двостороння стрілка\(\ce{<=>}\) або\(\leftrightarrows\) являє собою двосторонню реакцію, наприклад,
\[\ce{2NO2(g) <=> N2O4(g)}\nonumber\]
Балансування хімічного рівняння
Першим кроком є правильні формули реагентів і продуктів, розділених плюсовими знаками і стрілкою. Наприклад, початкове рівняння для спалювання водню, спалювання кисню та отримання води, буде:
\[\ce{H2 + O2 -> H2O}\nonumber\]
Зверніть увагу, що водень записується як H 2 (не H), а кисень як O 2 (не O), оскільки ці реагенти зазвичай існують як молекули, а не як атоми.
Наступним кроком є додавання коефіцієнтів для збалансування атомів кожного елемента з двох сторін рівняння. Наприклад, у вищенаведеному рівнянні водень збалансований, а кисень - ні. Балансуйте кисень шляхом зміни коефіцієнта води від 1 до 2:
\[\ce{H2 + O2 -> 2H2O}\nonumber\]
Індекси в формулах змінювати не можна, так як вони постійні. Наприклад, якщо O 2 змінено на O у наведеному вище рівнянні, щоб збалансувати кисень, це неправильно, оскільки O 2 - молекулярний кисень, який є іншим хімічним речовиною, ніж атомарний кисень O.
Коефіцієнт є множником кожного індексу в формулі, тобто в 2Н 2 О є 2х2 = 4 водню і 2х1 =2 кисню. Тепер знову шукайте інші елементи: зверніть увагу, що атоми водню змінилися на 4 з правого боку. Щоб збалансувати водень, змініть коефіцієнт Н 2 з 1 на 2:
\[\ce{2H2 + O2 -> 2H2O}\nonumber\]
Перевірте ще раз: Тепер атоми кожного елемента однакові з обох сторін, тобто рівняння збалансоване, як показано на рис. 4.3.3.

Правила збалансування хімічного рівняння
Описаний вище метод для збалансування хімічного рівняння називається методом удару та випробування. Жорстких і швидких правил в цьому методі немає. Загальними рекомендаціями є:
- якщо елемент зустрічається лише в одному реагенті та одному продукті, спочатку збалансуйте його,
- якщо в реагентах або продуктах є вільний елемент, збалансований його в останню чергу,
- якщо в реагентах і продуктах є багатоатомний іон, збалансуйте кількість багатоатомних іонів як одиницю, тобто додайте коефіцієнт до, але не змінюйте індекси в багатоатомному іоні або будь-якої формули.
- в деяких випадках для збалансування рівняння потрібен дробовий коефіцієнт, в такому випадку спочатку використовують дробовий коефіцієнт, а коли рівняння збалансовано, видаліть дріб, перемноживши всі коефіцієнти загальним множником,
- якщо множина коефіцієнтів в збалансованому рівнянні знаходиться не в найпростішому співвідношенні цілих чисел, рівняння все одно збалансоване, але рекомендується перетворити набір коефіцієнтів в найпростіший співвідношення цілих чисел.
Наступні приклади пояснюють рекомендації.

Спалювання пропану (С 3 Н 8) застосовується при газовому зварюванні, як показано на рис.4.3.4. Пропан реагує з киснем і виробляє вуглекислий газ і воду. Написати і збалансувати хімічне рівняння реакції?
Рішення
Почніть з написання правильних формул реагентів і продуктів у формі хімічного рівняння:
\[\ce{C3H8 + O2 -> CO2 + H2O}\nonumber\]
Згідно з правилом 1, спочатку подивіться на вуглець або водень. Обидва не збалансовані. Врівноважте вуглець, змінивши коефіцієнт СО 2 від 1 до 3:
\[\ce{C3H8 + O2 -> 3CO2 + H2O}\nonumber\]
Врівноважте водень, змінивши коефіцієнт Н 2 О від 1 до 4:
\[\ce{C3H8 + O2 -> 3CO2 + 4H2O}\nonumber\]
Тепер подивіться на кисень (правило 2) і збалансуйте його, змінивши коефіцієнт О 2 з 1 на 5:
\[\ce{C3H8 + 5O2 -> 3CO2 + 4H2O}\nonumber\]
Останнє рівняння збалансовано, як показано на рис.4.3.5.

Реакція між металевим порошком алюмінію та оксидом заліза, звана термітною реакцією, є дуже екзотермічною, що розплавляє іон. Термітна реакція застосовується для залізничного зварювання, як показано на рис. 4.3.6. Райт і збалансувати рівняння реакції.
Рішення
Почніть з написання правильних формул реагентів і продуктів у формі хімічного рівняння:
\[\ce{Al + Fe2O3 -> Fe + Al2O3}\nonumber\]
Правило 1 не застосовується, оскільки всі елементи знаходяться в одному реагенті і одному продукті. Згідно з правилом 2, подивіться на будь-який з з'єднань. Врівноважте алюміній, змінивши коефіцієнт в еактант від 1 до 2:
\[\ce{2Al + Fe2O3 -> Fe + Al2O3}\nonumber\]
Тепер збалансуйте залізо, змінивши його коефіцієнт від 1 до 2 у виробі:
\[\ce{2Al + Fe2O3 -> 2Fe + Al2O3}\nonumber\]
Всі атоми збалансовані на цьому етапі і коефіцієнти знаходяться в найпростішому співвідношенні цілого числа. Таким чином, рівняння збалансоване.

Метанол (CH 4 O) вступає в реакцію з киснем і виробляє вуглекислий газ і воду. Написати і збалансувати рівняння хімічної реакції?
Рішення
Початкове рівняння з правильними формулами таке:
\[\ce{CH4O + O2 -> CO2 + H2O}\nonumber\]
Згідно з правилом 1, спочатку подивіться на вуглець і водень. Вуглець вже збалансований. Зліва є 4 водню, але тільки два з правого боку, тому збалансуйте їх, змінюючи коефіцієнт води від 1 до 2:
\[\ce{CH4O + O2 -> CO2 + 2H2O}\nonumber\]
Тепер подивіться на кисень (правило 2). Праворуч є три атоми кисню (один в метанолі і два у вільному елементі кисню), але чотири кисню праворуч, він не збалансований. Зміна коефіцієнта СН 4 О від 1 до 2 врівноважує кисень, але вуглець і водень виходять з рівноваги. Зміна коефіцієнта O 2 від 1 до 2 не врівноважує кисень. На цьому етапі працює дробовий коефіцієнт 3/2 для О 2 (правило 4):
\[\ce{CH4O + 3/2 O2 -> CO2 + 2H2O}\nonumber\]
Всі елементи збалансовані, тобто рівняння збалансоване, але, згідно з правилом 5, дріб краще прибрати, множивши кожен коефіцієнт в рівнянні на 2:
\[\ce{2CH4O + 3O2 -> 2CO2 + 4H2O}\nonumber\]
Набір коефіцієнтів в збалансованому рівнянні знаходиться вже в найпростішому співвідношенні ціле число, тому подальший крок в цьому випадку не потрібен.
Алюміній реагує на сірчану кислоту з отриманням сульфату алюмінію та газу водню. Райт - збалансоване хімічне рівняння для реакції.
Рішення
Початкове рівняння з правильними формулами реагентів і продуктів таке:
\[\ce{Al + H2SO4 -> Al2(SO4)3 + H2}\nonumber\]
Всі елементи зустрічаються в одному реагенті і одному продукті, тому правило 1 не застосовуються. Згідно з правилом 2, залишити алюміній до кінця і, згідно з правилом 3, збалансувати багатоатомний іон (SO 4 2 -) як одиницю, змінивши коефіцієнт сірчаної кислоти від 1 до 3:
\[\ce{Al + 3H2SO4 -> Al2(SO4)3 + H2}\nonumber\]
Тепер збалансуйте водень, змінивши його коефіцієнт від 1 до 3:
\[\ce{Al + 3H2SO4 -> Al2(SO4)3 + 3H2}\nonumber\]
Остаточно збалансувати алюміній, змінивши його коефіцієнт від 1 до 2:
\[\ce{2Al + 3H2SO4 -> Al2(SO4)3 + 3H2}\nonumber\]
Двічі перевірте в кінці —Всі елементи збалансовані, і всі коефіцієнти знаходяться в найпростішому співвідношенні цілого числа. Ніякого подальшого кроку не потрібно.
