4.4: Закономірності хімічних реакцій
- Page ID
- 25371
Загальні види хімічних реакцій
Існує кілька способів класифікації хімічних реакцій. Загальні типи хімічних реакцій відносяться до категорій реакцій поєднання, розкладання, заміщення і горіння, як показано на рис. 4.4.1.
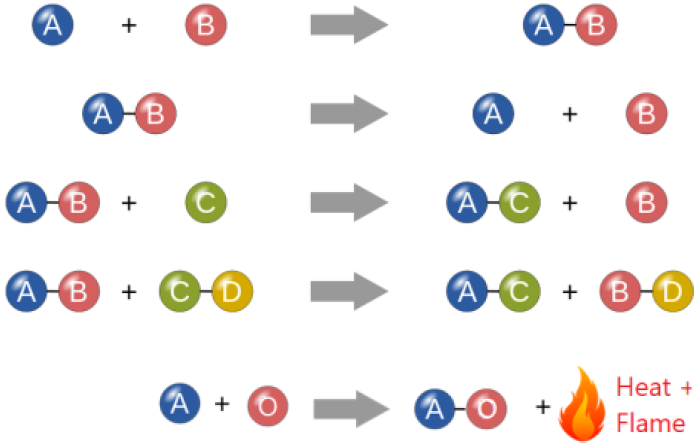
Комбіновані реакції
З'єднання синтезується або утворюється з двох або більше речовин, наприклад:
\[\ce{C + O2 -> CO2}\nonumber\]
\[\ce{2H2 + O2 -> 2H2O}\nonumber\]
\[\ce{2Mg + O2 -> 2MgO}\nonumber\]
\[\ce{2Na + Cl2 -> 2NaCl}\nonumber\]
\[\ce{CaO + CO2 -> CaCO3}\nonumber\]
На рис. 4.4.2 наведено приклад комбінаційної реакції водню з киснем, яка розробляється для використання в якості палива в майбутньому.

Реакції розкладання
Реакції розкладання є зворотним реакцією комбінації, тобто одна сполука розщеплюється на дві або більше речовин, як правило, нагріванням, наприклад:
\[\ce{H2CO3 -> H2O + CO2}\nonumber\]
\[\ce{CaCO3 ->[\Delta] CaO + CO2}\nonumber\]
\[\ce{2KClO3 ->[\Delta] 2KCl + 3O2}\nonumber\]
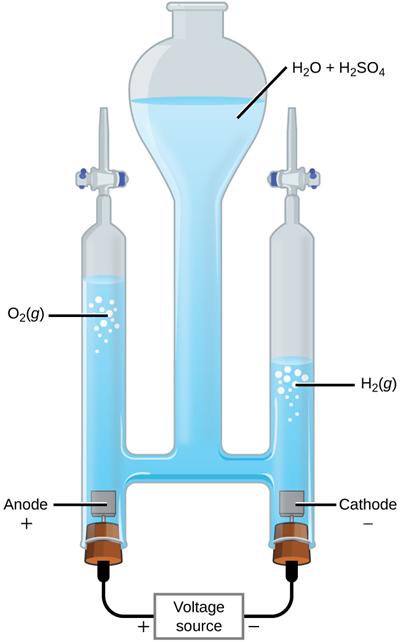
\[\ce{2H2O (l) ->[Electrolyisis] 2H2(g) + O2(g)}\nonumber\]
Рис. 4.4.3 ілюструє останню реакцію, тобто розкладання води за допомогою електролізу.
Реакції заміни або заміщення
Існує два підкласи цієї категорії реакцій, тобто реакція одноразового заміщення і подвійна заміщення.
Поодинокі реакції заміщення включають одну речовину, що замінює частину іншої, наприклад:
\[\ce{Zn(s) + CuCl2(aq) -> ZnCl2(aq) + Cu(s)}\nonumber\]
\[\ce{2Al(s) + 6HCl(aq) -> AlCl3(aq) + 3H2(g)}\nonumber\]
На рис. 4.4.4 наведено приклад однієї реакції заміщення магнію, що призводить до утворення водню.
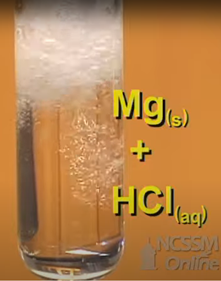
Реакції подвійного заміщення або метатез передбачають взаємний обмін партнерами між двома речовинами, наприклад, такі реакції опадів:
\[\ce{NaCl(aq) + AgNO3(aq) -> AgCl(s)(v) + NaNO3(aq)}\nonumber\]
\[\ce{Na2CO3(aq) + CaCl2(aq) -> CaCO3(s)(v) + 2NaCl(aq)}\nonumber\]
Реакції горіння
Горіння - це реакція речовини з киснем, часто з утворенням полум'я і виділенням великої кількості тепла, наприклад:
\[\ce{C8H16 + 12O2 -> 8CO2 + 8H2O + Heat}\nonumber\]
\[\ce{C + O2 -> CO2 + Heat}\nonumber\]
\[\ce{2H2 + O2 -> 2H2O + Heat}\nonumber\]
\[\ce{2Mg + O2 -> 2MgO + Heat}\nonumber\]
На рис. 4.4.5 показана вищевказана реакція, тобто згоряння Mg в повітрі.

Зазвичай горіння розглядається як реакція речовини, що містить вуглець і водень, з киснем, в результаті чого вуглекислий газ, вода, полум'я і тепло, наприклад, спалювання метану на кухонній плиті:
\[\ce{CH4 + 3O2 -> CO2 + 2H2O + Heat}\nonumber\]
Класифікація хімічної реакції
Хімічні реакції, як правило, класифікуються на основі того, що обмінюється під час реакції. До них відносяться;
- перенесення електронів в окислювально-відновних реакціях,
- перенесення протонів в кислотно-лужних реакціях,
- частина реагентів взаємно обмінюється в реакціях опадів, як описано нижче.
Окислювально-відновні реакції
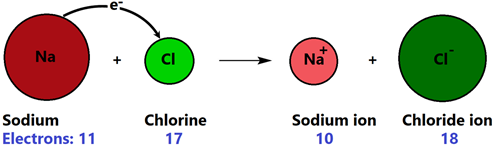
Окислювально-відновна або окислювально-відновна реакція передбачає обмін електронами. Наприклад, реакції між металом і неметалом передбачають перенесення електронів від металу до неметалу, що утворюють іонний зв'язок, як показано на рис.4.4.6.
Кислотно-лужні реакції
Кислотно-лужні реакції передбачають перенесення протонів з кислоти в основу, як показано на рис.4.4.7.

Walkerma, Суспільне надбання
Реакції опадів
Це реакції подвійного витіснення у воді, що призводить до осадження одного з продуктів, як показано на рис.4.4.8.

Реакції опадів і кислотно-лужні реакції описані в наступних розділах. Окислювально-відновні реакції розглянуті в наступному розділі.
