4.5: Окислювально-відновні реакції
- Page ID
- 25391
Що таке окислення та відновлення?
Окислення-відновлення визначається трьома способами:
- Про окислення - це l втрата електронів і r зменшення - це g main електронів. Слово OIL RIG допомагає в запам'ятовуванні цього визначення.
- Додавання кисню - це окислення, а видалення кисню - відновлення.
- Видалення водню - це окислення, а додавання водню - відновлення.
Окислювально-відновна або коротше окислювально-відновна реакція є одним з найпоширеніших типів хімічних реакцій, що відбуваються в нас і навколо нас. Наприклад, іржавіння металів, фотосинтез, перетравлення їжі, спалювання палива - окислювально-відновні реакції.

Окислення-половина і відновлення-половина реакції
Окислювально-відновні реакції відбуваються в парі, тому що одна річ втрачає електрони і окислюється; інша річ отримує електрони і зменшується. Ось чому її прийнято називати окислювально-відновною реакцією, де червоний - являє собою відновлення, а —вол - окислення.
Зелена патина на статуї Свободи, показана на рис. 4.5.1, є результатом окислення міді:
\[\ce{2Cu(s) + O2(g) -> CuO(s)}\nonumber\]
Перенесення електронів стає очевидним, коли реакція розщеплюється на окислювальну половину і відновлювальну половину. Окислення-половина - це:
\[\ce{Cu -> Cu^2+ + 2e^-}\nonumber\]
мідь втратила електрони, тому мідь є оксидами. Половина скорочення становить:
\[\ce{O2 + 4e^- -> 2O^2-}\nonumber\]
Кисень набирає електрони, тому кисень знижується.
- Речовина, що окислює іншу речовину, є окислювачем. Кисень є окислювачем у вищевказаній реакції, так як він окислює мідь.
- Речовина, що зменшує іншу речовину, є відновником. Мідь є відновником у вищевказаній реакції, так як вона знижує кисень.
Електрони, втрачені в окисленні-половині, повинні дорівнювати електронам, отриманим супутнім відновленням-половині. Множення окислення-наполовину на 2 робить втрачені електрони рівними електронам, отриманим при відновленні половини в вищезгаданій реакції. Потім додавання окислення і відновлення половини дає загальну реакцію:
\[\ce{2Cu -> 2Cu^2+ + \cancel{4e^-}}\nonumber\]
\[\ce{O2 + \cancel{4e^-} -> 2O^2-}\nonumber\]
\[\text {Overall reaction: } \ce{2Cu(s) + O2(g) -> CuO(s)}\nonumber\]
Хімічними рівняннями можна маніпулювати як алгебраїчні рівняння, тобто їх можна помножити або розділити на константу, додавати і віднімати, як показано на прикладі реакцій окислювально-половинної міді вище. Зверніть увагу, що електрони з одного боку рівняння скасували електрони з іншого боку рівняння під час операції додавання.
Цинкова смужка сріблястого кольору, змочена в розчині нітрату міді, стає покритою шаром міді червонуватого кольору, як показано на рис.4.5.2. Молекулярне рівняння реакції, яке показує формули одиниць сполук в реагентах і продуктах, є:
\[\ce{Zn(s) + Cu(NO3)2(aq) -> Cu(s) + Zn(NO3)2(aq)}\nonumber\]
Повне іонне рівняння для реакції отримують, показуючи розчинені іонні сполуки у вигляді іонів, наприклад:
\[\ce{Zn(s) + Cu^2+ (aq) + 2NO3^{-} (aq) -> Cu(s) + Zn^2+ (aq) + 2NO3^- (aq)}\nonumber\]
Окислення-половина реакції становить:
\[\ce{Zn(s) -> Zn^2+ (aq) + 2e^-}\nonumber\]
Зменшення-половина реакції становить:
\[\ce{Cu^2+ (aq) + 2e{-} -> Cu(s)}\nonumber\]
Чисте іонне рівняння, яке є додаванням окислення-половини і відновлення-половини, є:
\[\ce{Zn(s) + Cu^2+ (aq) -> Cu(s) + Zn^2+ (aq)}\nonumber\]
Зверніть увагу, що NO 3 - був по обидва боки повного іонного рівняння і був скасований в чистому іонному рівнянні:
\[\ce{Zn(s) + Cu^2+ (aq) + \cancel{2NO3^{-} (aq)} -> Cu(s) + Zn^2+ (aq) + \cancel{2NO3^- (aq)}}\nonumber\]
Іони, які не беруть участі в хімічній реакції, називаються глядацькими іонами, і вони з'являються по обидва боки молекулярного рівняння, як NO 3 - в даному випадку.
Біологічні реакції окислення та відновлення
У окислювально-відновних реакціях за участю видів металів передача електронів зазвичай очевидна через окислювальну половину та реакції відновлення-половина, як у наведених вище прикладах. В органічних і біохімічних окислювально-відновних реакціях перенесення електронів зазвичай не настільки очевидний, але зазвичай очевидний перенесення водню або кисню. Наприклад, метаболізм метанолу\(\ce{H3C-OH}\) починається з окислення через втрату водню:
\[\ce{H3C-OH -> H2C=O + 2H}\nonumber\]
Метанол окислюється до формальдегіду\(\ce{H2C=O}\). Формальдегід додатково окислюється, отримуючи кисень:
\[\ce{H2C=O -> HCOOH}\nonumber\]
Нарешті, мурашина кислота (HCOOH) окислюється, отримуючи кисень і утворюючи вуглекислий газ і воду:
\[\ce{2HCOOH -> 2O=C=O + 2H2O}\nonumber\]
Збільшення зв'язку C-O від одиночного зв'язку в метанолі до двох подвійних зв'язків (чотирьох зв'язків С-О) в вуглекислому газу є явним свідченням окислення вуглецю.
Видалення водню також окислюється, наприклад, гідроксималонат окислюється до оксомалонат ферментом гідроксималонатдегідрогенази:
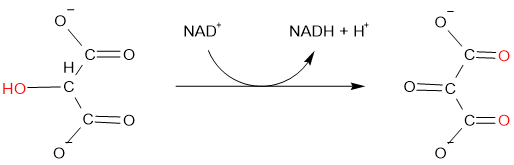
Зворотним з них, тобто видалення кисню і додавання водню, є відновлення.
