25.9: Спирти
- Page ID
- 19445
Вода при замерзає\(0^\text{o} \text{C}\), що створює проблеми для автомобілів в зимовий період. Вода в двигуні замерзне і трісне блок двигуна. Щоб цього не допустити, додають антифриз, щоб знизити температуру замерзання рідини. Найпоширенішим антифризом є спирт, відомий як пропіленгліколь. Він багато в чому замінив набагато більш токсичний етиленгліколь. Метанол також можна використовувати як антифриз, головним чином в рідині склоочисника.
Спирти
Спирт - це органічна сполука, яка містить одну або кілька гідроксильних\(\left( \ce{-OH} \right)\) груп. Загальна формула спиртів така\(\ce{R-OH}\). Не плутайте спирти з неорганічними основами, які містять гідроксид-іон\(\left( \ce{OH^-} \right)\). \(\ce{-OH}\)Група в спирті ковалентно пов'язана з атомом вуглецю і не іонізується в розчині. Етапи іменування спиртів наведені нижче.
- Назвіть батьківську сполуку, знайшовши найдовший безперервний ланцюг атомів вуглецю, який також містить гідроксильну групу. Якщо в молекулі є одна гідроксильна група, змініть кінцеву -е в назві алкану на -ол. Якщо існує більше однієї гідроксильної групи, використовуйте повну назву алкану і додайте суфікс для позначення кількості гідроксильних груп. Наприклад, дві гідроксильні групи - це -діол, три -тріол і ін.
- Пронумеруйте вуглецевий ланцюг таким чином, щоб сума гідроксильних чисел була максимально низькою.
- Додайте числовий префікс в ім'я перед назвою алкоголю.
- Відокремлюйте числа комами і відокремте цифри від імен або префіксів дефісом. У назві немає пробілів.
Нижче наведено три приклади спиртів та їх назви IUPAC.

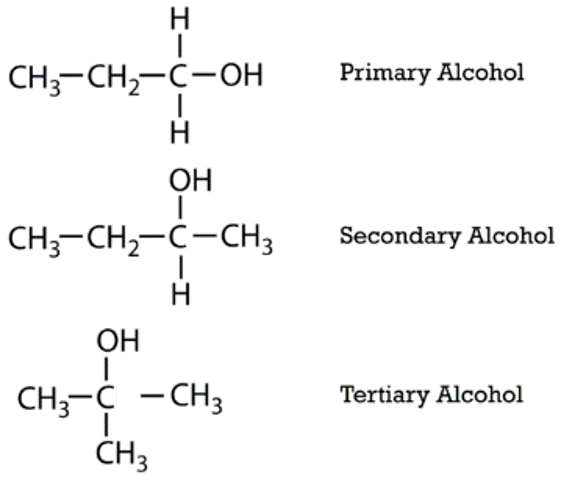
Аліфатичні спирти можна класифікувати за кількістю\(\ce{R}\) груп, приєднаних до вуглецю з гідроксильною групою. Якщо до цього вуглецю приєднана одна\(\ce{R}\) група, спирт є первинним спиртом. Якщо приєднані дві\(\ce{R}\) групи, то спирт є вторинним алкоголем. Якщо приєднані три\(\ce{R}\) групи, то алкоголь є третинним алкоголем. Нижче наведено приклад кожного з них. Первинним спиртом є 1-пропанол, вторинний спирт - 2-бутанол, а третинний - 2-метил-2-пропанол.
властивості спиртів
Найменші і легкі спирти (метанол, етанол, пропанол) повністю розчиняються у воді у всіх пропорціях. У розчині гідроксильні групи молекул спирту і молекули води утворюють водневі зв'язки між собою, в результаті чого відбувається повна змішуваність. Однак зі збільшенням довжини вуглецевого ланцюга розчинність зменшується. Розчинність 1-бутанолу\(7.4 \: \text{g}\) становить на\(100 \: \text{g}\) воді, тоді як 1-пентанол -\(2.7 \: \text{g}\) на\(100 \: \text{g}\) воду, а 1-октанол -\(0.06 \: \text{g}\) на\(100 \: \text{g}\) воду. Частина вуглецевого ланцюга більшої молекули спирту неполярна і призводить до зниження розчинності загальної сполуки.
Наявність водневих зв'язків в спиртах пояснює також відносно високі температури кипіння спиртів в порівнянні з алканами аналогічної молярної маси (див. Таблицю нижче).
| З'єднання | Формула | Молярна маса\(\left( \text{g/mol} \right)\) | Точка кипіння\(\left( ^\text{o} \text{C} \right)\) |
|---|---|---|---|
| етану | \(\ce{CH_3CH_3}\) | \ (\ ліворуч (\ текст {г/моль}\ праворуч)\) ">32 | \ (\ ліворуч (^\ text {o}\ text {C}\ праворуч)\) ">-88 |
| метанол | \(\ce{CH_3OH}\) | \ (\ ліворуч (\ text {г/моль}\ праворуч)\) ">30 | \ (\ ліворуч (^\ текст {o}\ текст {C}\ праворуч)\) ">64.7 |
| пропан | \(\ce{CH_3CH_2CH_3}\) | \ (\ ліворуч (\ текст {г/моль}\ праворуч)\) ">44 | \ (\ ліворуч (^\ текст {o}\ текст {C}\ праворуч)\) ">-42.1 |
| етанолу | \(\ce{CH_3CH_2OH}\) | \ (\ ліворуч (\ текст {г/моль}\ праворуч)\) ">46 | \ (\ ліворуч (^\ текст {o}\ текст {C}\ праворуч)\) ">78.3 |
Лише слабкі сили лондонської дисперсії утримують молекули неполярних алканів разом у рідкій фазі. Отже, потрібно менше енергії, щоб відірвати ці молекули від поверхні рідини і перетворити їх в пару. Більш міцний водневий зв'язок між молекулами спирту означає, що для перетворення рідини в пару потрібно більше енергії, і тому температура кипіння висока.
Резюме
- Спирт - це органічна сполука, яка містить одну або кілька гідроксильних\(\left( \ce{-OH} \right)\) груп.
- Найлегші спирти (метанол, етанол, пропанол) повністю розчиняються у воді у всіх пропорціях; при збільшенні довжини вуглецевого ланцюга розчинність зменшується.
- Наявність водневих зв'язків в спиртах також пояснює відносно високі температури кипіння спиртів в порівнянні з алканами аналогічної молярної маси.