21.6: Бронстед-Лоурі кислотно-лужні реакції
Римський бог Янус вважався богом воріт, дверей, початків і закінчень. Його зображують двома особами, дивлячись відразу в дві сторони. Янус був би в хорошому становищі, щоб подивитися на кислотно-лужні реакції, які ми бачимо в цій концепції, оскільки вони є рівноважними реакціями, що включають дві різні форми як кислот, так і підстав.
Brønsted-Lowry Кислотно-лужні реакції
Кислотно-лужною реакцією, згідно з визначенням Бронстеда-Лоурі, є перенесення протона з однієї молекули або іона в іншу. При розчиненні аміаку у воді він проходить наступну оборотну реакцію.
NH3(aq)+H2O(l)⇌NH+4(aq)+OH−(aq)baseacidacidbase
У цій реакції молекула води дарує протон молекулі аміаку. Отримані продукти - іон амонію і гідроксид-іон. Вода діє як кислота Бронстед-Лоурі, тоді як аміак діє як основа Бронстед-Лоурі. Гідроксид-іон, який виробляється, змушує розчин бути основним.
Ми також можемо розглянути зворотну реакцію в наведеному вище рівнянні. У цій реакції іон аміаку дарує протон гідроксидному іону. Іон амонію - це кислота Бронстеда-Лоурі, тоді як гідроксидний іон є основою Бронстеда-Лоурі. Більшість кислотно-лужних реакцій Бронстеда-Лоурі можна проаналізувати таким чином. Одна кислота і одна основа є реагентами, а одна кислота і одна основа - продукти.
У вищевказаній реакції вода виступала в ролі кислоти, яка може здатися трохи несподіваною. Вода також може виступати в якості основи в кислотно-лужній реакції Бронстеда-Лоурі, якщо вона реагує з речовиною, яка є кращим донором протонів. Нижче показана реакція води з іоном сульфату водню.
HSO−4(aq)+H2O(l)⇌H3O+(aq)+SO2−4(aq)acidbaseacidbase
Так, вода здатна бути або кислотою, або основою, характеристикою називається амфотеризм. Амфотерна речовина - це та, яка здатна діяти як кислота або основа, жертвуючи або приймаючи іони водню.
Кон'югатні кислоти та основи
Коли речовина, яка діє як кислота Бронстеда-Лоурі, здає свій протон, вона стає основою в зворотній реакції. У вищеописаній реакції іон сульфату(HSO−4) водню дарує протон воді і стає сульфатним іоном(SO2−4). TheHSO−4 іSO2−4 пов'язані один з одним наявністю або відсутністюH+ іона. Кон'югатна кислотно-лужний пара - це пара речовин, пов'язаних втратою або посиленням одного іона водню. Кон'югатна кислота - це частинка, що утворюється, коли основа приймає протон. Іон сульфату водню - це кон'югатна кислота сульфатного іона. Кон'югатна основа - це частинка, що утворюється, коли кислота дарує протон. Сульфат-іон є кон'югатною основою іона сульфату водню.
У реакції, проілюстрованої нижче, вода служить одночасно кислотою і основою. Одна молекула води служить кислотою і дарує протон. Інша молекула води функціонує як основа, приймаючи протон.
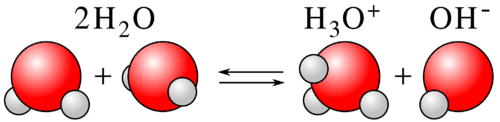
Типова кислотно-лужна реакція Брёнстеда-Лоурі містить дві кон'югатні кислотно-лужні пари, як показано нижче.
HNO2(aq)+PO3−4(aq)⇌NO−2(aq)+HPO2−4(aq)
Одна спряжена кислотно-лужної пари -NHO2/NO−2, тоді як інша пара -HPO2−4/PO3−4.
Резюме
- Кислотно-лужною реакцією, згідно з визначенням Бронстеда-Лоурі, є перенесення протона з однієї молекули або іона в іншу.
- Кон'югатна кислотно-лужний пара - це пара речовин, пов'язаних втратою або посиленням одного іона водню.
- Кон'югатна кислота - це частинка, що утворюється, коли основа приймає протон.
- Кон'югатна основа - це частинка, що утворюється, коли кислота дарує протон.
- Наведено приклади спряжених кислотно-лужних пар.