21.3: Арренієві кислоти
Венера - планета, найближча до Землі, але має зовсім інше і вороже середовище. Він має температуру поверхні, яка середня навколо450oC. Атмосфера складається з вуглекислого газу, але хмари сірчаної кислоти рухаються через верхню атмосферу, допомагаючи створити вкрай недружні умови. Через цих умов Венера - це не те місце, яке хочеться відвідати на відпочинку.
Арренієві кислоти
Шведський хімік Сванте Арреніус (1859-1927) першим запропонував теорію для пояснення спостережуваної поведінки кислот і підстав. Через їх здатності проводити струм він знав, що і кислоти, і основи містять іони в розчині. Арренієва кислота - це сполука, яка іонізується для отримання іонів водню(H+) у водному розчині.
Кислоти - молекулярні сполуки з іонізуючими атомами водню. Іонізуються лише атоми водню, що входять до складу високополярної ковалентної зв'язку. Хлористий водень(HCl) - це газ кімнатної температури і під нормальним тиском. H−ClЗв'язок в хлористому водні є полярним зв'язком. Атом водню дефіцит електронів через більш високу електронегативність атома хлору. Отже, атом водню притягується до самотній парі електронів в молекулі водиHCl при розчиненні у воді. Результатом є те, щоH−Cl зв'язок розривається, причому обидва зв'язку електронів залишаються з собоюCl, утворюючи хлорид-іон. H+Іон прикріплюється до молекули води, утворюючи багатоатомний іон, званий іоном гідронію. Іон гідронію(H3O+) можна розглядати як молекулу води з додатковим приєднаним іоном водню.
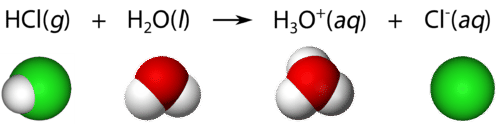
Рівняння, що показують іонізацію кислоти у воді, часто спрощуються, пропускаючи молекулу води:
HCl(g)→H+(aq)+Cl−(aq)
Це лише спрощення попереднього рівняння, але воно зазвичай використовується. Будь-які іони водню у водному розчині будуть приєднані до молекул води у вигляді іонів гідронію.
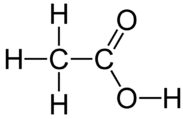
Не всі атоми водню в молекулярних сполуках є іонізуючими. У метані(CH4) атоми водню ковалентно пов'язані з вуглецем в зв'язках, які лише трохи полярні. Атоми водню не здатні до іонізації, а метан не має кислих властивостей. Оцтова кислота(CH3COOH) відноситься до класу кислот, званих органічними кислотами. У молекулі є чотири атоми водню, але тільки той водень, який пов'язаний з атомом кисню, є іонізуючим.
У таблиці нижче перераховані деякі найбільш поширені кислоти:
| Таблиця21.3.1: Загальні кислоти | |
|---|---|
| \ (\ pageIndex {1}\): Загальні кислоти» style="вертикальне вирівнювання: середина; "> Назва кислоти | Формула |
| \ (\ pageIndex {1}\): Загальні кислоти» style="вертикальне вирівнювання: середній; ">Соляна кислота | HCl |
| \ (\ pageIndex {1}\): Загальні кислоти» style="вертикальне вирівнювання: середній; ">Азотна кислота | HNO3 |
| \ (\ pageIndex {1}\): Загальні кислоти» style="вертикальне вирівнювання: середина; ">Сірчана кислота | H2SO4 |
| \ (\ pageIndex {1}\): Загальні кислоти» style="вертикальне вирівнювання: середній; ">Фосфорна кислота | H3PO4 |
| \ (\ pageIndex {1}\): Загальні кислоти» style="вертикальне вирівнювання: середній; ">Оцтова кислота | CH3COOH |
| \ (\ pageIndex {1}\): Загальні кислоти» style="вертикальне вирівнювання: середина; ">Хлорнуватиста кислота | HClO |
Монопротоновая кислота - це кислота, яка містить всього один іонізуючий водень. Соляна кислота і оцтова кислоти - це монопротонові кислоти. Поліпротова кислота - це кислота, яка містить множинні іонізуючі водні. Найбільш поширеними поліпротовими кислотами є або дипротоновая (наприкладH2SO4), або трипротова (наприкладH3PO4).
Резюме
- Арренієва кислота - це сполука, яка іонізується для отримання іонів водню(H+) у водному розчині.
- Наводяться приклади арренієвих кислот.