21.7: Кислоти та основи Льюїса
- Page ID
- 19443
Ідеї в науці не залишаються статичними. Одне відкриття будується на іншому. Поняття кислот і основ виросло від фундаментальних ідей Арренія до Бренстед-Лоурі до Льюїса. Кожен крок додає нашому розумінню навколишнього світу і робить «загальну картину» ще більшою.
Кислоти та основи Льюїса
Гілберт Льюїс (1875-1946) запропонував третю теорію кислот і основ, яка є навіть більш загальною, ніж теорії Арренія або Бренстеда-Лоурі. Кислота Льюїса - це речовина, яка приймає пару електронів для формування ковалентного зв'язку. Основа Льюїса - це речовина, яка дарує пару електронів для формування ковалентного зв'язку. Отже, кислотно-лужну реакцію Льюїса представляє перенесення пари електронів від основи до кислоти. Іон водню, якому не вистачає будь-яких електронів, приймає пару електронів. Це кислота як під визначеннями Бронстеда-Лоурі, так і Льюїса. Аміак складається з атома азоту як центрального атома з самотньою парою електронів. Реакцію між аміаком і іоном водню можна зобразити так, як показано на малюнку нижче.
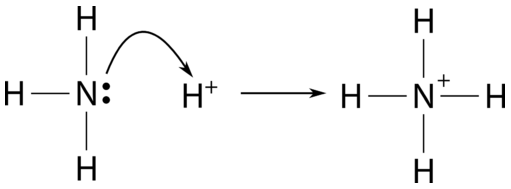
Самотня пара на атомі азоту переноситься на іон водню, роблячи основу\(\ce{NH_3}\) Льюїса, тоді як кислота Льюїса.\(\ce{H^+}\)
Деякі реакції, які не кваліфікуються як кислотно-лужні реакції за іншими визначеннями, роблять це лише під визначенням Льюїса. Прикладом може служити реакція аміаку з трифторидом бору.
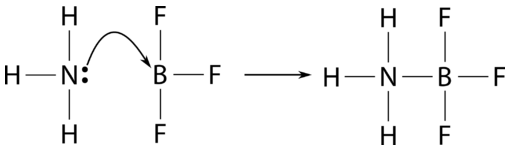
Трифторид бору - кислота Льюїса, тоді як аміак знову є основою Льюїса. Оскільки в цій реакції не бере участі іона водню, він кваліфікується як кислотно-лужну реакцію лише за визначенням Льюїса. Наведена нижче таблиця узагальнює три кислотно-лужні теорії.
| Таблиця\(\PageIndex{1}\): Кислотно-лужні визначення | ||
|---|---|---|
| \ (\ pageIndex {1}\): Кислотно-лужні визначення» style="вертикальне вирівнювання: middle; "> Тип | Кислота | База |
| \ (\ pageIndex {1}\): Кислотно-лужні визначення» style="вертикальне вирівнювання: middle; ">Arrhenius | \(\ce{H^+}\)іони в розчині | \(\ce{OH^-}\)іони в розчині |
| \ (\ PageIndex {1}\): Кислотно-лужні визначення» style="вертикальне вирівнювання: middle; "> Brønsted-Lowry | \(\ce{H^+}\)донор | \(\ce{H^+}\)акцептор |
| \ (\ pageIndex {1}\): Кислотно-лужні визначення» style="вертикальне вирівнювання: середній; "> Льюїс | електронно-парний акцептор | електронно-парний донор |
Резюме
- Кислота Льюїса - це речовина, яка приймає пару електронів для формування ковалентного зв'язку.
- Основа Льюїса - це речовина, яка дарує пару електронів для формування ковалентного зв'язку.
- Наводяться приклади кислот і основ Льюїса.