21.5: Бронстед-низькі кислоти та основи
Концепція Arrhenius кислот і основ була значним внеском у наукове розуміння кислот і підстав. Він замінив і розширив оригінальну ідею Лавуазьє про те, що всі кислоти містять кисень. Однак теорія Арренія також мала свої недоліки. При цьому не враховувалася роль розчинника. Крім того, це поняття не стосувалося кислотно-лужної поведінки в розчинниках, таких як бензол, де не могло бути іонізації. Отже, імперативом було формування нової теорії, яка будувалася на знахідках Арренія, але і вийшла за їх межі.
Бронстед-Lowry кислоти і основи
Визначення Arrhenius кислот і підстав дещо обмежене. Є деякі сполуки, властивості яких свідчать про те, що вони є або кислими, або основними, але які не кваліфікуються відповідно до визначення Арренія. Прикладом може служити аміак(NH3). Його водний розчин стає лакмусовим синім, він вступає в реакцію з кислотами і виводить всі інші властивості основи. Однак він не містить гідроксид-іона. У 1923 році більш широке визначення кислот і основ було самостійно запропоновано датським хіміком Йоханнесом Бронстедом (1879-1947) і англійським хіміком Томасом Лоурі (1874-1936). Кислота Бронстеда-Лоурі - це молекула або іон, який дарує іон водню в реакції. Основа Бронстеда-Лоурі - це молекула або іон, який приймає іон водню в реакції. Іон водню зазвичай називають протоном, і тому кислоти та основи є донорами протонів та акцепторами протонів відповідно відповідно до визначення Бронстеда-Лоурі. Всі речовини, які класифікуються як кислоти та основи під визначенням Arrhenius, також визначаються як такі під визначенням Бронстеда-Лоурі. Нове визначення, однак, включає деякі речовини, які залишаються поза увагою відповідно до визначення Арренія.
Яку молекулу кваліфікували б як основу Бронстеда-Лоурі? Ці молекули повинні вміти приймати іон водню (або протон). На думку спадають дві можливості: аніон, який може утворювати нейтральне з'єднання з протоном, або молекула, в якій один або кілька атомів мають однопарні електрони. Найбільш очевидним аніоном є основа АрреніусаOH−. Цей іон може утворювати молекулу води з протоном, приймаючи протон. CH3COO−Ацетатний аніон - ще один аніон, який може поєднуватися з протоном, утворюючи оцтову кислоту. Однопарні електронні групи включали б атом азоту (див. Малюнок нижче). Два електрони у верхній частині атома азоту не пов'язані ні в одному типі зв'язку, але вони легко взаємодіють з оголеним протоном.
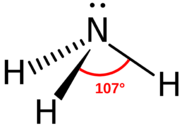
Кисень - це ще один атом з одинокими парами електронів, які можуть функціонувати як основа Бронстеда-Лоурі.

Два поодинокі електрони (зліва і знизу атома) можуть утворювати поодинокі ковалентні зв'язки з іншими атомами, тоді як дві пари подвійних електронів (верхній і правий) доступні для взаємодії з іоном водню.
Резюме
- Кислота Бронстеда-Лоурі - це молекула або іон, який дарує іон водню в реакції.
- Основа Бронстеда-Лоурі - це молекула або іон, який приймає іон водню в реакції.