14.11: Реальні та ідеальні гази
Поведінка молекули багато в чому залежить від її структури. Дві сполуки з однаковою кількістю атомів можуть діяти дуже по-різному. Етанол(C2H5OH) - це прозора рідина, яка має температуру кипіння близько79oC. (CH3OCH3)Диметилефір має однакову кількість вуглеців, воднів та кисню, але кипить при значно нижчій температурі(−25oC). Різниця полягає в величині міжмолекулярної взаємодії (міцніH -зв'язки для етанолу, слабкі сили ван дер Ваальса для ефіру).
Реальні та ідеальні гази
Ідеальним газом є той, який дотримується законів газу при будь-яких умовах температури і тиску. Для цього газ повинен повністю дотримуватися кінетико-молекулярної теорії. Частинки газу повинні займати нульовий об'єм, і вони не повинні проявляти ніяких привабливих сил один до одного. Оскільки жодна з цих умов не може бути правдою, немає такого поняття, як ідеальний газ. Реальний газ - це газ, який поводиться не за припущеннями кінетико-молекулярної теорії. На щастя, в умовах температури та тиску, які зазвичай зустрічаються в лабораторії, справжні гази, як правило, поводяться дуже як ідеальні гази.
За яких умов тоді гази поводяться найменш ідеально? Коли газ піддається високому тиску, його молекули змушуються ближче один до одного, оскільки порожній простір між частинками зменшується. Зменшення порожнього простору означає, що припущення про те, що обсяг самих частинок мізерно малий, менш справедливо. Коли газ охолоджується, зниження кінетичної енергії частинок змушує їх сповільнюватися. Якщо частинки рухаються з повільнішими швидкостями, сили притягання між ними більш помітні. Інший спосіб розглядати це полягає в тому, що тривале охолодження газу врешті-решт перетворить його в рідину, а рідина, безумовно, більше не є ідеальним газом (див. Рідкий азот на малюнку нижче). Підсумовуючи, реальний газ найбільше відхиляється від ідеального газу при низьких температурах і високих тисках. Гази найбільш ідеальні при високій температурі і низькому тиску.

На малюнку нижче показаний графікPVRT побудованого проти тиску газу при1mol трьох різних температурах—200K500K, і 1000\:\ text {K}\). Ідеальний газ мав би значення 1 для цього співвідношення при всіх температурах і тисках, а графік просто буде горизонтальною лінією. Як видно, відбуваються відхилення від ідеального газу. Коли тиск починає зростати, сили притягання призводять до того, що обсяг газу буде меншим, ніж очікувалося, а значенняPVRT падає менше 1. Постійне підвищення тиску призводить до того, що обсяг частинок стає значним, а значенняPVRT піднімається до більш ніж 1. Зверніть увагу, що величина відхилень від ідеальності є найбільшою для газу принаймні200K і принаймні для газу при1000K.
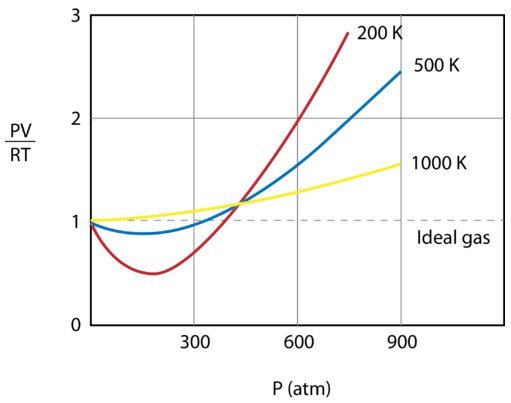
Ідеальність газу також залежить від сили та типу міжмолекулярних сил привабливості, які існують між частинками. Гази, сили притягання яких слабкі, більш ідеальні, ніж ті, що мають сильні привабливі сили. При тій же температурі і тиску неон є більш ідеальним, ніж водяна пара, оскільки атоми неону притягуються лише слабкими силами дисперсії, тоді як молекули водяної пари притягуються відносно сильними водневими зв'язками. Гелій є більш ідеальним газом, ніж неон, оскільки його менша кількість електронів означає, що сили дисперсії гелію ще слабкіші, ніж сили неону.
Резюме
- Реальний газ - це газ, який поводиться не за припущеннями кінетико-молекулярної теорії.
- Описано властивості реальних газів та їх відхилення від ідеальності.