14.3: Закон Бойля
- Page ID
- 19692
Щодня запускаються сотні повітряних куль. Зроблений з синтетичного каучуку і несе коробку інструментів, кожен наповнений гелієм повітряна куля піднімається вгору в небо. Коли повітряна куля набирає висоту, атмосферний тиск стає менше, а повітряна куля розширюється. У якийсь момент повітряна куля лопається через розширення; інструменти падають (за допомогою парашута), щоб бути витягнуті та вивчені для отримання інформації про погоду.
Закон Бойла
Роберт Бойл (1627-1691), англійський хімік, широко вважається одним із засновників сучасної експериментальної науки хімії. Він виявив, що подвоєння тиску закритого зразка газу при збереженні його температури постійною призвело до зменшення обсягу газу вдвічі. Закон Бойла стверджує, що обсяг даної маси газу змінюється обернено з тиском, коли температура підтримується постійною. Зворотний зв'язок описується таким чином. При збільшенні вартості однієї змінної зменшується інша змінна.
Фізично, що відбувається? Молекули газу рухаються і знаходяться на певній відстані один від одного. Збільшення тиску зближує молекули, зменшуючи обсяг. Якщо тиск знижується, гази можуть вільно рухатися в більшому обсязі.

Математично закон Бойла може бути виражений рівнянням:
\[P \times V = k\nonumber \]
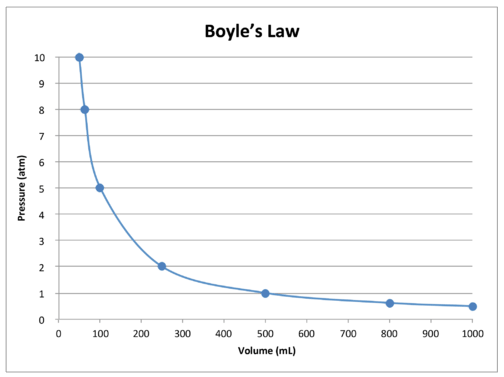
The\(k\) є постійною для даної проби газу і залежить тільки від маси газу і температури. У таблиці нижче наведені дані про тиск і обсяг для заданої кількості газу при постійній температурі. Третій стовпець представляє значення константи\(\left( k \right)\) для цих даних і завжди дорівнює тиску, помноженому на обсяг. Оскільки одна зі змінних змінюється, інша змінюється таким чином, що твір\(P \times V\) завжди залишається незмінним. У цьому конкретному випадку, що константа є\(500 \: \text{atm} \cdot \text{mL}\).
| Тиск\(\left( \text{atm} \right)\) | Обсяг\(\left( \text{mL} \right)\) | \(P \times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) |
|---|---|---|
| \ (\ left (\ text {atm}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 0.5 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 1000 | \ (P\ times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру;" >500 |
| \ (\ left (\ text {atm}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 0.625 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 800 | \ (P\ times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру;" >500 |
| \ (\ left (\ text {atm}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">1.0 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 500 | \ (P\ times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру;" >500 |
| \ (\ left (\ text {atm}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">2.0 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 250 | \ (P\ times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру;" >500 |
| \ (\ left (\ text {atm}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 5.0 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 100 | \ (P\ times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру;" >500 |
| \ (\ left (\ text {atm}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">8.0 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">62.5 | \ (P\ times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру;" >500 |
| \ (\ left (\ text {atm}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">10.0 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">50 | \ (P\ times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру;" >500 |
Графік даних у таблиці додатково ілюструє обернену природу взаємозв'язку закону Бойля (див. Малюнок нижче). Об'єм наноситься на\(x\) -вісь, з відповідним тиском на\(y\) -вісь.
Закон Бойла може бути використаний для порівняння мінливих умов для газу. Використовуємо\(P_1\) і для того,\(V_1\) щоб відстояти початковий тиск і початковий об'єм газу. Після того, як зміни були зроблені,\(P_2\) і\(V_2\) стояти за кінцевий тиск і обсяг. Математичним співвідношенням закону Бойля стає:
\[P_1 \times V_1 = P_2 \times V_2\nonumber \]
Це рівняння може бути використано для обчислення будь-якої з чотирьох величин, якщо відомі інші три.
Приклад\(\PageIndex{1}\)
Зразок кисневого газу має обсяг,\(425 \: \text{mL}\) коли тиск дорівнює\(387 \: \text{kPa}\). Газу дозволяється розширюватися в\(1.75 \: \text{L}\) ємність. Розрахуйте новий тиск газу.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- \(P_1 = 387 \: \text{kPa}\)
- \(V_1 = 425 \: \text{mL}\)
- \(V_2 = 1.75 \: \text{L} = 1750 \: \text{mL}\)
Невідомий
Використовуйте закон Бойла для вирішення невідомого тиску\(\left( P_2 \right)\). Важливо, щоб два томи (\(V_1\)і\(V_2\)) виражалися в однакових одиницях, тому\(V_2\) було перетворено в\(\text{mL}\).
Крок 2: Вирішіть.
По-перше, переставити рівняння алгебраїчно для розв'язання для\(P_2\).
\[P_2 = \frac{P_1 \times V_1}{V_2}\nonumber \]
Тепер підставляємо відомі величини в рівняння і вирішуємо.
\[P_2 = \frac{387 \: \text{kPa} \times 425 \: \text{mL}}{1750 \: \text{mL}} = 94.0 \: \text{kPa}\nonumber \]
Крок 3: Подумайте про свій результат.
Обсяг збільшився до трохи більше 4 разів від початкового значення, і тому тиск зменшується приблизно на одну четверту. Тиск знаходиться в\(\text{kPa}\) і значення має три значущі цифри. Зверніть увагу, що будь-які одиниці тиску або обсягу можна використовувати до тих пір, поки вони узгоджені протягом всієї проблеми.