2.2: Концентрація
- Page ID
- 25000
Концентрація - це загальна одиниця вимірювання, яка повідомляє про кількість розчиненої речовини, присутньої у відомій кількості розчину.
\[\text{concentration} = \dfrac {\text{amount of solute}} {\text{amount of solution}} \label{2.1}\]
Хоча ми пов'язуємо терміни «розчинений» та «розчин» з рідкими зразками, ми можемо також розширити їх використання на газофазні та твердофазні зразки. У таблиці Template:index наведено найбільш поширені одиниці концентрації.
| Ім'я | Одиниці | Символ |
|---|---|---|
| молярність | \(\dfrac {\text{moles solute}} {\text{liters solution}}\) | М |
| формальності | \(\dfrac {\text{moles solute}} {\text{liters solution}}\) | F |
| нормальності | \(\dfrac {\text{equivalents solute}} {\text{liters solution}}\) | П |
| моляльність | \(\dfrac {\text{moles solute}} {\text{kilograms solvent}}\) | м |
| вага відсоток | \(\dfrac {\text{grams solute}} {\text{100 grams solution}}\) | % Вт/Вт |
| обсяг відсоток | \(\dfrac {\text{mL solute}} {\text{100 mL solution}}\) | % в/в |
| вага до обсягу відсоток | \(\dfrac {\text{grams solute}} {\text{100 mL solution}}\) | % Вт/в |
| частин на мільйон | \(\dfrac {\text{grams solute}} {10^6 \text{ grams solution}}\) | проміле |
| частин на мільярд | \(\dfrac {\text{grams solute}} {10^9 \text{ grams solution}}\) | ppb |
Альтернативним виразом для вагового відсотка є
\[\dfrac {\text{grams solute}} {\text{grams solution}} \times 100\ \nonumber\]
Подібні альтернативні вирази можна використовувати для відсотків об'єму та відсотків від ваги до обсягу.
Молярність і формальність
І молярність, і формальність виражають концентрацію як молі розчиненої речовини на літр розчину; однак між ними є тонка різниця. Молярність - це концентрація конкретного хімічного виду. Формальність, з іншого боку, - це загальна концентрація речовини без урахування його специфічної хімічної форми. Немає різниці між молярністю сполуки та формальністю, якщо вона розчиняється без дисоціації на іони. Формальна концентрація розчину глюкози, наприклад, така ж, як і його молярність.
Для з'єднання, яке іонізується в розчині, такого як CaCl 2, молярність і формальність різні. При розчиненні 0,1 моль CaCl 2 в 1 л води розчин містить 0,1 моль Са 2 + і 0,2 моль Cl —. Отже, молярність CaCl 2 дорівнює нулю, оскільки в розчині немає нероз'єднаного CaCl 2; натомість розчин становить 0,1 М у Са 2 + і 0,2 М в Cl -. Однак формальність CaCl 2 становить 0,1 F, оскільки вона являє собою загальну кількість CaCl 2 в розчині. Це більш суворе визначення молярності, в кращу чи гіршу сторону, багато в чому ігнорується в сучасній літературі, як це є в цьому підручнику. Коли ми стверджуємо, що розчин становить 0,1 M CaCl 2, ми розуміємо, що він складається з Ca 2 + та Cl - іонів. Ми зарезервуємо одиницю формальності до ситуацій, коли вона забезпечує більш чіткий опис хімії розчинів.
Молярність використовується настільки часто, що ми використовуємо символічне позначення для спрощення його вираження в рівняннях і в письмовій формі. Квадратні дужки навколо виду вказують на те, що ми маємо на увазі молярність цього виду. Таким чином, [Ca 2 +] читається як «молярність іонів кальцію».
Для розчиненої речовини, яка розчиняється, не піддаючись іонізації, молярність і формальність мають однакове значення. Розчин, який становить 0,0259 М в глюкозі, наприклад, становить 0,0259 F в глюкозі, а також.
Нормальність
Нормальність - це одиниця концентрації, яка більше не використовується; однак, оскільки ви можете зіткнутися з нормальністю в старих довідниках аналітичних методів, корисно зрозуміти її значення. Нормальність визначає концентрацію з точки зору еквівалента, який є кількістю одного хімічного виду, який реагує стехіометрично з іншим хімічним видом. Зауважте, що це визначення робить еквівалентну, а отже, і нормальність, функцію хімічної реакції, в якій бере участь вид. Хоча розчин H 2 SO 4 має фіксовану молярність, його нормальність залежить від того, як він реагує. Більш детальне лікування нормальності ви знайдете в Додатку 1.
Одним з посібників, який все ще використовує нормальність, є Стандартні методи експертизи води та стічних вод, спільна публікація Американської асоціації громадського здоров'я, Американської асоціації водопровідних робіт та Федерації водного середовища. Цей посібник є одним з основних ресурсів для екологічного аналізу води та стічних вод.
Моляльність
Моляльність використовується в термодинамічних розрахунках, де потрібна незалежна від температури одиниця концентрації. Молярність заснована на обсязі розчину, який містить розчинену речовину. Оскільки щільність є залежною від температури властивістю, обсяг розчину і, отже, його молярна концентрація, змінюється з температурою. Використовуючи масу розчинника замість обсягу розчину, отримана концентрація стає незалежною від температури.
Вага, об'єм та відсоток ваги до обсягу
Ваговий відсоток (% w/w), об'ємний відсоток (% v/v) та відсоток ваги до обсягу (% w/v) виражають концентрацію як одиниці розчиненої речовини, присутні в 100 одиницях розчину. Розчин, який становить 1,5% в/в NH 4 NO 3, наприклад, містить 1,5 грама NH 4 NO 3 в 100 мл розчину.
Частини на мільйон і частин на мільярд
Частини на мільйон (ppm) і частини на мільярд (ppb) - це співвідношення, які дають грами розчиненої речовини в відповідно один мільйон або один мільярд грамів зразка. Наприклад, зразок сталі, який становить 450 проміле в Мн, містить 450 мкг Mn на кожен грам сталі. Якщо наблизити щільність водного розчину як 1,00 г/мл, то ми можемо експресувати концентрації розчину в проміле або ppb за допомогою наступних співвідношень.
\[\text{ppm} = \dfrac {\mu \text{g}} {\text{g}} = \dfrac {\text{mg}} {\text{L}} = \dfrac {\mu \text{g}} {\text{mL}} \quad \text{ppb} = \dfrac {\text{ng}} {\text{g}} = \dfrac {\mu \text{g}} {\text{L}} = \dfrac {\text{ng}} {\text{mL}} \nonumber\]
Для газів частина на мільйон зазвичай виражається у вигляді об'ємного співвідношення; наприклад, концентрація гелію 6,3 проміле означає, що один літр повітря містить 6,3 мкл He.
Ви повинні бути обережними при використанні частин на мільйон і частин на мільярд, щоб висловити концентрацію водного розчиненого речовини. Різниця між концентрацією розчиненої речовини в мг/л і нг/г, наприклад, є значною, якщо щільність розчину не становить 1,00 г/мл. З цієї причини багато організацій радять не використовувати абревіатуру ppm і ppb (див. Розділ 7.10.3 на www.nist.gov). Якщо є сумніви, включіть точні одиниці, такі як 0,53 мкг Pb 2 + /L для концентрації свинцю в зразку морської води.
Перетворення між одиницями концентрації
Найбільш поширеними способами вираження концентрації в аналітичній хімії є молярність, ваговий відсоток, відсоток обсягу, відсоток ваги до обсягу, частини на мільйон і частини на мільярд. Загальне визначення концентрації в Equation\ ref {2.1} дозволяє легко конвертувати між одиницями концентрації.
Концентрований розчин аміаку становить 28,0% w/w NH 3 і має щільність 0,899 г/мл. Яка молярна концентрація NH 3 в цьому розчині?
Рішення
\[\dfrac {28.0 \text{ g } \ce{NH3}} {100 \text{ g soln}} \times \dfrac {0.899 \text{ g soln}} {\text{ml soln}} \times \dfrac {1 \text{ mol } \ce{NH3}} {17.03 \text{ g } \ce{NH3}} \times \dfrac {1000 \text{mL}} {\text{L}} = 14.8 \text{ M} \nonumber\]
Гранично допустима концентрація іонів хлориду в комунальному питному водопостачанні становить\(2.50 \times 10^2\) проміле Cl —. Коли подача води перевищує цю межу, вона часто має характерний солоний смак. Яка еквівалентна молярна концентрація Cl —?
Рішення
\[\dfrac {2.50 \times 10^2 \text{ mg } \ce{Cl-}} {\text{L}} \times \dfrac {1 \text{ g}} {1000 \text{ mg}} \times \dfrac {1 \text{ mol } \ce{Cl-}} {35.453 \text{ g} \ce{Cl-}} = 7.05 \times 10^{-3} \text{ M} \nonumber\]
Який розчин - 0,50 М NaCl або 0,25 M SrCl 2 - має більшу концентрацію при вираженні в мг/мл?
- Відповідь
-
Концентрації двох розчинів є
\[\dfrac {0.50 \text{ mol NaCl}} {\text{L}} \times \dfrac {58.44 \text{ g NaCl}} {\text{mol NaCl}} \times \dfrac {10^6 \: \mu \text{g}} {\text{g}} \times \dfrac {1 \text{L}} {1000 \text{ mL}} = 2.9 \times 10^{4} \: \mu \text{g/mL NaCl} \nonumber\]
\[\dfrac {0.25 \text{ mol } \ce{SrCl2}} {\text{L}} \times \dfrac {158.5 \text{ g } \ce{SrCl2}} {\text{mol } \ce{SrCl2}} \times \dfrac {10^6 \: \mu \text{g}} {\text{g}} \times \dfrac {1 \text{L}} {1000 \text{ mL}} = 4.0 \times 10^{4} \: \mu \text{g/ml } \ce{SrCl2} \nonumber\]
Розчин SrCl 2 має більшу концентрацію, коли він виражається в мкг/мл замість в моль/л.
P-функції
Іноді незручно використовувати одиниці концентрації в таблиці Template:index. Наприклад, під час хімічної реакції концентрація виду може змінюватися на багато порядків. Якщо ми хочемо відобразити прогрес реакції графічно, ми можемо помістити концентрацію реагенту як функцію обсягу реагенту, доданого до реакції. Такий випадок на малюнку Template:index для титрування HCl з NaOH. Вісь y у лівій частині малюнка відображає [H +] як функцію об'єму NaOH. Початковий [Н +] становить 0,10 М, а його концентрація після додавання 80 мл NaOH становить\(4.3 \times 10^{-13}\) М. Ми легко можемо стежити за зміною [H +] для додавання перших 50 мл NaOH; однак для решти обсягів NaOH зміна в [H +] занадто мала, щоб побачити.
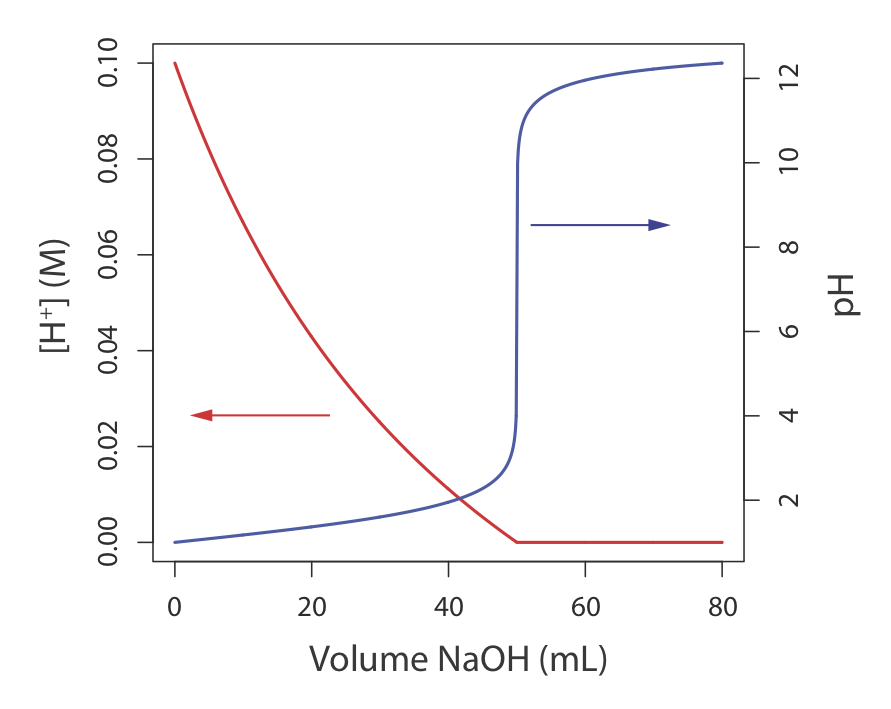
При роботі з концентраціями, які охоплюють багато порядків, часто зручніше виражати концентрацію за допомогою p-функції. p-функція X записується як p X і визначається як
\[\text{p} X = - \log (X) \nonumber\]
РН розчину, який становить 0,10 М Н +, наприклад, становить
\[\text{pH} = - \log [\ce{H+}] = - \log (0.10) = 1.00 \nonumber\]
і рН\(4.3 \times 10^{-13}\) М Н + дорівнює
\[\text{pH} = - \log [\ce{H+}] = - \log (4.3 \times 10^{-13}) = 12.37 \nonumber\]
Рисунок Template:index показує, що побудова pH як функції об'єму NaOH дає більш корисну інформацію про те, як змінюється концентрація H + під час титрування.
Більш підходящим рівнянням для рН\(a_{\ce{H+}}\) є те,\(\text{pH} = - \log (a_{\ce{H+}})\) де активність іона водню. Докладніше див. Розділ 6.9. Наразі приблизного\(\text{pH} = - \log [\ce{H+}]\) рівняння достатньо.
Що таке пНК для розчину\(1.76 \times 10^{-3}\) М Na 3 PO 4?
Рішення
Оскільки кожен моль Na 3 PO 4 містить три молі Na +, концентрація Na + становить
\[[\ce{Na+}] = (1.76 \times 10^{-3} \text{ M}) \times \dfrac {3 \text{ mol } \ce{Na+}} {\text{mol } \ce{Na3PO4}} = 5.28 \times 10^{-3} \text{ M} \nonumber\]
і пНК
\[\text{pNa} = - \log [\ce{Na+}] = - \log (5.28 \times 10^{-3}) = 2.277 \nonumber\]
Пам'ятайте, що pNA 2.777 має три, а не чотири значні цифри; 2, що з'являється на місці, вказує на потужність 10, коли ми пишемо [Na +] як\(0.528 \times 10^{-2}\) М.
Що таке [Н +] в розчині, який має рН 5,16?
Рішення
Концентрація Н + становить
\[\text{pH} = - \log [\ce{H+}] = 5.16 \nonumber\]
\[\log [\ce{H+}] = -5.16 \nonumber\]
\[[\ce{H+}] = 10^{-5.16} = 6.9 \times 10^{-6} \text{ M} \nonumber\]
Нагадаємо, що якщо log (X) = a, то X = 10 a.
Які значення для pNA і PSO 4, якщо ми розчиняємо 1,5 г Na 2 SO 4 в загальному обсязі розчину 500,0 мл?
- Відповідь
-
Концентрації Na + і\(\ce{SO4^{2-}}\) є
\[\dfrac {1.5 \text{ g } \ce{Na2SO4}} {0.500 \text{L}} \times \dfrac {1 \text{ mol } \ce{Na2SO4}} {142.0 \text{ g } \ce{Na2SO4}} \times \dfrac {2 \text{ mol } \ce{Na+}} {\text{mol } \ce{mol } \ce{Na2SO4}} = 4.23 \times 10^{-2} \text{ M } \ce{Na+} \nonumber\]
\[\dfrac {1.5 \text{ g } \ce{Na2SO4}} {0.500 \text{L}} \times \dfrac {1 \text{ mol } \ce{Na2SO4}} {142.0 \text{ g } \ce{Na2SO4}} \times \dfrac {1 \text{ mol } \ce{SO4^{2-}}} {\text{mol } \ce{mol } \ce{Na2SO4}} = 2.11 \times 10^{-2} \text{ M } \ce{SO4^{2-}} \nonumber\]
Значення pNA і PSO 4 є
\[\text{pNa} = - \log (4.23 \times 10^{-2} \text{ M } \ce{Na+}) = 1.37 \nonumber\]
\[\text{pSO}_4 = - \log (2.11 \times 10^{-2} \text{ M } \ce{SO4^{2-}}) = 1.68 \nonumber\]
