23.3: Мембранні іонно-селективні електроди
- Page ID
- 27216
Якби метали були єдиними корисними матеріалами для побудови індикаторних електродів, то корисних застосувань потенціометрії було б мало. У 1906 році Кремер виявив, що різниця потенціалів на тонкій скляній мембрані є функцією рН, коли протилежні сторони мембрани контактують з розчинами, які мають різну концентрацію H 3 O +. Існування цього мембранного потенціалу призвело до розробки нового класу індикаторних електродів, які ми називаємо іоноселективними електродами (ІСЕД). На додаток до скляного pH-електрода доступні іоноселективні електроди для широкого спектру іонів. Також можна сконструювати мембранний електрод для нейтрального аналіту, використовуючи хімічну реакцію для генерації іона, який контролюється іоноселективним електродом. Активним напрямком досліджень продовжує залишатися розробка нових іоноселективних мембранних електродів.
Класифікація іонно-селективних мембран
Існує два широких класу матеріалів, які використовуються в якості мембран: кристалічні твердотільні мембрани і некристалічні мембрани. Прикладами кристалічних твердотільних мембран є монокристали LaF 3 і полікристалічні AgS. Прикладами некристалічних мембран служать скляні і гідрофобні мембрани, які утримують рідкий іонообмінник. Кожен з них розглянуто нижче.
Властивості іонселективних мембран
Щоб бути корисною, іонселективна мембрана повинна бути структурно стабільною (кристалічна мембрана, яка розчинна, наприклад, не є структурно стабільною), здатною оброблятися до відповідного розміру і форми, які можуть бути включені в індикаторний електрод в потенціометричний електрохімічний елемент, електрично провідний, так що можна виміряти потенціал електрохімічної клітини, і селективний по відношенню до аналіту.
Граничний потенціал мембрани
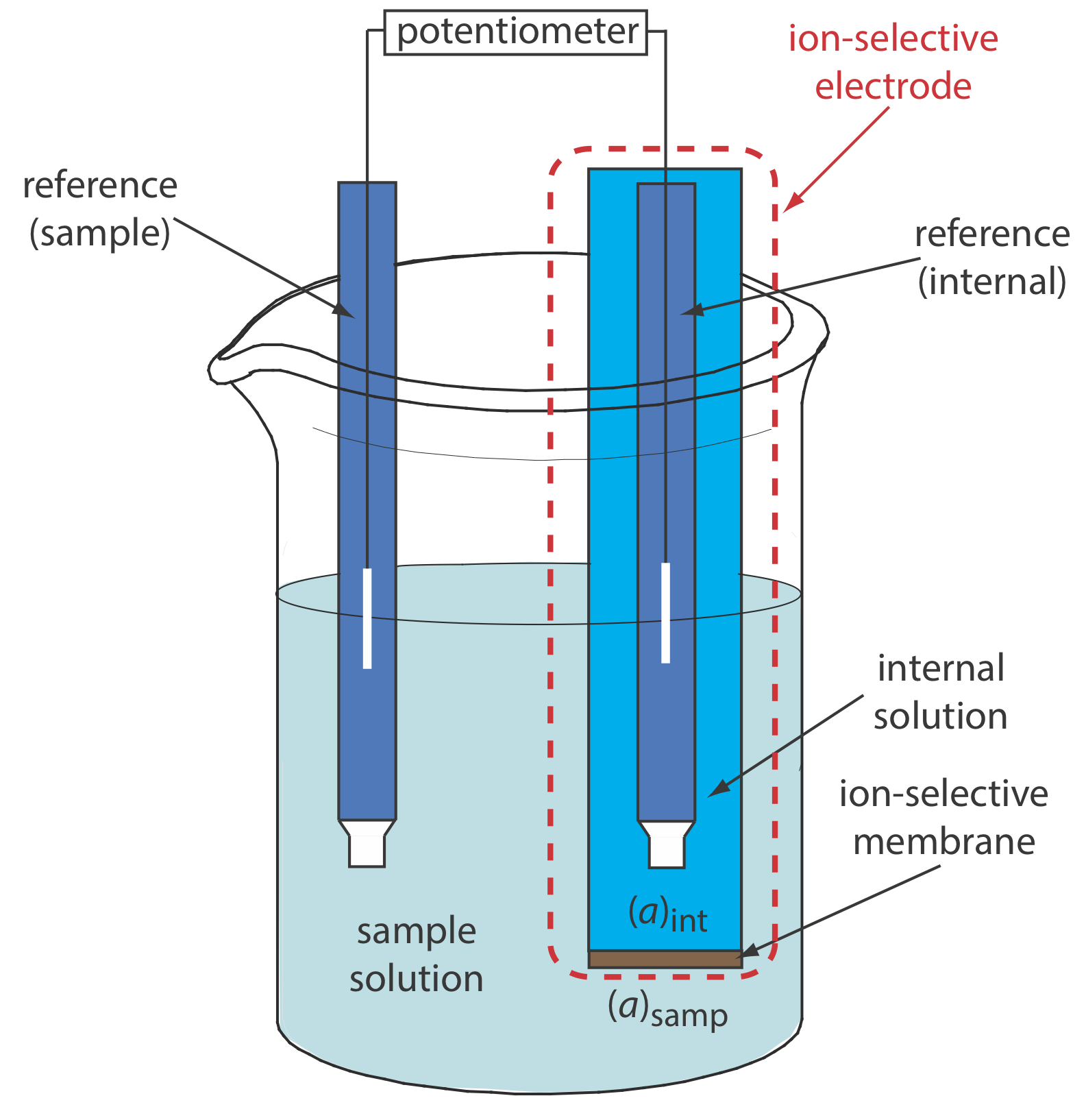
\(\PageIndex{1}\)На малюнку показана типова потенціометрична електрохімічна комірка, оснащена іоноселективним електродом. Коротке позначення руки для цієї клітинки
\[\text { ref (sample) }\left\|\mathrm{A}_{\text { samp }}\left(a q, a_{\mathrm{A_{\text{samp}}}}=x\right) | \text{membrane} | \mathrm{A}_{\text { int }}\left(a q, a_{\mathrm{A_{\text{int}}}}=y\right)\right\| \text { ref (internal) } \nonumber \]
де іоноселективна мембрана розділяє два розчини, що містять аналіт з активністю x і y: розчин зразка і внутрішній розчин іоноселективного електрода. Потенціал цієї електрохімічної клітини
\[E_\text{cell} = E_\text{ref(int)} - E_\text{ref(samp)} + E_\text{mem} \label{membrane1} \]
включає потенціал кожного опорного електрода і різницю потенціалів по всій мембрані, Е мем, яка є граничним потенціалом мембрани. Позначення ref (зразок) і ref (internal) являють собою еталонний електрод, занурений у зразок, і еталонний електрод, занурений у внутрішній розчин іоноселективного електрода. Оскільки потенціал двох опорних електродів є постійним, будь-яка зміна E клітини відображає зміну граничного потенціалу мембрани.
Взаємодія аналіту з мембраною генерує граничний потенціал, якщо є різниця в його активності з двох сторін мембрани. Струм здійснюється через мембрану рухом або аналіта, або іона, вже присутнього в матриці мембрани. Мембранний потенціал задається наступним рівнянням Нернста
\[E_{\mathrm{mem}}=E_{\mathrm{asym}}-\frac{R T}{z F} \ln \frac{\left(a_{A}\right)_{\mathrm{int}}}{\left(a_{A}\right)_{\mathrm{samp}}} \label{membrane2} \]
де (A) samp - активність аналіта у зразку, (A) int - активність аналіта у внутрішньому розчині іонселективного електрода, а z - заряд аналіта. В ідеалі, E mem дорівнює нулю, коли (A) int = (A) samp. Термін E asym, який є потенціалом асиметрії, пояснює той факт, що E mem зазвичай не дорівнює нулю за цих умов.
Наразі просто відзначимо, що різниця в активності аналіта призводить до граничного потенціалу мембрани. Розглядаючи різні типи іоноселективних електродів, ми розглянемо більш конкретно джерело мембранного потенціалу.
Підставляючи рівняння\ ref {membrane2} на рівняння\ ref {membrane1}, припускаючи температуру 25 o С, і перестановка дає
\[E_{\mathrm{cell}}=K+\frac{0.05916}{z} \log \left(a_{A}\right)_{\mathrm{samp}} \label{membrane3} \]
де K - константа, яка включає потенціали двох опорних електродів, потенціал асиметрії та активність аналіта у внутрішньому розчині. Рівняння\ ref {membrane3} є загальним рівнянням і застосовується до всіх типів іоноселективних електродів.
Мембранна селективність
Граничний потенціал мембрани є результатом хімічної взаємодії між аналітом і активними ділянками на поверхні мембрани. Оскільки сигнал залежить від хімічного процесу, більшість мембран не є виборчими до одного аналіту. Натомість граничний потенціал мембрани пропорційний концентрації кожного іона, який взаємодіє з активними ділянками мембрани. Ми можемо переписати Equation\ ref {membrane3}, щоб включити внесок у потенціал інтерферента, I
\[E_\text{cell} = K + \frac {0.05916} {z_A} \log \left\{ a_A + K_{A,I}(a_I)^{z_A/z_I} \right\} \label{membrane4} \]
де z A і z I - заряди аналіта і інтерферента, а K A, I - коефіцієнт вибірковості, що становить відносну реакцію інтерферента. Коефіцієнт селективності визначається як
\[K_{A,I} = \frac {(a_A)_e} {(a_I)_e^{z_A/z_I}} \label{membrane5} \]
де (a) e і (a I) e - діяльність аналіту та інтерференту, що дають однакові потенціали клітин. Коли коефіцієнт селективності дорівнює 1,00, мембрана однаково реагує на аналіт і інтерферент. Мембрана показує хорошу селективність для аналіта , коли K A, I значно менше 1,00.
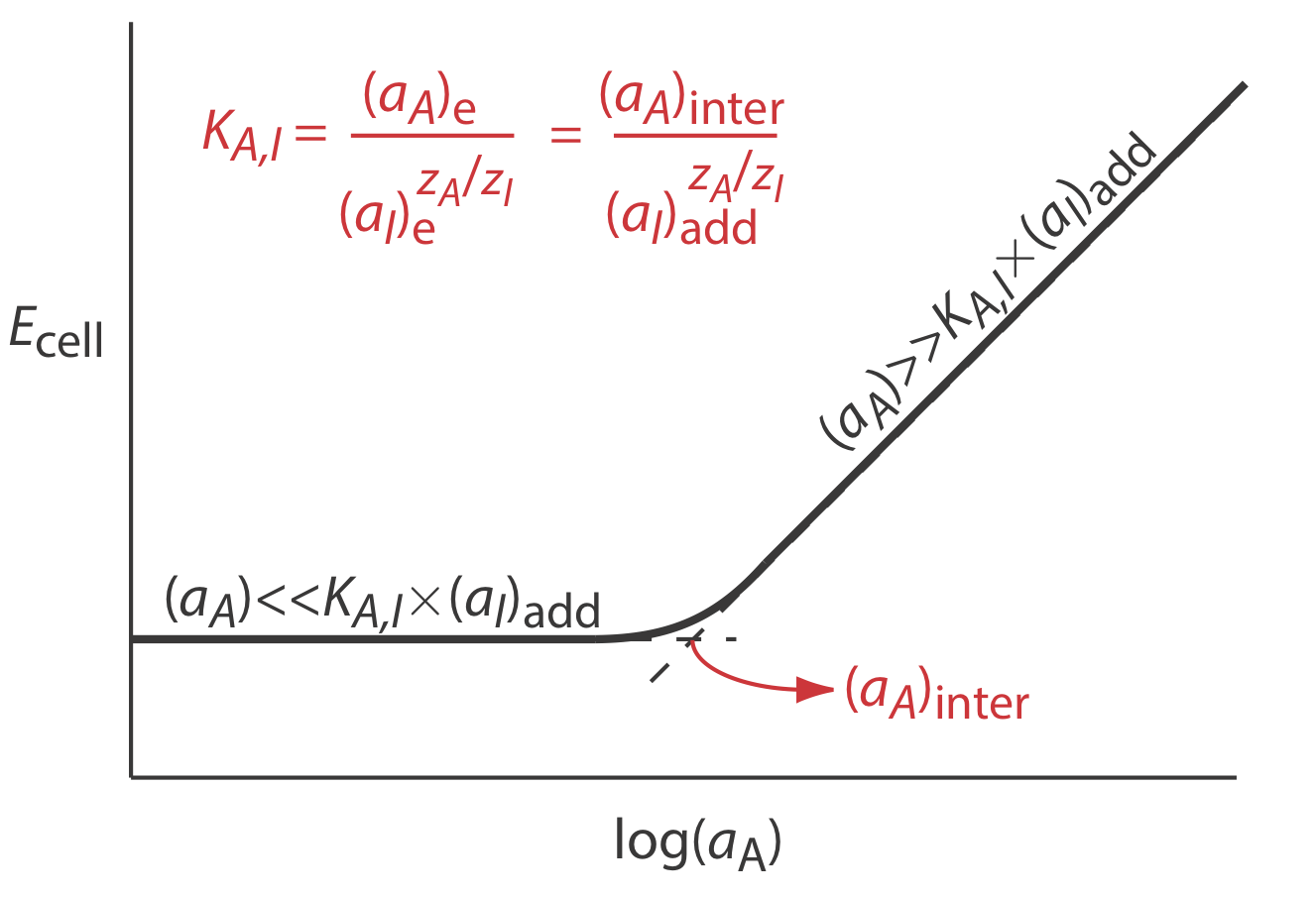
Коефіцієнти селективності для більшості наявних в продажу іоноселективних електродів передбачені виробником. Якщо коефіцієнт селективності невідомий, легко визначити його величину експериментальним шляхом шляхом приготування ряду розчинів, кожен з яких містить однакову активність інтерферентного, (а) додати, але різну активність аналіта. Як показано на малюнку\(\PageIndex{2}\), графік потенціалу клітини порівняно з журналом активності аналіта має дві різні лінійні області. Коли активність аналіту значно більша за K A, I\(\times\) (a I) додати, потенціал є лінійною функцією log (a A), заданою Equation\ ref {membrane3}. Якщо K A, I\(\times\) (a I) додати значно більше активності аналіта, однак потенціал клітини залишається постійним. Активність аналіта та інтерферента на перетині цих двох лінійних областей використовується для обчислення K A, I.
Сокальський та колеги описали спосіб отримання іонселективних електродів зі значно поліпшеною селективністю [Sokalski, T.; Ceresa, A.; Zwicki, T.; Pretsch, EJ Am. Хім. Соц. 1997, 119, 11347—11348]. Наприклад, звичайний Pb 2 + ISE має\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\) значення —3.6. Якщо потенціал для розчину, в якому активність Pb 2 +\(4.1 \times 10^{-12}\) ідентичний такому для розчину, в якому активність Mg 2 + становить 0,01025, яке значення\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\) для їх ISE?
Рішення
Здійснюючи відповідні заміни в Equation\ ref {membrane5}, ми виявимо, що
\[K_{\text{Pb}^{2+}/\text{Mg}^{2+}} = \frac {(a_{\text{Pb}^{2+}})_e} {(a_{\text{Mg}^{2+}})_e^{z_{\text{Pb}^{2+}}/z_{\text{Mg}^{2+}}}} = \frac {4.1 \times 10^{-12}} {(0.01025)^{+2/+2}} = 4.0 \times 10^{-10} \nonumber \]
Значення\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\), отже, становить —9,40.
Скляний електрод для вимірювання рН
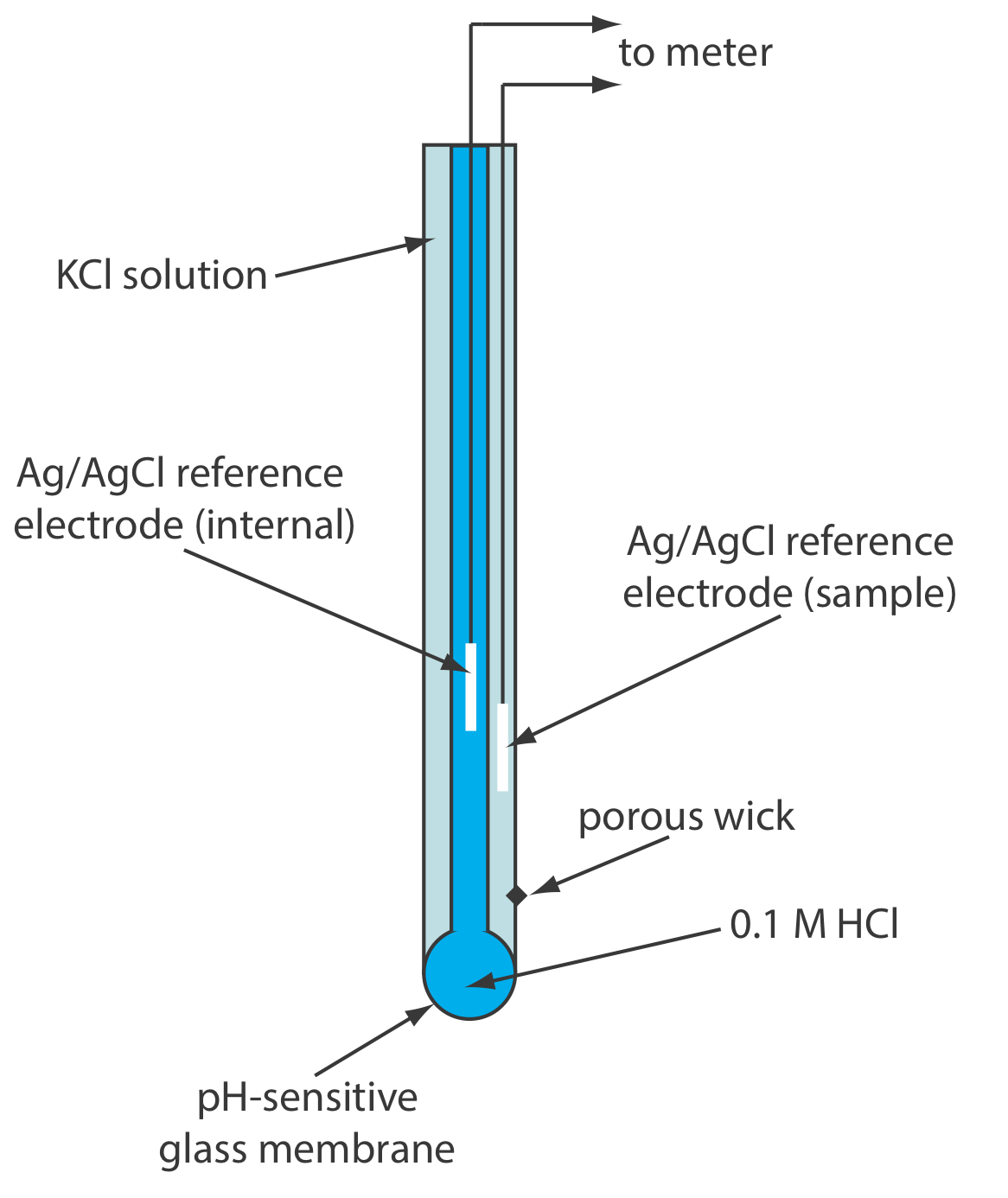
Найбільш ранні іоноселективні електроди базувалися на спостереженні, що тонка скляна мембрана, що розділяє два розчини з різним рівнем кислотності, розвиває вимірну різницю потенціалів на протилежних сторонам мембрани. Включення скляного електрода в потенціометр разом з еталонним електродом забезпечує спосіб вимірювання потенціалу. Комерційні скляні мембранні рН-електроди часто випускаються в комбінованому вигляді, що включає як індикаторний електрод, так і опорний електрод. Використання одного електрода значно спрощує вимірювання рН. Приклад типового комбінованого електрода наведено на малюнку\(\PageIndex{3}\).
Склад і структура скляних мембран
Перші комерційні скляні електроди були виготовлені з використанням Corning 015, скла зі складом, який становить приблизно 22% Na 2 O, 6% CaO та 72% SiO 2. Мембрани, виготовлені з Corning 015, мають чудову селективність для іонів водню H +, нижче рН 9; вище цього рН мембрана стає більш селективною для інших катіонів і виміряне значення рН відхиляється від фактичного значення. Заміна Na 2 O і CaO на Li 2 O і BaO розширює корисний діапазон рН скляних мембран до рівня рН більше 12.
Походження граничного потенціалу скляної мембрани
При зануренні у водний розчин протягом декількох годин зовнішня приблизно 10 нм поверхні скляної мембрани стає гідратованою, в результаті чого утворюються негативно заряджені ділянки, —SiO —. Іони натрію, Na +, служать протиіонами. Оскільки H + зв'язується сильніше з —SiO - ніж Na +, вони витісняють іони натрію з обох сторін мембрани.
\[\mathrm{H}^{+}+-\mathrm{SiO}^{-} \mathrm{Na}^{+}\rightleftharpoons-\mathrm{SiO}^{-} \mathrm{H}^{+}+\mathrm{Na}^{+} \label{glass1} \]
пояснюючи селективність мембрани для Н +. Транспортування заряду через мембрану здійснюється іонами Na + всередині скляної мембрани. Потенціал скляного електрода підпорядковується рівнянню
\[E_{\mathrm{cell}}=K+0.05916 \log a_{\mathrm{H}^{+}} \label{glass2} \]
Лужні та кислотні помилки
Як зазначалося вище, при досить базових значеннях рН скляний електрод більше не забезпечує точного вимірювання рН зразка, оскільки мембрана стає більш селективною для інших одновалентних катіонів, таких як Na + і K +.
Для скляної мембрани Corning 015 коефіцієнт селективності K H + /Na + дорівнює\(\approx 10^{-11}\). Яка очікувана похибка, якщо виміряти рН розчину, в якому активність Н +\(2 \times 10^{-13}\) і активність Na + становить 0,05?
Рішення
Розчин, в якому діє активність Н +, (а Н +),\(2 \times 10^{-13}\) має рН 12,7. Оскільки електрод реагує як на H +, так і на Na +, видима активність додатка H +, (A H +),
\[(a_{\text{H}^+})_\text{app} = (a_{\text{H}^+})_\text{act} + (K_{\text{H}^+ / \text{Na}^+} \times a_{\text{Na}^+}) = 2 \times 10^{-13} + (10^{-11} \times 0.05) = 7 \times 10^{-13} \nonumber \]
Видима активність Н + еквівалентна рН 12,2, похибка -0,5 одиниць рН.
Скляні електроди рН також показують відхилення від ідеальної поведінки при рівнях рН менше 0,5, хоча причини цього не ясні. Все-таки скляний електрод має широкий динамічний діапазон для вимірювання рН.
Інші обмеження скляних електродів
Оскільки скляна мембрана іоноселективного електрода дуже тонка - вона має товщину лише близько 50 мкм - з ними потрібно звертатися обережно, щоб уникнути тріщин або поломок. Скляні електроди зазвичай зберігаються в буфері для зберігання, рекомендованому виробником, що гарантує, що зовнішня поверхня мембрани залишається гідратованою. Якщо скляний електрод висихає, його відновлюють, замочуючи на кілька годин у розчині, який містить аналіт. Склад скляної мембрани з часом буде змінюватися, що впливає на продуктивність електрода. Середній термін служби типового скляного електрода становить кілька років.
Скляні електроди для інших катіонів
Спостереження за тим, що скляна мембрана Corning 015 реагує на іони, відмінні від H +, призвело до розвитку скляних мембран з більшою селективністю для інших катіонів. Наприклад, в якості іоноселективного електрода для Na + використовується скляна мембрана зі складом 11% Na 2 O, 18% Al 2 O 3, а 71% SiO 2. Інші склоіонселективні електроди розроблені для аналізу Li +, K +, Rb +, Cs +\(\text{NH}_4^+\), Ag + та Tl +. У таблиці\(\PageIndex{1}\) наведено кілька прикладів.
Кристалічні мембранні електроди
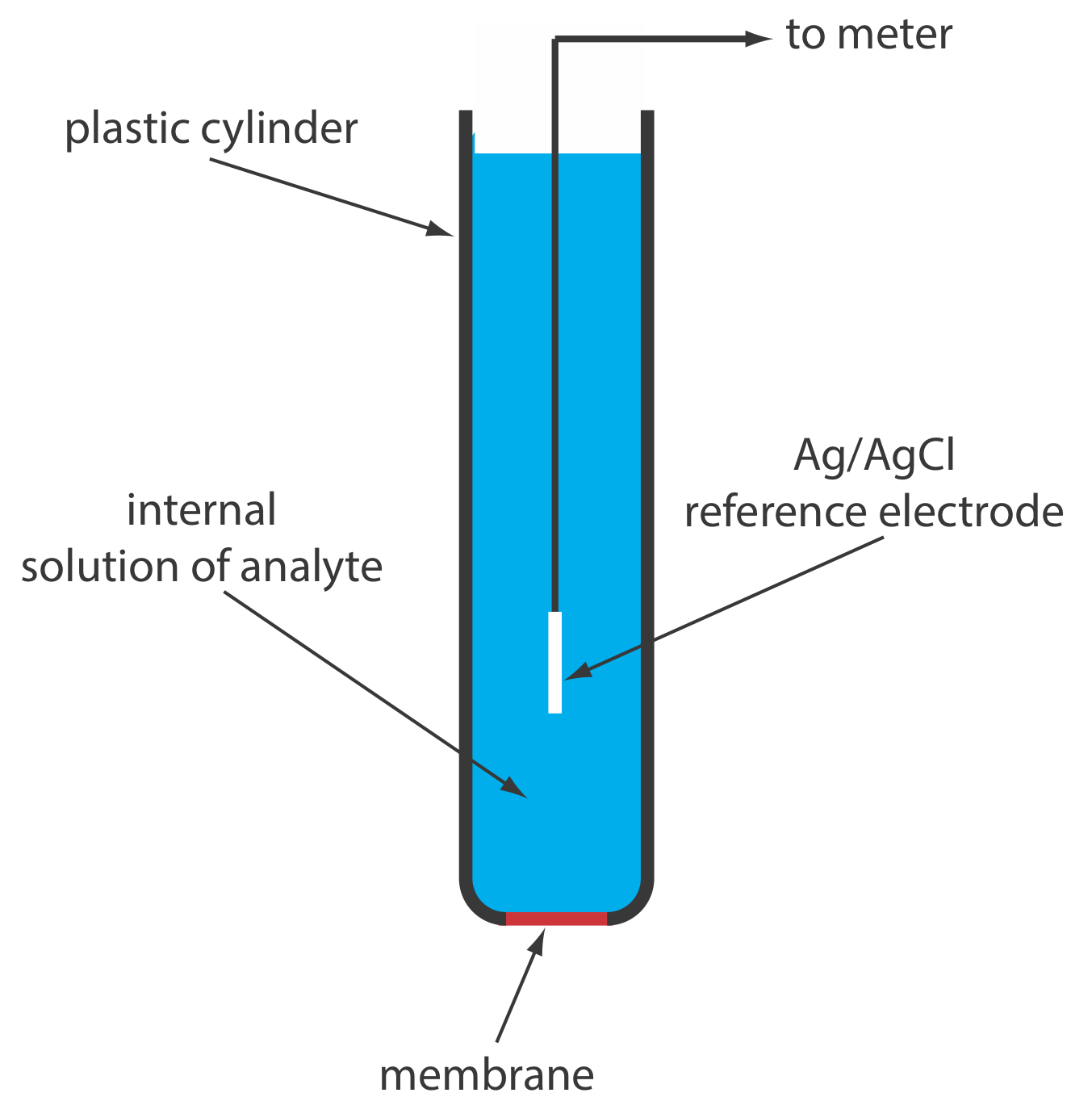
Твердотільний іонселективний електрод має мембрану, яка складається або з полікристалічної неорганічної солі, або з монокристала неорганічної солі. Ми можемо сформувати полікристалічний твердотільний іонселективний електрод, ущільнивши гранулу AGS товщиною 1—2 мм або суміш AgS та другої солі срібла або іншого сульфіду металу - в кінець непровідного пластикового циліндра, заповнивши циліндр внутрішнім розчином, який містить аналіт, і розмістивши еталонний електрод у внутрішній розчин. На малюнку\(\PageIndex{4}\) показана типова конструкція.
NaCl в сільничці є прикладом полікристалічного матеріалу, оскільки він складається з безлічі дрібних кристалів хлориду натрію. З іншого боку, соляні пластини NaCl, що використовуються в ІЧ-спектроскопії, є прикладом монокристала хлориду натрію.
Мембранний потенціал для гранули Ag 2 S розвивається в результаті різниці в ступені реакції розчинності
\[\mathrm{Ag}_{2} \mathrm{S}(s)\rightleftharpoons2 \mathrm{Ag}^{+}(a q)+\mathrm{S}^{2-}(a q) \label{ss1} \]
з двох сторін мембрани, при цьому заряд переноситься через мембрану іонами Ag +. Коли ми використовуємо електрод для контролю активності Ag +, потенціал клітини дорівнює
\[E_{\text {cell }}=K+0.05916 \log a_{\mathrm{Ag}^{+}} \label{ss2} \]
Мембрана також реагує на активність\(\text{S}^{2-}\), з потенціалом клітини
\[E_{\mathrm{cell}}=K-\frac{0.05916}{2} \log a_{\text{S}^{2-}} \label{ss3} \]
Якщо об'єднати нерозчинну сіль срібла, таку як AgCl, з Ag 2 S, то мембранний потенціал також реагує на концентрацію Cl —, з потенціалом клітини
\[E_{\text {cell }}=K-0.05916 \log a_{\mathrm{Cl}^{-}} \label{ss4} \]
Змішуючи Ag 2 S з CdS, CU або PbS, ми можемо зробити іоноселективний електрод, який реагує на активність Cd 2 +, Cu 2+ або Pb 2 +. У цьому випадку потенціал клітини дорівнює
\[E_{\mathrm{cell}}=K+\frac{0.05916}{2} \ln a_{M^{2+}} \label{ss5} \]
де М 2 + - активність іона металу.
У таблиці\(\PageIndex{2}\) наведені приклади полікристалічних твердотільних іонселективних електродів на основі Ag 2 S. Селективність цих іоноселективних електродів залежить від відносної розчинності сполук. A Cl - ISE з використанням мембрани Ag 2 S/AgCl є більш селективним для Br - (K Cl - /Br - = 10 2) і для I - (K Cl - /I - = 10 6) тому що AgBr і AgI менш розчинні, ніж AgCl. Якщо активність Br — досить висока, AgCl на межі розділу мембрана/розчин замінюється AgBr і реакція електрода на Cl — істотно знижується. Більшість полікристалічних іоноселективних електродів, перерахованих в таблиці,\(\PageIndex{2}\) працюють в розширеному діапазоні рівнів рН. Рівновага між S 2— і HS — обмежує аналіз для S 2— до діапазону рН 13—14.
| аналіт | мембранний склад | коефіцієнти вибірковості |
|---|---|---|
| Вік + | Вік 2 С |
\(K_{\text{Ag}^+/\text{Cu}^{2+}} = 10^{-6}\) \(K_{\text{Ag}^+/\text{Pb}^{2+}} = 10^{-10}\) Hg 2 + заважає |
| Кд 2+ | Компакт-диски/Ag 2 S |
\(K_{\text{Cd}^{2+}/\text{Fe}^{2+}} = 200\) \(K_{\text{Cd}^{2+}/\text{Pb}^{2+}} = 6\) Ag +, Hg 2+ та Cu 2+ повинні бути відсутніми |
| Куб 2+ | Куб/мішка 2 S |
\(K_{\text{Cu}^{2+}/\text{Fe}^{3+}} = 10\) \(K_{\text{Cu}^{2+}/\text{Cu}^{+}} = 10^{-6}\) Ag + і Hg 2 + повинні бути відсутніми |
| Пб 2+ | ПБС/Аг 2 S |
\(K_{\text{Pb}^{2+}/\text{Fe}^{3+}} = 1\) \(K_{\text{Pb}^{2+}/\text{Cd}^{2+}} = 1\) Ag +, Hg 2+ та Cu 2+ повинні бути відсутніми |
| Бр — | Агбр/мітка 2 S |
\(K_{\text{Br}^-/\text{I}^{-}} = 5000\) \(K_{\text{Br}^-/\text{Cl}^{-}} = 0.005\) \(K_{\text{Br}^-/\text{OH}^{-}} = 10^{-5}\) S 2— має бути відсутнім |
| Cl — | АГКЛ/Міг 2 S |
\(K_{\text{Cl}^-/\text{I}^{-}} = 10^{6}\) \(K_{\text{Cl}^-/\text{Br}^{-}} = 100\) \(K_{\text{Cl}^-/\text{OH}^{-}} = 0.01\) S 2— має бути відсутнім |
| Я — | Агі/мітка 2 S |
\(K_{\text{I}^-/\text{S}^{2-}} = 30\) \(K_{\text{I}^-/\text{Br}^{-}} = 10^{-4}\) \(K_{\text{I}^-/\text{Cl}^{-}} = 10^{-6}\) \(K_{\text{I}^-/\text{OH}^{-}} = 10^{-7}\) |
| СКН — | AGSCN/мітка 2 S |
\(K_{\text{SCN}^-/\text{I}^{-}} = 10^{3}\) \(K_{\text{SCN}^-/\text{Br}^{-}} = 100\) \(K_{\text{SCN}^-/\text{Cl}^{-}} = 0.1\)\(K_{\text{SCN}^-/\text{OH}^{-}} = 0.01\) S 2— має бути відсутнім |
| S 2— | Вік 2 С | Hg 2 + повинен бути відсутнім |
| Коефіцієнти селективності є приблизними; значення, знайдені експериментальним шляхом, можуть істотно відрізнятися від перерахованих значень. Див. Камманн, К. Робота з іонно-селективними електродами, Спрінгер-Верлаг: Берлін, 1977. | ||
Мембрана F — іоноселективного електрода виготовлена з монокристалу LaF 3, який зазвичай легують невеликою кількістю eUF 2 для підвищення провідності мембрани. Оскільки EuF 2 забезпечує лише два F - іони - порівняно з трьома F - іонами в LaF 3, кожен eUF 2 створює вакансію в решітці кристала. Іони фтору проходять через мембрану шляхом переміщення в сусідні вакансії. Як показано на малюнку\(\PageIndex{4}\), мембрана LaF 3 герметична в кінець непровідного пластикового циліндра, який містить стандартний розчин F -, як правило, 0,1 M NaF, і опорний електрод Ag/AgCl.
Мембранний потенціал для F — ISE є результатом різниці розчинності LaF 3 на протилежних сторонам мембрани, причому потенціал задається
\[E_{\mathrm{cell}}=K-0.05916 \log a_{\mathrm{F}^-} \label{ss6} \]
Однією з переваг F — іоноселективного електрода є його свобода від перешкод. Єдиним істотним винятком є OH — (K F — /OH — = 0.1), що накладає максимальну межу рН для успішного аналізу. Нижче рН 4 переважною формою фтору в розчині є HF, що не сприяє мембранному потенціалу. З цієї причини аналіз на фтор проводять при рН більше 4.
Який максимальний рН ми можемо терпіти, якщо потрібно проаналізувати розчин, в якому активність F —\(1 \times 10^{-5}\) з похибкою менше 1%?
Рішення
При наявності ОН — потенціал клітини
\[E_{\mathrm{cell}}=K-0.05916\left\{a_{\mathrm{F}^-}+K_{\mathrm{F}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^-}\right\} \nonumber \]
Для досягнення похибки менше 1% термін\(K_{\mathrm{F}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^-}\) повинен бути менше 1% від F —; таким чином
\[K_{\mathrm{F}^- / \mathrm{OH}^-} \times a_{\mathrm{OH}^{-}} \leq 0.01 \times a_{\mathrm{F}^-} \nonumber \]
\[0.10 \times a_{\mathrm{OH}^{-}} \leq 0.01 \times\left(1.0 \times 10^{-5}\right) \nonumber \]
Розв'язування для ОН — дає максимально допустиму активність для ОН — як\(1 \times 10^{-6}\), що відповідає рН менше 8.
На відміну від іоноселективного електрода зі скляної мембрани, твердотільний ISE не потребує кондиціонування перед його використанням, і він може зберігатися сухим. Поверхня електрода схильна до отруєння, як описано вище для Cl — ISE при контакті з надмірною концентрацією Br —. Якщо електрод отруївся, його можна повернути в початковий стан шляхом шліфування і полірування кристалічної мембрани.
Отруєння просто означає, що поверхня була хімічно модифікована, наприклад, AgBr, що утворюється на поверхні мембрани AgCl.
Рідкі мембранні електроди
Інший клас іоноселективних електродів використовує гідрофобну мембрану, яка містить рідкий органічний комплексоутворювач, який вибірково реагує з аналітом. Використовували три типи органічних комплексоутворювачів: катіонообмінники, аніонообмінники та нейтральні іонофори. Мембранний потенціал існує, якщо активність аналіту різна з двох сторін мембрани. Струм проводиться через мембрану аналітом.
Іонофор - це ліганд, зовнішній вигляд якого гідрофобний і внутрішній простір якого гідрофільний. Показаний тут коронний ефір - один із прикладів нейтрального іонофора.
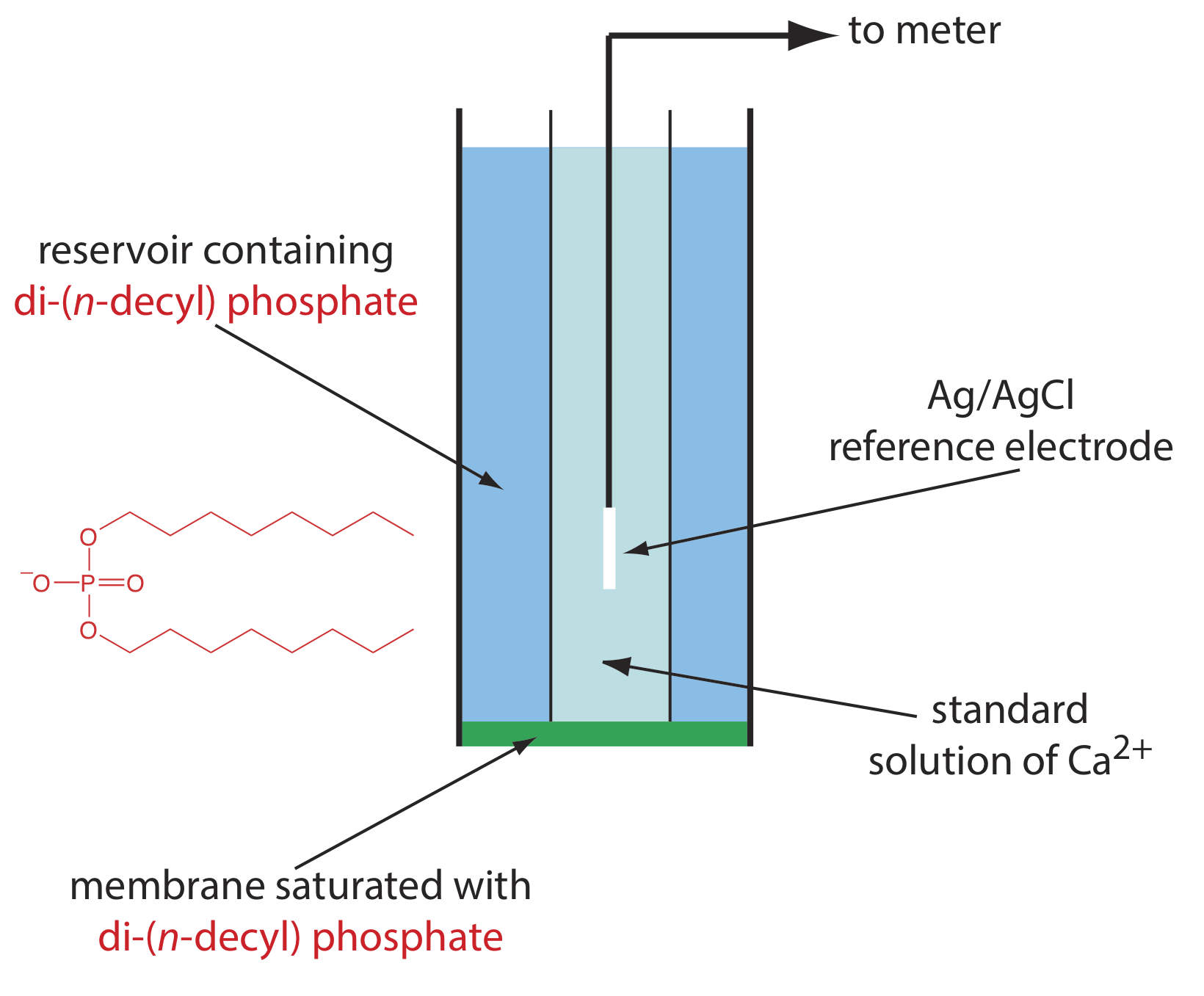
Одним із прикладів іоноселективного електрода на рідкій основі є те, що для Ca 2 +, який використовує пористу пластичну мембрану, насичену катіонообмінником ді- (n -децил) фосфатом. Як показано на малюнку\(\PageIndex{5}\), мембрана розміщена на кінці непровідної циліндричної трубки і контактує з двома резервуарами. Зовнішній резервуар містить ді- (n -децил) фосфат в di- n -октилфенілфосфонаті, який просочується в пористу мембрану. Внутрішній резервуар містить стандартний водний розчин Ca 2 + і еталонний електрод Ag/AgCl. Також випускаються іоноселективні електроди кальцію, в яких ді- (n -децил) фосфат іммобілізується в мембрані з полівінілхлориду (ПВХ), що виключає необхідність у зовнішньому резервуарі.
Мембранний потенціал для Ca 2 + ISE розвивається в результаті різниці в ступені реакції комплексоутворення
\[\mathrm{Ca}^{2+}(a q)+2\left(\mathrm{C}_{10} \mathrm{H}_{21} \mathrm{O}\right)_{2} \mathrm{PO}_{2}^{-}(mem) \rightleftharpoons \mathrm{Ca}\left[\left(\mathrm{C}_{10} \mathrm{H}_{21} \mathrm{O}\right)_{2} \mathrm{PO}_{2}\right]_2 (mem) \label{liq1} \]
з двох сторін мембрани, де (мем) вказує вид, який присутній в мембрані. Потенціал клітини для іоноселективного електрода Ca 2 + дорівнює
\[E_{\mathrm{cell}}=K+\frac{0.05916}{2} \log a_{\mathrm{ca}^{2+}} \label{liq2} \]
Селективність цього електрода для Ca 2 + дуже хороша, причому тільки Zn 2 + демонструє більшу селективність.
У таблиці\(\PageIndex{3}\) наведено властивості декількох іоноселективних електродів на рідкій основі. Електрод, що використовує резервуар для рідини, може зберігатися в розведеному розчині аналіту і не потребує додаткового кондиціонування перед використанням. Термін служби електрода з ПВХ-мембраною, однак, пропорційний його впливу водними розчинами. З цієї причини ці електроди найкраще зберігати, накривши мембрану ковпачком разом з невеликою кількістю змоченої марлі для підтримки вологого середовища. Перед використанням електрода його витримують в розчині аналіту протягом 30-60 хвилин.
