23.2: Металеві індикаторні електроди
- Page ID
- 27217
У потенціометрії потенціал електрода-індикатора пропорційний активності аналіта. Для проведення потенціометричних вимірювань використовуються два класи індикаторних електродів: металеві електроди, які є предметом даного розділу, і іоноселективні електроди, які розглянуті в наступному розділі.
Електроди першого роду
Якщо помістити мідний електрод в розчин, який містить Cu 2 +, потенціал електрода обумовлений реакцією
\[\mathrm{Cu}^{2+}(a q)+2 e^{-} \rightleftharpoons \mathrm{Cu}(s) \nonumber \]
визначається активністю Cu 2 +.
\[E=E_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^{\mathrm{o}}-\frac{0.05916}{2} \log \frac{1}{a_{\mathrm{Cu}^{2+}}}=+0.3419 \mathrm{V}-\frac{0.05916}{2} \log \frac{1}{a_{\mathrm{Cu}^{2+}}} \nonumber \]
Якщо мідь є індикаторним електродом в потенціометричній електрохімічній комірці, яка також включає насичений каломельний опорний електрод.
\[\mathrm{SCE} \| \mathrm{Cu}^{2+}\left(a q, a_{\mathrm{Cu^{2+}}}=x\right) | \text{Cu}(s) \nonumber \]
то ми можемо використовувати потенціал клітини для визначення невідомої активності Cu 2 + в напівклітині індикаторного електрода
\[E_{\text{cell}}= E_{\text { ind }}-E_{\text {SCE }}= +0.3419 \mathrm{V}-\frac{0.05916}{2} \log \frac{1}{a_{\mathrm{Cu}^{2+}}}-0.2224 \mathrm{V} \nonumber \]
Індикаторний електрод, в якому метал контактує з розчином, що містить його іон, називається електродом першого роду. Загалом, якщо метал, M, знаходиться в розчині M n+, потенціал клітини дорівнює
\[E_{\mathrm{call}}=K-\frac{0.05916}{n} \log \frac{1}{a_{M^{n+}}}=K+\frac{0.05916}{n} \log a_{M^{n+}} \nonumber \]
де K - константа, що включає в себе потенціал стандартного стану для M n +/M окислювально-відновної пари і потенціал опорного електрода.
З різних причин, включаючи повільну кінетику перенесення електронів на межі розділу метал-розчин, утворення оксидів металів на поверхні електрода та інтерференційні реакції, електроди першого роду обмежуються наступними металами: Ag, Bi, Cd, Cu, Hg, Pb, Sn, Tl та Zn.
Багато з цих електродів, таких як Zn, не можна використовувати в кислих розчині, оскільки вони легко окислюються H +.
\[\mathrm{Zn}(s)+2 \mathrm{H}^{+}(a q)\rightleftharpoons \text{ H}_{2}(g)+\mathrm{Zn}^{2+}(a q) \nonumber \]
Електроди другого роду
Потенціал електрода першого роду реагує на активність M n +. Ми також можемо використовувати цей електрод для визначення активності іншого виду, якщо він знаходиться в рівновазі з M n +. Наприклад, потенціал електрода Ag в розчині Ag + дорівнює
\[E=0.7996 \mathrm{V}+0.05916 \log a_{\mathrm{Ag}^{+}} \label{second1} \]
Якщо наситити напівосередок електрода індикатора AgI, реакція розчинності
\[\operatorname{Agl}(s)\rightleftharpoons\operatorname{Ag}^{+}(a q)+\mathrm{I}^{-}(a q) \label{second2} \]
визначає концентрацію Ag +; таким чином
\[a_{\mathrm{Ag}^{+}}=\frac{K_{\mathrm{sp}, \mathrm{Agl}}}{a_{\text{I}^-}} \label{second3} \]
де K sp, AgI - продукт розчинності для AgI. Підставляємо рівняння\ ref {second3} на рівняння\ ref {second1}
\[E=0.7996 \text{ V}+0.05916 \log \frac{K_{\text{sp, Agl}}}{a_{\text{I}^-}} \label{second4} \]
показує, що потенціал срібного електрода є функцією активності I —. Якщо включити цей електрод в потенціометричну електрохімічну комірку з насиченим каломелевим електродом.
\[\mathrm{SCE} \| \mathrm{AgI}(s), \text{ I}^-\left(a q, a_{\text{I}^-}=x\right) | \mathrm{Ag}(\mathrm{s}) \label{second5} \]
тоді потенціал клітини
\[E_{\mathrm{cell}}=K-0.05916 \log a_{\text{I}^-} \label{second6} \]
де K - константа, яка включає потенціал стандартного стану для окислювально-відновної пари Ag + /Ag, продукт розчинності для AgI та потенціал опорного електрода.
Якщо електрод першого роду реагує на активність іона в рівновазі з M n +, ми називаємо його електродом другого роду. Два загальних електроди другого роду - це каломель і еталонні електроди срібло/хлориду срібла.
У електроді другого роду ми пов'язуємо разом окислювально-відновну реакцію та іншу реакцію, таку як реакція розчинності. Ви можете задатися питанням, чи можемо ми зв'язати разом більше двох реакцій. Коротка відповідь - так. Електрод третього роду, наприклад, пов'язує воєдино окислювально-відновну реакцію і дві інші реакції. Такі електроди зустрічаються рідше і розглядати їх в цьому тексті ми не будемо.
Металеві окислювально-відновні електроди
Електрод першого роду або другого роду розвиває потенціал в результаті окислювально-відновної реакції, в якій задіяний металевий електрод. Електрод також може служити джерелом електронів або як раковина для електронів в непов'язаній окислювально-відновної реакції, і в цьому випадку ми називаємо його окислювально-відновним електродом. Катод Pt в\(\PageIndex{1}\) є окислювально-відновним електродом, оскільки його потенціал визначається активністю Fe 2 + і Fe 3 + в індикаторній напівкомірці. Зверніть увагу, що потенціал окислювально-відновного електрода часто реагує на активність більше одного іона, що обмежує його корисність для прямої потенціометрії.
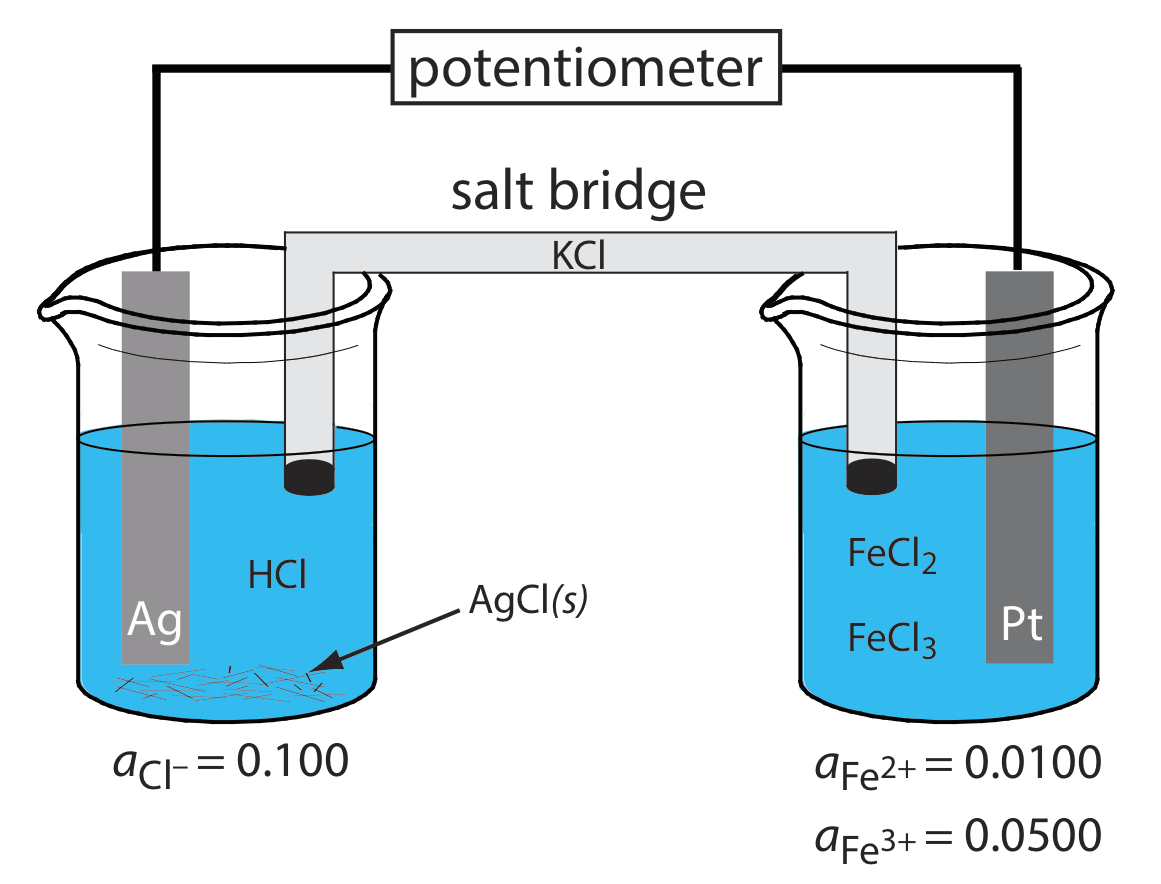
Малюнок\(\PageIndex{1}\). Потенціометрична електрохімічна комірка, в якій анод являє собою металевий електрод першого роду (Ag), а катод - металевий окислювально-відновний електрод (Pt).
