23.1: Еталонні електроди
- Page ID
- 27188
У потенціометрії вимірюємо різницю між потенціалом двох електродів. Потенціал одного електрода - робочого або індикаторного електрода - реагує на активність аналіта, а інший електрод - лічильник або еталонний електрод - має відомий, фіксований потенціал. За умовністю опорний електрод є анодом; таким чином, коротке позначення руки для потенціометричної електрохімічної комірки є
опорний електрод || індикатор електрода
і потенціал клітини
\[E_{\mathrm{cell}}=E_{\mathrm{ind}}-E_{\mathrm{ref}} \nonumber \]
Ідеальний опорний електрод забезпечує стабільний, відомий потенціал, так що ми можемо віднести будь-яку зміну E комірки до впливу аналіта на потенціал електрода індикатора. Крім того, еталонний електрод повинен бути простим у виготовленні та зручним у використанні. Хоча стандартний водневий електрод є еталонним електродом, який використовується для визначення потенціалів електродів, його використання не є поширеним. Натомість два еталонних електроди, розглянуті в цьому розділі, знаходять найбільше застосувань.
Каломелеві електроди
Еталонний електрод calomel заснований на наступній окислювально-відновній парі між Hg 2 Cl 2 і Hg (каломель - загальна назва Hg 2 Cl 2)
\[\mathrm{Hg}_{2} \mathrm{Cl}_{2}(s)+2 e^{-}\rightleftharpoons2 \mathrm{Hg}(l)+2 \mathrm{Cl}^{-}(a q) \nonumber \]
для яких потенціал
\[E=E_{\mathrm{Hg}_{2} \mathrm{Cl}_{2} / \mathrm{Hg}}^{\mathrm{o}}-\frac{0.05916}{2} \log \left(a_{\text{Cl}^-}\right)^{2}=+0.2682 \mathrm{V}-\frac{0.05916}{2} \log \left(a_{\text{Cl}^-}\right)^{2} \nonumber \]
Потенціал каломельного електрода, таким чином, залежить від активності Cl — в рівновазі з Hg і Hg 2 Cl 2.
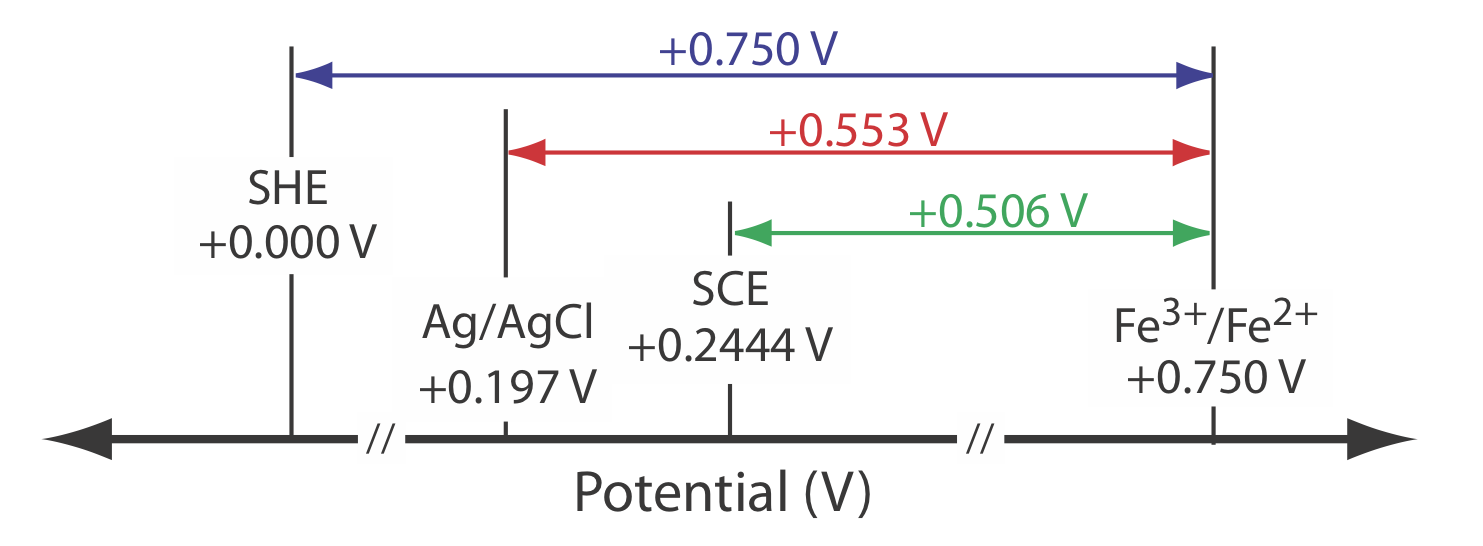
Як показано на малюнку\(\PageIndex{1}\), в насиченому каломелевому електроді (SCE) концентрація Cl — визначається розчинністю KCl. Електрод складається з внутрішньої трубки, упакованої пастою Hg, Hg 2 Cl 2 і KCl, розташованої всередині другої трубки, яка містить насичений розчин KCl. Невеликий отвір з'єднує дві трубки і пористий гніт служить соляним містком до розчину, в який занурений СКВ. Пробка в зовнішній трубці забезпечує отвір для додавання насиченого KCl. Коротке позначення руки для цієї клітинки
\[\mathrm{Hg}(l) | \mathrm{Hg}_{2} \mathrm{Cl}_{2}(s), \mathrm{KCl}(a q, \text { sat'd }) \| \nonumber \]
Оскільки концентрація Cl — фіксується розчинністю KCl, потенціал SCE залишається постійним, навіть якщо ми втрачаємо частину внутрішнього розчину до випаровування. Істотним недоліком СКВ є те, що розчинність KCl чутлива до зміни температури. При більш високих температурах розчинність KCl збільшується і потенціал електрода зменшується. Наприклад, потенціал СКВ становить +0,2444 В при 25 о С і +0,2376 В при 35 о С. Потенціал каломелевого електрода, який містить ненасичений розчин KCl, менш залежить від температури, але його потенціал змінюється, якщо концентрація, а значить і активність Cl —, збільшується за рахунок випаровування.
Наприклад, потенціал каломельного електрода становить +0,280 В при концентрації KCl 1,00 М і +0,336 В при концентрації KCl 0,100 М. Якщо активність Cl — 1,00, потенціал становить +0,2682 В.
Срібло/хлорид срібла електроди
Іншим поширеним еталонним електродом є електрод срібло/хлорид срібла, який заснований на зниженні AgCl до Ag.
\[\operatorname{AgCl}(s)+e^{-} \rightleftharpoons \mathrm{Ag}(s)+\mathrm{Cl}^{-}(a q) \nonumber \]
Як і у випадку з каломелевим електродом, активність Cl — визначає потенціал електрода Ag/AgCl; таким чином
\[E = E_\text{AgCl/Ag}^{\circ}-0.05916 \log a_{\text{Cl}^-} = 0.2223 \text{ V} - 0.05916 \log a_{\text{Cl}^-} \nonumber \]
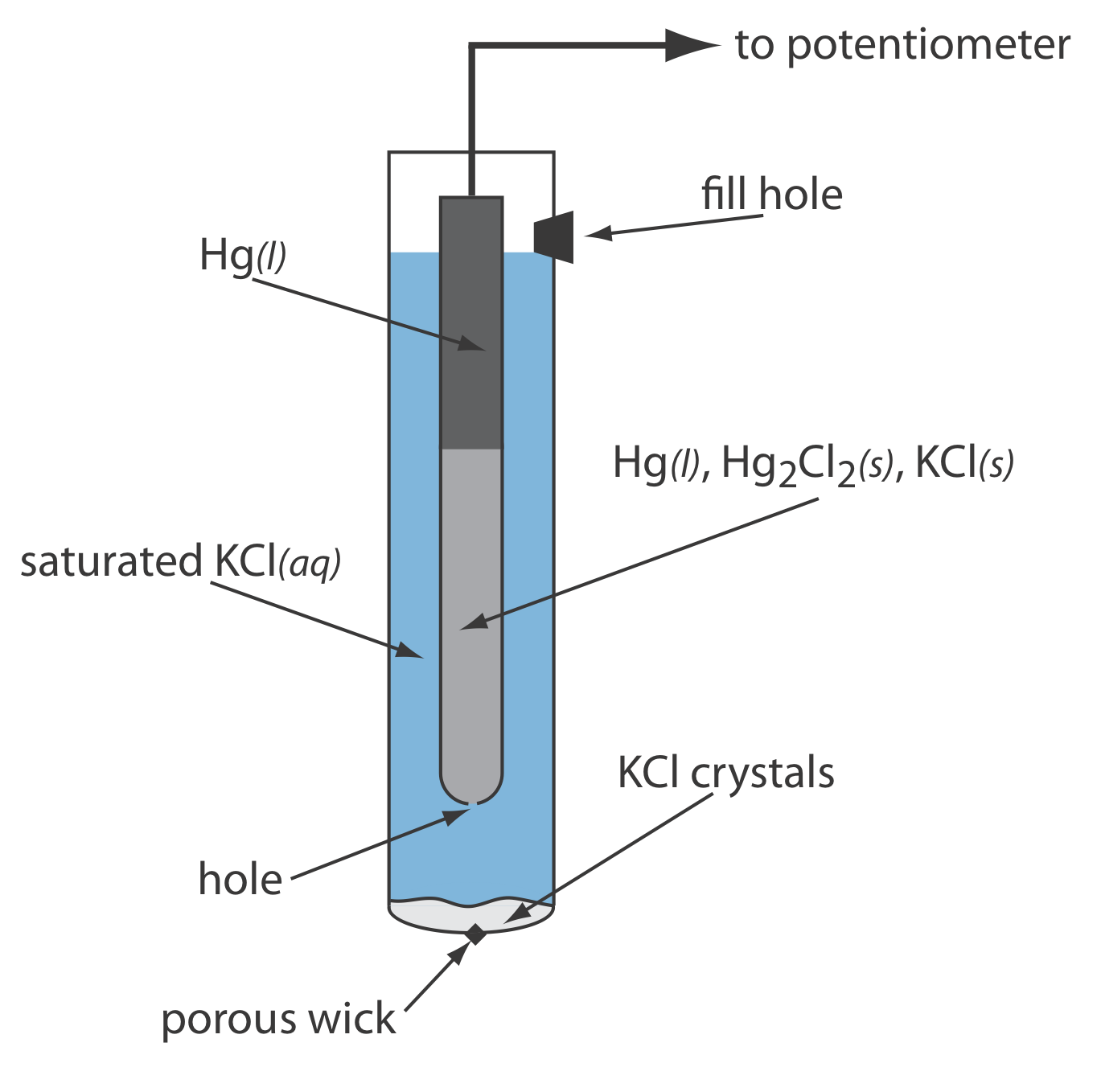
При приготуванні з використанням насиченого розчину KCl потенціал електрода становить +0,197 В при 25 о С. Інший поширений електрод Ag/AgCl використовує розчин 3,5 М KCl і має потенціал +0,205 В при 25 о С. Як і слід було очікувати, потенціал електрода Ag/AgCl з використанням насиченого розчину KCl більш чутливий до зміни температури, ніж електрод, який використовує ненасичений розчин KCl.
Типовий електрод Ag/AgCl показаний на малюнку\(\PageIndex{2}\) і складається з срібного дроту, кінець якої покритий тонкою плівкою AgCl, зануреної в розчин, що містить потрібну концентрацію KCl. Пориста пробка служить соляним містком. Короткі позначення руки електрода
\[\operatorname{Ag}(s) | \operatorname{Ag} \mathrm{Cl}(s), \mathrm{KCl}\left(a q, a_{\mathrm{Cl}^{-}}=x\right) \| \nonumber \]
Перетворення потенціалів між опорними електродами
Стандартні потенціали відновлення стану в більшості таблиць повідомляються щодо потенціалу стандартного водневого електрода +0,00 В. Оскільки ми рідко використовуємо SHE як опорний електрод, нам потрібно перетворити потенціал індикаторного електрода в його еквівалентне значення при використанні іншого опорного електрода. Як показано в наступному прикладі, це зробити нескладно.
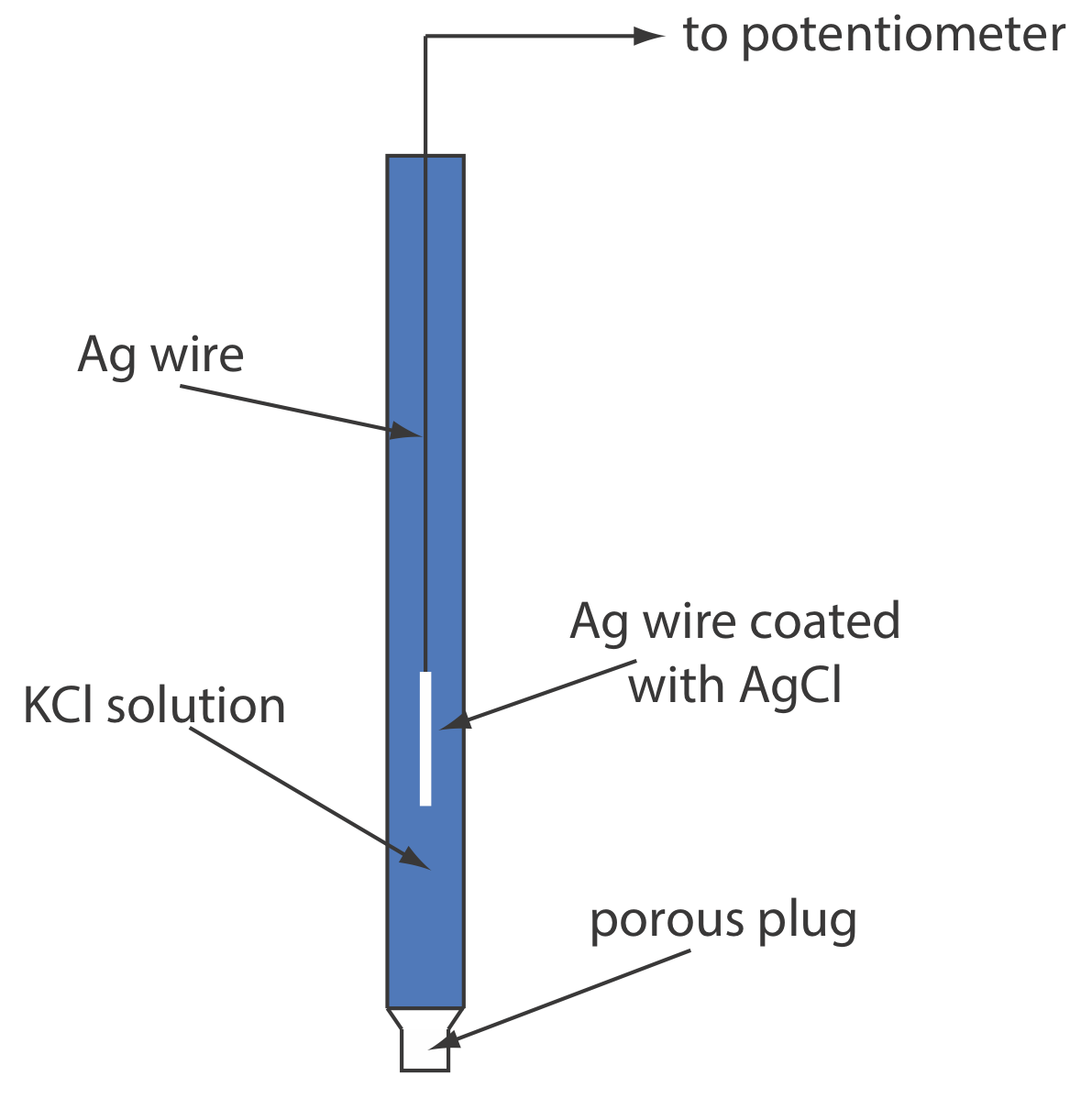
Потенціал для напівкомірки Fe 3 + +/Fe 2+ становить +0,750 В щодо стандартного водневого електрода. Який його потенціал, якщо ми використовуємо насичений каломельний електрод або насичений електрод срібло/хлорид срібла?
Рішення
Коли ми використовуємо стандартний водневий електрод, потенціал електрохімічної комірки дорівнює
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.000 \text{ V} = 0.750 \text{ V} \nonumber \]
Ми можемо використовувати те саме рівняння для обчислення потенціалу, якщо використовувати насичений каломелевий електрод
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.2444 \text{ V} = 0.506 \text{ V} \nonumber \]
або насичений електрод срібло/хлорид срібла
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.197 \text{ V} = 0.553 \text{ V} \nonumber \]
Малюнок\(\PageIndex{3}\) надає образотворче уявлення про зв'язок між цими різними потенціалами.