6.4: Аллостеричне гальмування
- Page ID
- 66701
Термін аллостерія походить від грецького слова аллос, що означає різні, і стерео, що означає твердий, і відноситься до ферменту з регулюючим зв'язуючим сайтом окремо від його активного вузла зв'язування. У нашій моделі аллостеричного інгібування передбачається, що молекула інгібітора зв'язується зі своїм власним регуляторним сайтом на ферменті, що призводить або до зниженої спорідненості зв'язування субстрату з ферментом, або зниженою швидкістю перетворення субстрату в продукт. Мультфільм аллостеричного гальмування внаслідок зниженої спорідненості зв'язування показаний на рис. \(6.3\).
Загалом, нам потрібно визначити три комплекси:\(C_{1}\) це комплекс, утворений з субстрату і ферменту;\(C_{2}\) з інгібітора і ферменту, і;\(C_{3}\) з субстрату, інгібітора і ферменту. Прописуємо хімічні реакції наступним чином:
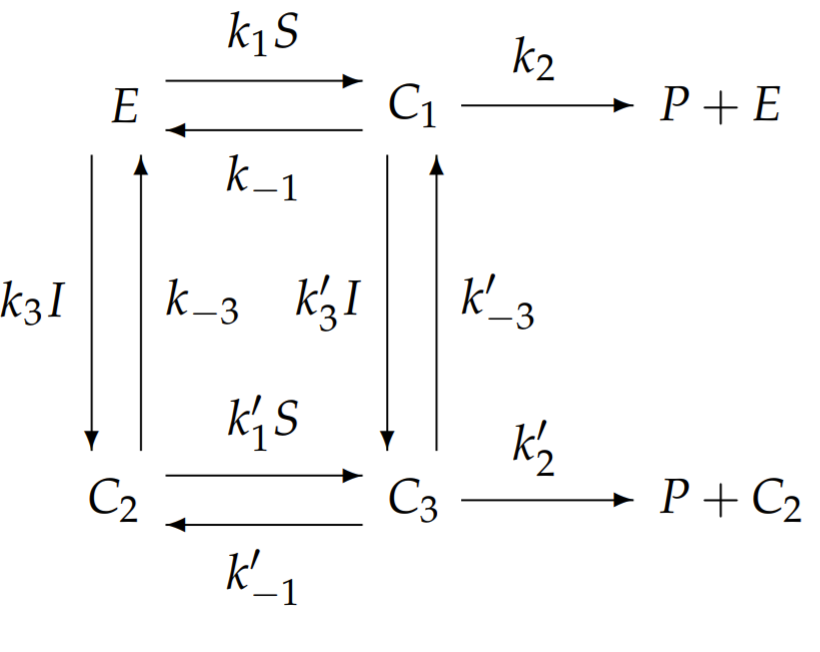
Загальна модель аллостеричного інгібування з десятьма незалежними константами швидкості виявляється занадто складною для аналізу. Ми спростимо цю загальну модель до такої з меншою кількістю констант швидкості, яка все ще демонструє унікальні особливості аллостеричного гальмування. Одне можливе, але нецікаве спрощення передбачає, що якщо\(I\) зв'язується з\(E\), то\(S\) ні; однак це зменшує аллостеричне гальмування до конкурентного гальмування і втрачає суть алостерії. Замість цього ми спрощуємо, дозволяючи обидва\(I\) і\(S\) одночасно зв'язуватися\(E\), але ми припускаємо, що зв'язування I запобігає перетворенню субстрату в продукт. З цим спрощенням,\(k_{2}^{\prime}=0\). Для подальшого зменшення кількості незалежних констант швидкості припускаємо, що на прив'язку\(S\) до\(E\) не впливає пов'язана присутність\(I\), а на прив'язку\(I\) до\(E\) не впливає прив'язка наявність\(S\). Ці наближення мають на увазі, що всі загрунтовані константи швидкості дорівнюють відповідним негрунтованим константам швидкості\(k_{1}^{\prime}=k_{1}\), наприклад, і т.д. з цими спрощеннями схема хімічної реакції спрощує
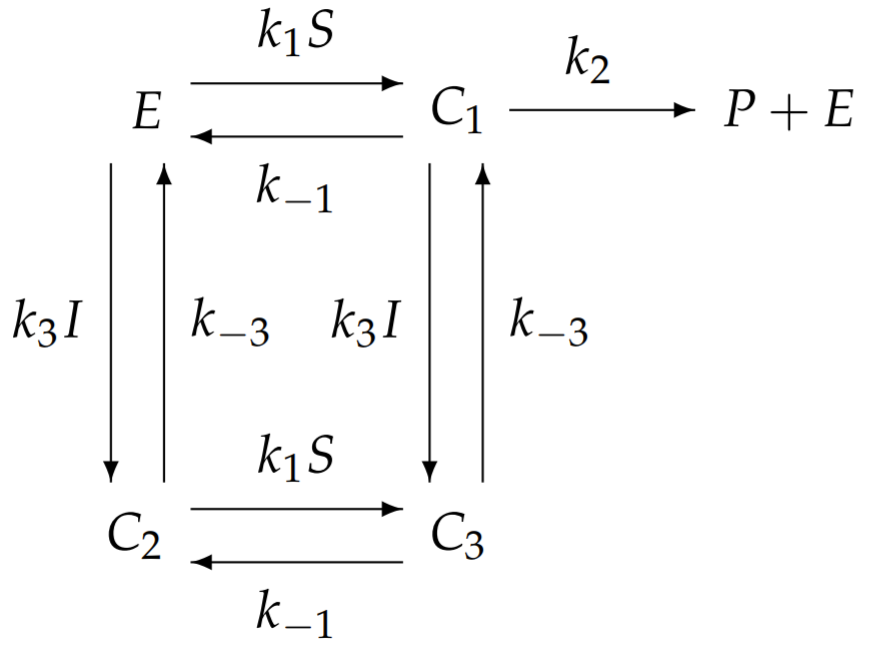
і зараз існує всього п'ять незалежних констант швидкості. Запишемо рівняння для комплексів, використовуючи закон масової дії:
\[\begin{align} &\frac{d C_{1}}{d t}=k_{1} S E+k_{-3} C_{3}-\left(k_{-1}+k_{2}+k_{3} I\right) C_{1} \\[4pt] &\frac{d C_{2}}{d t}=k_{3} I E+k_{-1} C_{3}-\left(k_{-3}+k_{1} S\right) C_{2} \\[4pt] &\frac{d C_{3}}{d t}=k_{3} I C_{1}+k_{1} S C_{2}-\left(k_{-1}+k_{-3}\right) C_{3} \end{align} \nonumber \]
в той час як швидкість реакції задається
\[\frac{d P}{d t}=k_{2} C_{1} \nonumber \]
Знову ж таки, як вільний, так і зв'язаний фермент зберігається, так що\(E=E_{0}-C_{1}-C_{2}-C_{3}\). При квазірівноважному наближенні\(\dot{C}_{1}=\dot{C}_{2}=\dot{C}_{3}=0\) ми отримуємо систему з трьох рівнянь і трьох невідомих:\(C_{1}, C_{2}\) і\(C_{3} .\) незважаючи на наші спрощення, аналітичне рішення швидкості реакції залишається безладним (див. Keener & Sneyd, посилання на кінець глави) і не особливо висвітлює. Опускаємо тут повний аналітичний результат і визначаємо тільки максимальну швидкість реакції.
Максимальна швидкість реакції\(V_{m}^{\prime}\) для алостерично-інгібованої реакції визначається як похідна за часом концентрації продукту, коли реакція насичена субстратом; тобто
\[\begin{aligned} V_{m}^{\prime} &=\lim _{S \rightarrow \infty} d P / d t \\[4pt] &=k_{2} \lim _{S \rightarrow \infty} C_{1} \end{aligned} \nonumber \]
При насиченні субстрату кожен фермент буде займати місце зв'язування субстрату. Ферменти або пов'язані тільки з субстратом в комплексі\(C_{1}\), або зв'язуються разом з субстратом і інгібітором в комплексі\(C_{3}\). Відповідно, схема хімічної реакції з насиченням субстрату спрощує
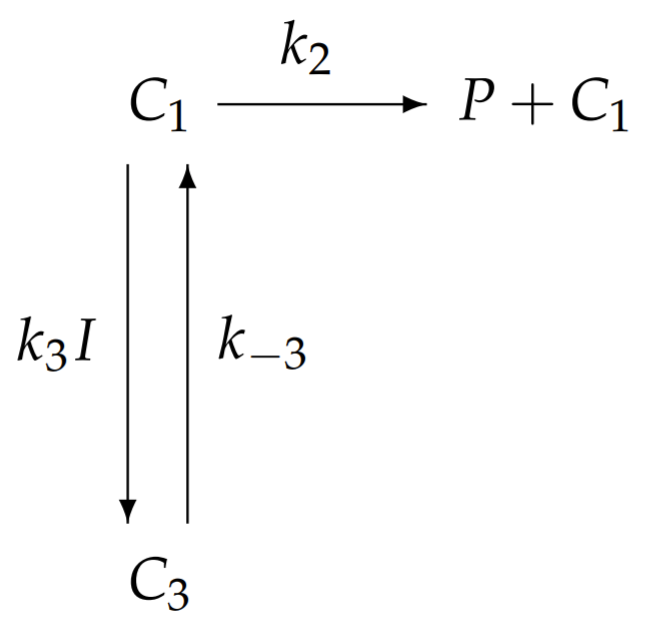
Рівняння для\(C_{1}\) і\(C_{3}\) з насиченістю підкладки, таким чином, задаються
\[\begin{align} \frac{d C_{1}}{d t} &=k_{-3} C_{3}-k_{3} I C_{1} \\[4pt] \frac{d C_{3}}{d t} &=k_{3} I C_{1}-k_{-3} C_{3} \end{align} \nonumber \]
а квазірівноважне наближення дає єдине незалежне рівняння
\[\begin{align} \nonumber C_{3} &=\left(k_{3} / k_{-3}\right) I C_{1} \\[4pt] &=\left(I / K_{i}\right) C_{1} \end{align} \nonumber \]
з\(K_{i}=k_{-3} / k_{3}\) як раніше. Рівняння, що виражає збереження ферменту, дається шляхом\(E_{0}=C_{1}+C_{3}\). Цей закон про збереження, разом з\((6.4.7)\), дозволяє нам вирішувати для\(C_{1}\):
\[C_{1}=\frac{E_{0}}{1+I / K_{i}} \nonumber \]
Тому максимальна швидкість реакції для алостерично-інгібованої реакції задається
\[\begin{aligned} V_{m}^{\prime} &=\frac{k_{2} E_{0}}{1+I / K_{i}} \\[4pt] &=\frac{V_{m}}{1+I / K_{i}} \end{aligned} \nonumber \]
де\(V_{m}\) максимальна швидкість реакції як розгальмованої, так і конкурентної гальмованої реакції. Таким чином, алостеричний інгібітор зменшує максимальну швидкість розгальмованої реакції за рахунок фактора\(\left(1+I / K_{i}\right)\), який може бути великим, якщо концентрація алостеричного інгібітора є значною.
