8.6: Ферменти
- Page ID
- 8396
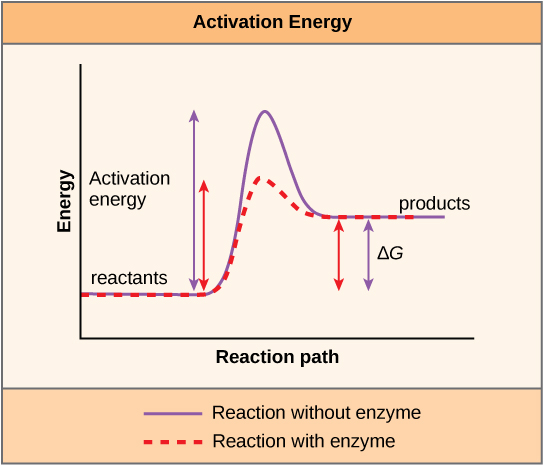
Речовина, яка допомагає протікати хімічну реакцію, називається каталізатором, а молекули, що каталізують біохімічні реакції, називаються ферментами. Більшість ферментів є білками і виконують критичне завдання зниження енергій активації хімічних реакцій всередині клітини. Більшість реакцій, критичних для живої клітини, відбуваються занадто повільно при нормальних температурах, щоб бути корисними для клітини. Без ферментів для прискорення цих реакцій життя не могла зберігатися. Ферменти роблять це шляхом зв'язування з молекулами реагентів і утримуючи їх таким чином, щоб зробити хімічні процеси руйнування зв'язків і -формування протікати легше. Важливо пам'ятати, що ферменти не змінюють, чи є реакція ексергонічної (спонтанної) або ендергонічної. Це пояснюється тим, що вони не змінюють вільну енергію реагентів або продуктів. Вони лише зменшують енергію активації, необхідну для того, щоб реакція йшла вперед (рис.\(\PageIndex{1}\)). Крім того, сам фермент незмінний реакцією, яку він каталізує. Після того, як одна реакція була каталізована, фермент здатний брати участь в інших реакціях.
Хімічні реагенти, з якими зв'язується фермент, називаються субстратами ферменту. Може бути одна або кілька підкладок, в залежності від конкретної хімічної реакції. У деяких реакціях один субстрат реагенту розщеплюється на кілька продуктів. В інших два субстрати можуть зібратися разом, щоб створити одну більшу молекулу. Два реагенти також можуть вступити в реакцію і обидва модифікуються, але вони залишають реакцію як два продукти. Розташування всередині ферменту, де субстрат зв'язується, називається активною ділянкою ферменту. На активному сайті відбувається «дія». Оскільки ферменти - це білки, існує унікальна комбінація амінокислотних бічних ланцюгів всередині активної ділянки. Кожна бічна ланцюг характеризується різними властивостями. Вони можуть бути великими або дрібними, слабокислими або основними, гідрофільними або гідрофобними, позитивно або негативно зарядженими, або нейтральними. Унікальне поєднання бічних ланцюгів створює дуже специфічне хімічне середовище всередині активної ділянки. Це специфічне середовище підходить для зв'язування з одним певним хімічним субстратом (або субстратами).
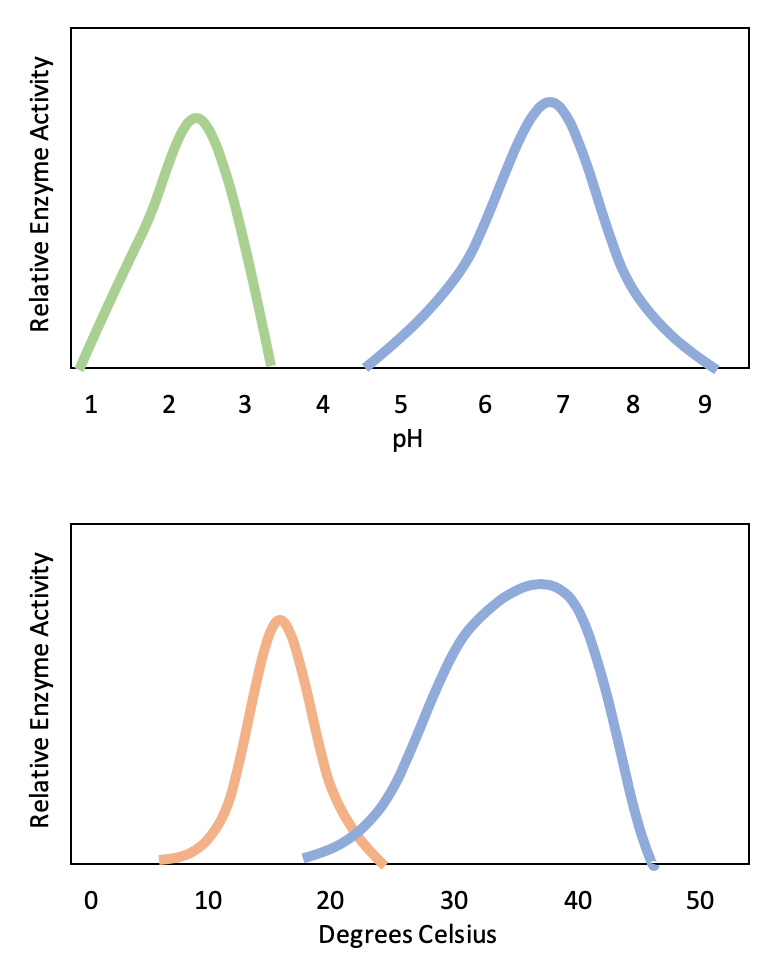
Активні ділянки схильні до впливу місцевого середовища. Підвищення температури навколишнього середовища, як правило, збільшує швидкість реакції, каталізується ферментом або іншим чином. Однак температури поза оптимальним діапазоном знижують швидкість, з якою фермент каталізує реакцію. Гарячі температури в кінцевому підсумку призведуть до денатурації ферментів, незворотної зміни тривимірної форми і, отже, функції ферменту (рис.\(\PageIndex{2}\)). Ферменти також підходять для найкращого функціонування в межах певного діапазону pH та концентрації солі, і, як і при температурі, екстремальні концентрації pH та солі можуть спричинити денатурацію ферментів.

Як правило, ферменти оптимально функціонують в середовищі, де вони зазвичай знаходяться і використовуються. Наприклад, фермент амілаза міститься в слині, де він функціонує, щоб розщеплювати крохмаль (полісахарид - вуглеводний ланцюг) на більш дрібні цукру. Зверніть увагу, що в даному прикладі амілаза є ферментом, крохмаль - субстратом, а більш дрібні цукру - продуктом. РН слини зазвичай становить від 6,2 до 7,6, причому приблизно 6,7 є середнім. Оптимальний рН амілази знаходиться в межах від 6,7 до 7,0, що близьке до нейтрального (рис.\(\PageIndex{3}\)). Оптимальна температура для амілази близька до 37ºC (це температура тіла людини).
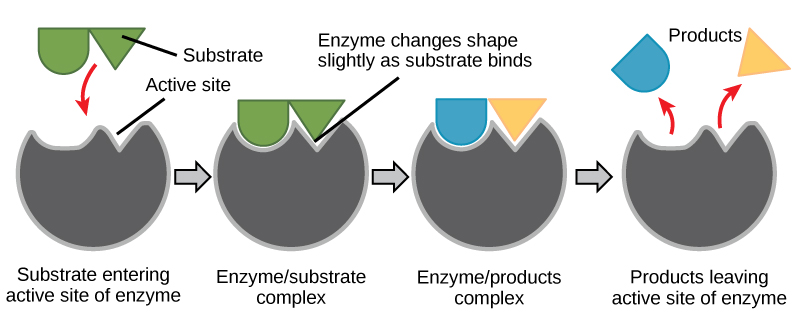
Протягом багатьох років вчені вважали, що зв'язування ензим-субстрату відбувається простим способом «замок і ключ». Ця модель стверджувала, що фермент і субстрат ідеально поєднуються в один миттєвий крок. Однак сучасні дослідження підтримують модель, яка називається індукованим приляганням (рис.\(\PageIndex{4}\)). Модель індукованої посадки розширюється на моделі блокування та ключа, описуючи більш динамічне зв'язування між ферментом і субстратом. Коли фермент і субстрат збираються разом, їх взаємодія викликає м'який зрушення в структурі ферменту, що утворює ідеальне розташування зв'язування між ферментом і субстратом.
Коли фермент зв'язує його субстрат, утворюється ферментно-субстратний комплекс. Цей комплекс знижує енергію активації реакції і сприяє її швидкому прогресуванню одним з безлічі можливих способів.
- На базовому рівні ферменти сприяють хімічним реакціям, які залучають більше одного субстрату, об'єднуючи субстрати в оптимальній орієнтації для реакції.
- Ферменти сприяють реакції їх субстратів, створюючи оптимальне середовище в межах активної ділянки для реакції. Хімічні властивості, що виникають з особливого розташування груп амінокислот R (бічних ланцюгів) в межах активної ділянки, створюють ідеальне середовище для реакції специфічних субстратів ферменту.
- Комплекс фермент-субстрат також може знизити енергію активації, порушуючи структуру зв'язку, щоб його було легше розірвати.
- Нарешті, ферменти також можуть знизити енергію активації, беручи участь у самій хімічній реакції. У цих випадках важливо пам'ятати, що фермент завжди повернеться в початковий стан до завершення реакції.
Однією з характерних властивостей ферментів є те, що вони залишаються в кінцевому підсумку незмінними реакціями, які вони каталізують. Після того, як фермент каталізував реакцію, він вивільняє свій продукт (и) і може каталізувати нову реакцію.
Здавалося б, ідеальним є сценарій, в якому всі ферменти організму існували в рясному постачанні і функціонували оптимально в усіх клітинних умовах, у всіх клітині, в усі часи. Однак різноманітність механізмів гарантує, що цього не відбувається. Клітинні потреби та умови постійно змінюються від клітини до клітини та змінюються всередині окремих клітин з плином часу. Необхідні ферменти клітин шлунка відрізняються від ферментів клітин жирових накопичувачів, клітин шкіри, клітин крові та нервових клітин. Крім того, клітина травного органу працює набагато важче для обробки та розщеплення поживних речовин протягом часу, який уважно стежить за їжею порівняно з багатьма годинами після їжі. Оскільки ці клітинні вимоги та умови змінюються, так само повинні бути і кількість і функціональність різних ферментів.
Оскільки швидкості біохімічних реакцій контролюються енергією активації, а ферменти нижчі і визначають енергії активації для хімічних реакцій, відносні кількості і функціонування різноманітних ферментів всередині клітини в кінцевому підсумку визначають, які реакції будуть протікати і з якими темпами. Це визначення жорстко контролюється в клітині. У певних клітинних середовищах активність ферментів частково контролюється факторами навколишнього середовища, такими як рН, температура, концентрація солі, а в деяких випадках - кофактори або коферменти.
Ферменти також можуть регулюватися способами, які або сприяють, або знижують активність ферментів. Існує багато видів молекул, які пригнічують або сприяють функції ферментів, і різних механізмів, за допомогою яких вони це роблять. У деяких випадках інгібування ферменту молекула інгібітора досить схожа на субстрат, який може зв'язуватися з активною ділянкою і просто блокувати субстрат від зв'язування. Коли це відбувається, фермент пригнічується шляхом конкурентного інгібування, оскільки молекула інгібітора конкурує з субстратом за зв'язування з активною ділянкою.
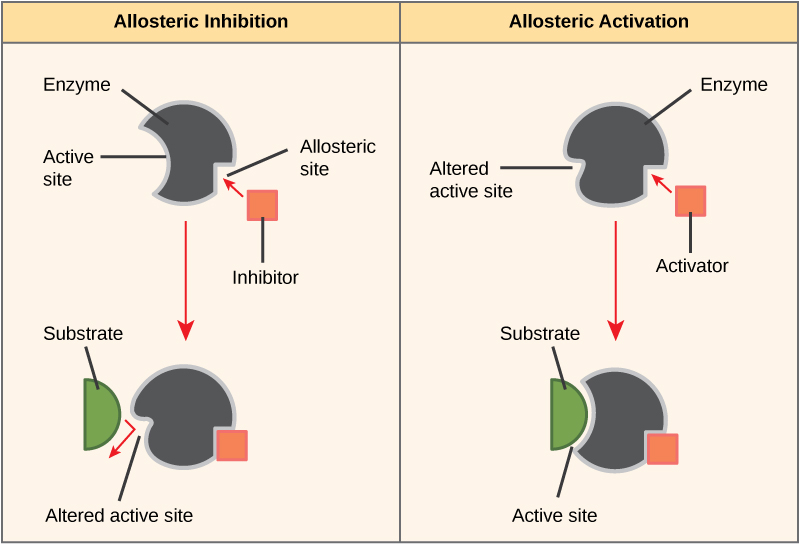
З іншого боку, при неконкурентному гальмуванні молекула інгібітора зв'язується з ферментом в іншому місці, ніж активний сайт, який називається аллостеричним сайтом, але все ж вдається блокувати зв'язування субстрату з активним сайтом. Деякі молекули інгібіторів зв'язуються з ферментами в місці, де їх зв'язування викликає конформаційні зміни, що знижує спорідненість ферменту до його субстрату. Цей вид гальмування називається аллостеричним гальмуванням (рис.\(\PageIndex{5}\)). Більшість алостерично регульованих ферментів складаються з більш ніж одного поліпептиду, що означає, що вони мають більше однієї білкової субодиниці. Коли аллостеричний інгібітор зв'язується з областю на ферменті, всі активні ділянки на білкових субодиницях трохи змінюються таким чином, що вони пов'язують свої субстрати з меншою ефективністю. Існують аллостеричні активатори, а також інгібітори. Аллостеричні активатори зв'язуються з місцями на ферменті далеко від активної ділянки, викликаючи конформаційні зміни, що збільшує спорідненість активного сайту (ів) ферменту до його субстрату (ів) (рис.\(\PageIndex{5}\)).
Багато ферменти працюють не оптимально, або навіть взагалі, якщо тільки не пов'язані з іншими специфічними молекулами-помічниками, що не містять білків. Вони можуть зв'язуватися або тимчасово через іонні або водневі зв'язки, або постійно через більш міцні ковалентні зв'язки. Зв'язування з цими молекулами сприяє оптимальній формі та функціонуванню відповідних ферментів. Два приклади цих типів молекул-помічників - кофактори та коферменти. Кофакторами є неорганічні іони, такі як іони заліза і магнію. Коферменти - це органічні молекули-помічники, ті, що мають основну атомну структуру, що складається з вуглецю та водню. Як і ферменти, ці молекули беруть участь у реакціях, не змінюючись самі, і в кінцевому підсумку переробляються та використовуються повторно. Вітаміни є джерелом коферментів. Деякі вітаміни є попередниками коферментів, а інші діють безпосередньо як коферменти. Вітамін С є прямим коензимом для декількох ферментів, які беруть участь у побудові важливої сполучної тканини, колагену. Тому функція ферментів частково регулюється великою кількістю різних кофакторів і коферментів, які можуть забезпечуватися раціоном організму або, в деяких випадках, вироблятися організмом.
Запит\(\PageIndex{1}\)
ActivityЗапит\(\PageIndex{2}\)
ActivityЗапит\(\PageIndex{3}\)
ActivityЗапит\(\PageIndex{4}\)
ActivityЗапит\(\PageIndex{5}\)
ActivityПосилання
Якщо не зазначено інше, зображення на цій сторінці ліцензуються відповідно до CC-BY 4.0 OpenStax.
Текст адаптований з: OpenStax, Концепції біології. OpenStax CNX. 18 травня 2016 р. http://cnx.org/contents/b3c1e1d2-839...9a8aafbdd@9.10