12.2: Візуалізація та характеристика ДНК
- Page ID
- 4058
Цілі навчання
- Поясніть використання зондів нуклеїнової кислоти для візуалізації конкретних послідовностей ДНК
- Поясніть використання гелевого електрофорезу для відокремлення фрагментів ДНК
- Поясніть принцип аналізу поліморфізму довжини рестрикційного фрагмента та його використання
- Порівняйте і контрастуйте південні і північні плями
- Поясніть принципи та використання аналізу мікромасивів
- Опишіть методи, які використовуються для розділення та візуалізації білкових варіантів
- Поясніть метод та використання полімеразної ланцюгової реакції та секвенування ДНК
Послідовність молекули ДНК може допомогти нам ідентифікувати організм у порівнянні з відомими послідовностями, розміщеними в базі даних. Послідовність також може розповісти нам щось про функцію певної частини ДНК, наприклад, чи кодує вона певний білок. Порівняння білкових підписів - рівнів експресії конкретних масивів білків - між зразками є важливим методом оцінки клітинних реакцій на безліч факторів навколишнього середовища та стресів. Аналіз білкових сигнатур може виявити ідентичність організму або як клітина реагує під час захворювання.
ДНК і білки, що представляють інтерес, мікроскопічні і, як правило, змішуються з багатьма іншими молекулами, включаючи ДНК або білки, що не мають відношення до наших інтересів. Для виділення і характеристики молекул, що цікавлять, розроблено багато методик. Ці методи спочатку були розроблені для дослідницьких цілей, але в багатьох випадках вони були спрощені до того, що можливе звичайне клінічне використання. Наприклад, багато патогенні мікроорганізми, такі як бактерія Helicobacter pylori, яка викликає виразку шлунка, можна виявити за допомогою тестів на основі білків. Крім того, все більша кількість високоспецифічних та точних ідентифікаційних аналізів на основі ампліфікації ДНК тепер може виявити такі патогени, як стійкі до антибіотиків кишкові бактерії, вірус простого герпесу, вірус вітряної віспи та багато інших.
Молекулярний аналіз ДНК
У цьому підрозділі ми викладемо деякі основні методи, які використовуються для поділу і візуалізації конкретних фрагментів ДНК, які представляють інтерес для вченого. Деякі з цих методів не вимагають знання повної послідовності молекули ДНК. До появи швидкого секвенування ДНК ці методи були єдиними доступними для роботи з ДНК, але вони все ще утворюють основний арсенал інструментів, що використовуються молекулярними генетиками для вивчення реакцій організму на мікробні та інші захворювання.
Зондування нуклеїнової кислоти
Молекули ДНК невеликі, а інформація, що міститься в їх послідовності, невидима. Як дослідник виділяє ту чи іншу ділянку ДНК, або виділивши його, визначає, з якого організму вона складається, яка його послідовність, або яка його функція? Один із методів виявлення наявності певної послідовності ДНК використовує штучно побудовані шматочки ДНК, звані зондами. Зонди можуть бути використані для ідентифікації різних видів бактерій у навколишньому середовищі, і багато зондів ДНК тепер доступні для клінічного виявлення патогенів. Наприклад, ДНК-зонди використовуються для виявлення вагінальних збудників Candida albicans, Gardnerella vaginalis та Trichomonas vaginalis.
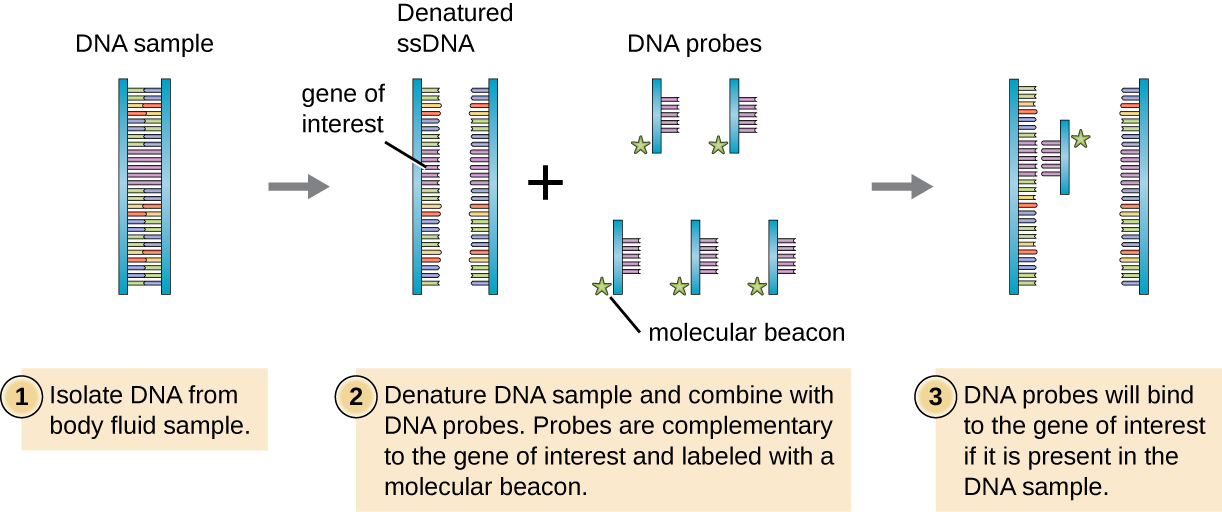
Щоб перевірити геномну бібліотеку для певного гена або послідовності, що цікавить, дослідники повинні знати щось про цей ген. Якщо дослідники мають частину послідовності ДНК для цікавить гена, вони можуть спроектувати зонд ДНК, одноланцюговий фрагмент ДНК, який доповнює частину цікавого гена і відрізняється від інших послідовностей ДНК у зразку. ДНК-зонд може бути синтезований хімічним шляхом комерційними лабораторіями, або він може бути створений шляхом клонування, ізоляції та денатурації фрагмента ДНК з живого організму. У будь-якому випадку зонд ДНК повинен бути позначений молекулярною міткою або маяком, таким як радіоактивний атом фосфору (як використовується для авторадіографії) або флуоресцентним барвником (як використовується при флуоресцентній гібридизації in situ, або FISH), щоб можна було побачити зонд і ДНК, з якою він зв'язується (Рис. \(\PageIndex{1}\)). Зразок ДНК, що досліджується, також повинен бути денатурований, щоб зробити його одноланцюговим, щоб одноланцюговий зонд ДНК міг відпалити до одноланцюгового зразка ДНК в місцях, де їх послідовності взаємодоповнюють. Хоча ці методи є цінними для діагностики, їх безпосереднє використання на мокротинні та інших зразках тіла може бути проблематичним через складний характер цих зразків. ДНК часто потрібно спочатку ізолювати із зразків тіла хімічними методами екстракції, перш ніж зонд ДНК може бути використаний для ідентифікації патогенів.
Клінічна спрямованість: Частина 2
Легкі грипоподібні симптоми, які відчуває Кайла, можуть бути викликані будь-якою кількістю інфекційних агентів. Крім того, кілька неінфекційних аутоімунних станів, таких як розсіяний склероз, системний червоний вовчак (СЧВ) та бічний аміотрофічний склероз (БАС), також мають симптоми, які узгоджуються з ранніми симптомами Кайли. Однак протягом декількох тижнів симптоми Кайли погіршилися. Вона почала відчувати біль у суглобах в колін, прискорене серцебиття і дивна кульгавість м'язів обличчя. Крім того, вона страждала від жорсткої шиї і хворобливих головних болів. Неохоче вона вирішила, що пора звернутися за медичною допомогою.
Вправа\(\PageIndex{1}\)
- Чи дають нові симптоми Кайли будь-які підказки щодо того, який тип інфекції чи іншого медичного стану вона може мати?
- Які тести чи інструменти може використовувати медичний працівник, щоб визначити збудник, що викликає симптоми Кайли?
Агарозний гель електрофорез
Існує ряд ситуацій, в яких дослідник може захотіти фізично відокремити колекцію фрагментів ДНК різного розміру. Дослідник може також перетравлювати зразок ДНК з рестрикційним ферментом з утворенням фрагментів. Отримана картина розподілу розмірів та фрагментів часто може дати корисну інформацію про послідовність основ ДНК, які можуть бути використані, подібно до сканування штрих-коду, для ідентифікації індивіда або виду, до якого належить ДНК.
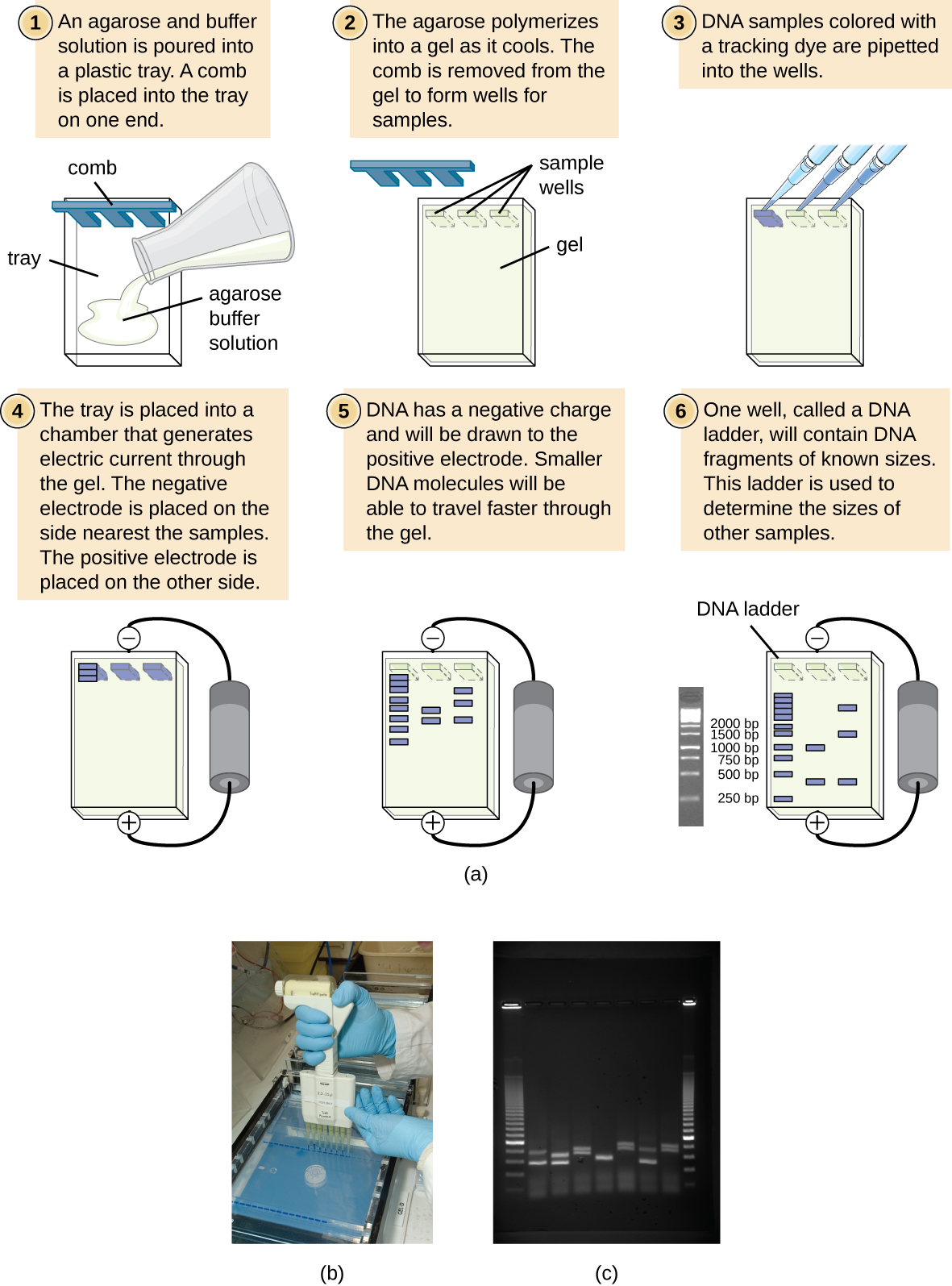
Гелевий електрофорез - це методика, яка зазвичай використовується для поділу біологічних молекул на основі розміру та біохімічних характеристик, таких як заряд та полярність. Гелевий електрофорез агарозного гелю широко використовується для відділення ДНК (або РНК) різних розмірів, які можуть генеруватися рестрикційним ферментним перетравленням або іншими способами, такими як ПЛР (рис.\(\PageIndex{2}\)).
За рахунок свого негативно зарядженого хребта ДНК сильно притягується до позитивного електрода. При електрофорезі агарозного гелю гель орієнтується горизонтально в буферному розчині. Зразки завантажують у зразкові лунки з боку гелю, найближчого до негативного електрода, потім витягують через молекулярне сито агарозної матриці у напрямку до позитивного електрода. Матриця агарози перешкоджає руху більших молекул через гель, тоді як більш дрібні молекули проходять через нього легше. Таким чином, відстань міграції обернено корелює з розміром фрагмента ДНК, причому більш дрібні фрагменти проходять більшу відстань через гель. Розміри фрагментів ДНК всередині зразка можна оцінити порівняно з фрагментами відомого розміру в драбинці ДНК, які також проходять на тому ж гелі. Для відділення дуже великих фрагментів ДНК, таких як хромосоми або вірусні геноми, електрофорез агарозного гелю можна модифікувати, періодично чергуючи орієнтацію електричного поля під час імпульсного польового гелевого електрофорезу (ПФГЕ). У PFGE менші фрагменти можуть переорієнтуватися і мігрувати трохи швидше, ніж більші фрагменти, і ця техніка може, таким чином, служити для відокремлення дуже великих фрагментів, які в іншому випадку подорожували б разом під час стандартного електрофорезу агарозного гелю. У будь-якому з цих методів електрофорезу місця розташування фрагментів ДНК або РНК в гелі можуть бути виявлені різними методами. Одним із поширених методів є додавання броміду етидію, плями, яка вставляється в нуклеїнові кислоти в неспецифічних місцях і може бути візуалізована під впливом ультрафіолету. Інші плями, безпечніші, ніж бромід етидію, потенційний канцероген, тепер доступні.
Аналіз поліморфізму довжини рестрикційного фрагмента (RFLP)
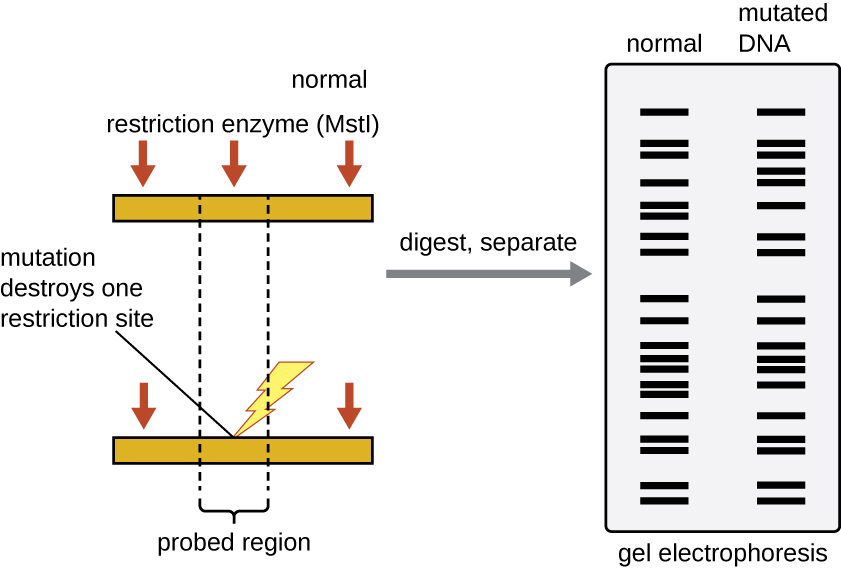
Місця розпізнавання рестрикційних ферментів короткі (довжиною лише кілька нуклеотидів), паліндроми, специфічні для послідовності, і можуть бути знайдені по всьому геному. Таким чином, відмінності в послідовностях ДНК в геномах індивідів призведуть до відмінностей у розподілі місць розпізнавання рестрикційно-ферментів, які можуть бути візуалізовані як чіткі смугасті візерунки на гелі після електрофорезу агарозного гелю. Аналіз поліморфізму довжини рестрикційного фрагмента (RFLP) порівнює схеми бандажу ДНК різних зразків ДНК після рестрикційного перетравлення (рис.\(\PageIndex{3}\)).
Аналіз RFLP має безліч практичних застосувань як в медицині, так і в криміналістиці. Наприклад, епідеміологи використовують RFLP-аналіз для відстеження та виявлення джерела конкретних мікроорганізмів, причетних до спалахів харчових отруєнь або деяких інфекційних захворювань. Аналіз RFLP також може бути використаний на ДНК людини для визначення моделей успадкування хромосом з варіантними генами, в тому числі пов'язаних з спадковими захворюваннями або для встановлення батьківства.
Судові експерти використовують аналіз RFLP як форму відбитків пальців ДНК, яка корисна для аналізу ДНК, отриманої з місць злочину, підозрюваних та потерпілих. Зразки ДНК збирають, кількість копій молекул ДНК зразка збільшують за допомогою ПЛР, а потім піддають рестрикційному ферментному перетравленню та електрофорезу агарозного гелю для створення специфічних діапазонних моделей. Порівнюючи зразки бандажу зразків, зібраних з місця злочину, проти тих, що зібрані у підозрюваних або потерпілих, слідчі можуть остаточно визначити, чи залишили докази ДНК, зібрані на місці події, підозрювані або потерпілі.
Південні плями і модифікації
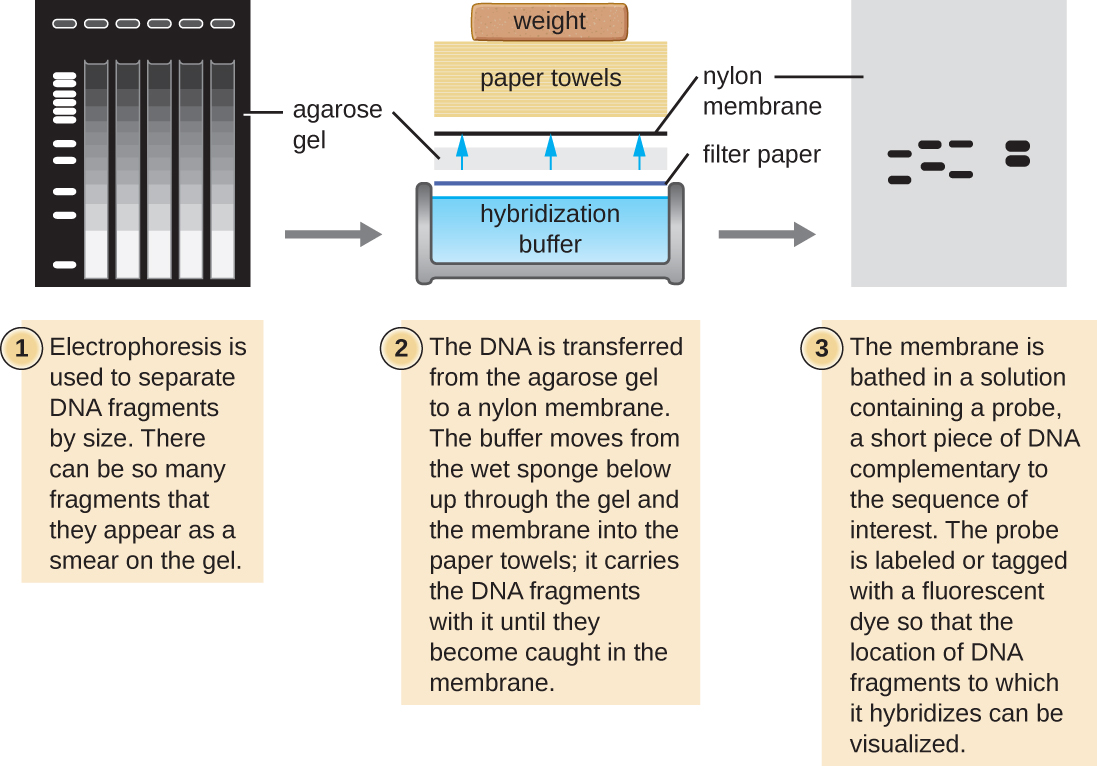
Кілька молекулярних методів використовують використання послідовності комплементарності та гібридизації між нуклеїновими кислотами зразка та зондами ДНК. Як правило, зондування зразків нуклеїнових кислот всередині гелю є невдалим, оскільки, коли зонд ДНК просочується в гель, зразки нуклеїнових кислот всередині гелю дифузіруются. Таким чином, методи блоттинга зазвичай використовуються для перенесення нуклеїнових кислот на тонку, позитивно заряджену мембрану, виготовлену з нітроцелюлози або нейлону. У Південній блоттехніці, розробленій сером Едвіном Саутерном в 1975 році, фрагменти ДНК всередині зразка спочатку відокремлюються електрофорезом агарозного гелю, а потім переносяться на мембрану за допомогою капілярної дії (рис.\(\PageIndex{4}\)). Фрагменти ДНК, які зв'язуються з поверхнею мембрани, потім піддаються впливу специфічного одноцепочечного зонда ДНК, позначеного радіоактивним або флуоресцентним молекулярним маяком, щоб допомогти у виявленні. Південні плями можуть бути використані для виявлення наявності певних послідовностей ДНК в даному зразку ДНК. Після візуалізації цільової ДНК всередині мембрани дослідники можуть вирізати частину мембрани, що містить фрагмент, щоб відновити цікавий фрагмент ДНК.
Варіації Південного пляма - точкова пляма, пляма щілини та пляма - не включають електрофорез, а замість цього концентрують ДНК із зразка в невеликому місці на мембрані. Після гібридизації за допомогою ДНК-зонда вимірюється виявлена інтенсивність сигналу, що дозволяє досліднику оцінити кількість цільової ДНК, присутньої всередині зразка.
Колонійний плям - це ще одна варіація Південного пляма, в якій колонії, що представляють різні клони в геномній бібліотеці, переносяться на мембрану шляхом натискання мембрани на культуральну пластину. Клітини на мембрані лізуються, і мембрану потім можна зондувати, щоб визначити, які колонії в геномній бібліотеці містять цільовий ген. Оскільки колонії на тарілці все ще ростуть, цікаві клітини можна виділити з пластини.
У північній плямі інша варіація Південного пляма, РНК (НЕ ДНК) іммобілізується на мембрані і прощупується. Північні плями зазвичай використовуються для виявлення кількості мРНК, зробленої шляхом експресії генів у зразку тканини або організму.
Аналіз мікромасивів
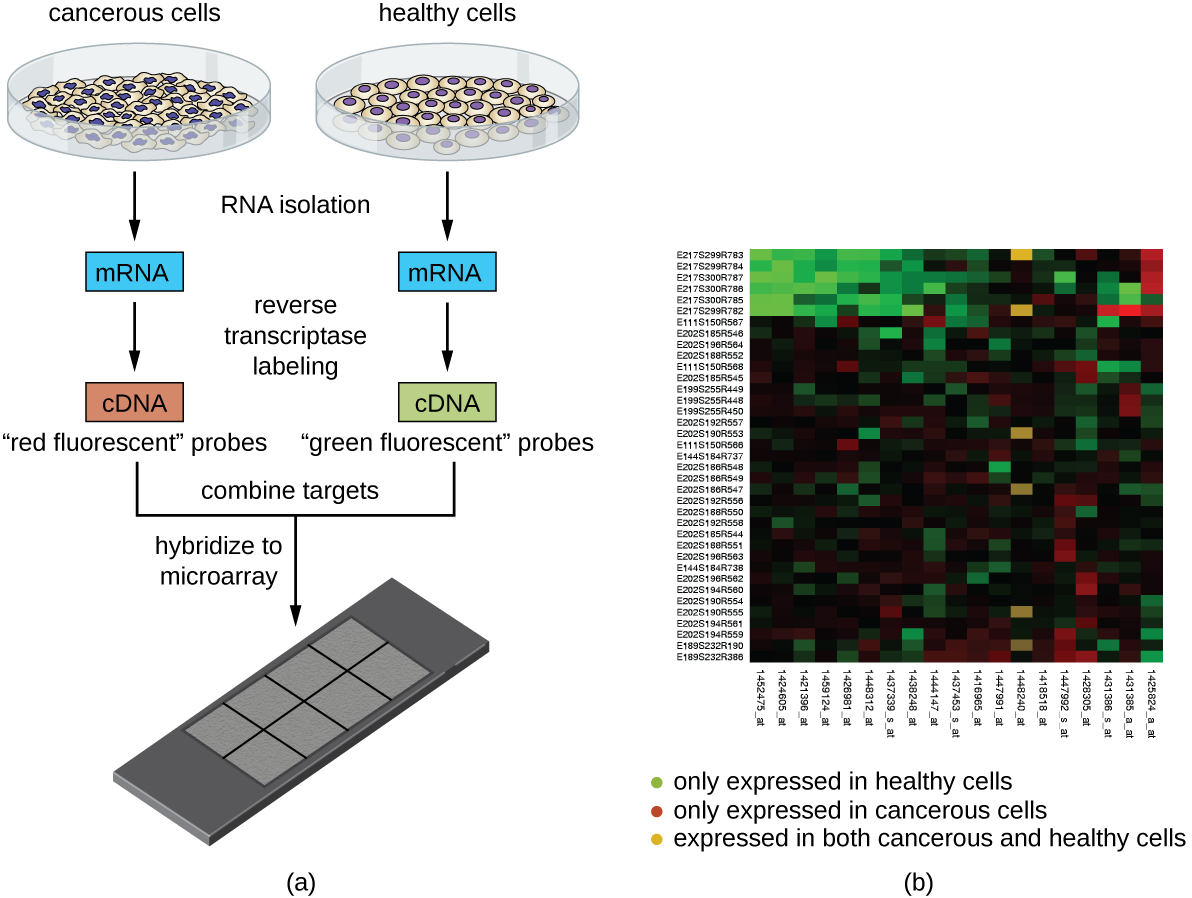
Ще одна методика, яка використовує гібридизацію між комплементарними послідовностями нуклеїнових кислот, називається мікроматричним аналізом. Аналіз мікромасивів корисний для порівняння моделей експресії генів між різними типами клітин - наприклад, клітин, інфікованих вірусом, проти неінфікованих клітин, або ракових клітин проти здорових клітин (Рисунок\(\PageIndex{5}\)).
Як правило, ДНК або кДНК з експериментального зразка депонуються на скляному слайді поряд з відомими послідовностями ДНК. Кожен слайд може містити більше 30 000 різних типів фрагментів ДНК. Різні фрагменти ДНК (що охоплюють всю геномну бібліотеку організму) або фрагменти кДНК (відповідні повному доповненню організму експресованих генів) можуть бути окремо помічені на скляному слайді.
Після депонування на слайді геномну ДНК або мРНК можна виділити з двох зразків для порівняння. Якщо іРНК ізольована, її зворотно транскрибують до кДНК за допомогою зворотної транскриптази. Потім два зразки геномної ДНК або кДНК маркуються різними флуоресцентними барвниками (зазвичай червоним і зеленим). Потім мічені зразки геномної ДНК об'єднують у рівних кількостях, додають до мікромікросхеми та дозволяють гібридизувати до додаткових плям на мікромасиві.
Гібридизацію молекул геномної ДНК зразка можна контролювати шляхом вимірювання інтенсивності флуоресценції в окремих плямах на мікромасиві. Відмінності в кількості гібридизації між зразками можна легко спостерігати. Якщо лише нуклеїнові кислоти одного зразка гібридизуються до певної плями на мікромасиві, то ця пляма буде або зеленим, або червоним. Однак якщо нуклеїнові кислоти обох зразків гібридизуються, то пляма з'явиться жовтим через поєднання червоного і зеленого барвників.
Хоча технологія мікромасивів дозволяє проводити цілісне порівняння двох зразків за короткий час, вона вимагає складного (і дорогого) обладнання для виявлення та програмного забезпечення для аналізу. Через витрати ця технологія, як правило, обмежується дослідницькими налаштуваннями. Дослідники використовували аналіз мікромасивів для вивчення того, як впливає на експресію генів в організмах, заражених бактеріями або вірусами або піддаються певній хімічній обробці.
Дослідіть технологію мікрочіпів на цьому інтерактивному веб-сайті.
Вправа\(\PageIndex{2}\)
- З чого складається ДНК-зонд?
- Чому південна пляма використовується після гелевого електрофорезу ДНК дайджеста?
Молекулярний аналіз білків
У багатьох випадках може бути небажаним або можливим вивчення ДНК або РНК безпосередньо. Білки можуть надавати специфічну для виду інформацію для ідентифікації, а також важливу інформацію про те, як і чи реагує клітина або тканина на присутність патогенного мікроорганізму. Різні білки вимагають різних методів виділення і характеристики.
Поліакриламідний гель Електрофорез
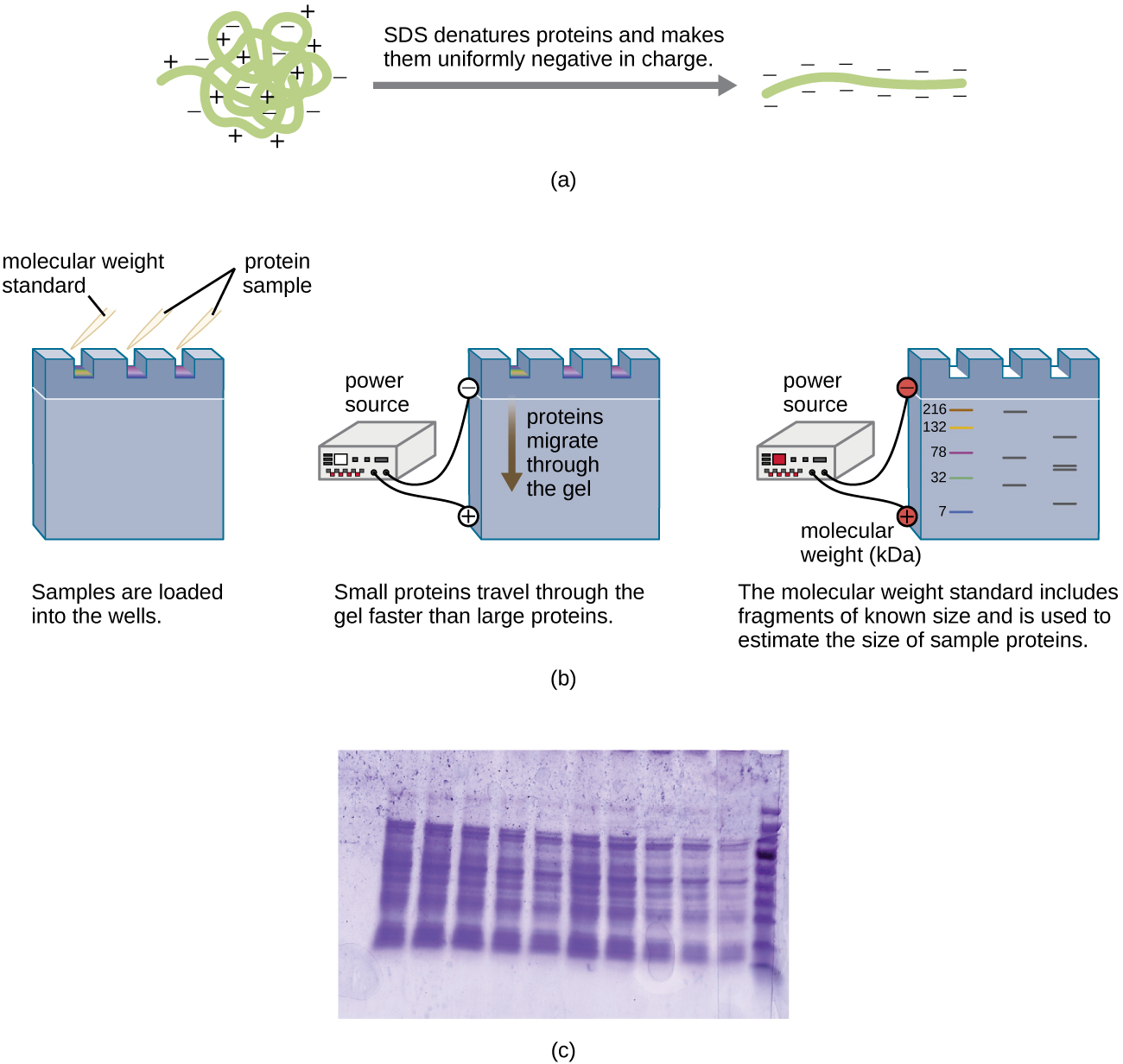
Різновид гелевого електрофорезу, який називається електрофорезом поліакриламідного гелю (PAGE), зазвичай використовується для поділу білків. У PAGE гелева матриця тонша і складається з поліакриламіду замість агарози. Додатково PAGE зазвичай виконується за допомогою вертикального гелевого апарату (рис.\(\PageIndex{6}\)). Через різні заряди, пов'язані з бічними ланцюгами амінокислот, PAGE може бути використаний для відокремлення інтактних білків на основі їх чистих зарядів. Крім того, білки можуть бути денатуровані та покриті негативно зарядженим миючим засобом під назвою додецилсульфат натрію (SDS), маскуючи нативні заряди та дозволяючи розділяти лише за розміром. PAGE може бути додатково модифікований для розділення білків на основі двох характеристик, таких як їх заряди при різних рН, а також їх розмір, за допомогою двовимірного PAGE. У будь-якому з цих випадків, після електрофорезу, білки візуалізуються за допомогою фарбування, як правило, або з синім кольором Coomassie, або срібною плямою.
Вправа\(\PageIndex{3}\)
На якій основі виділяють білки в SDS-PAGE?
Клінічна спрямованість: Частина 3
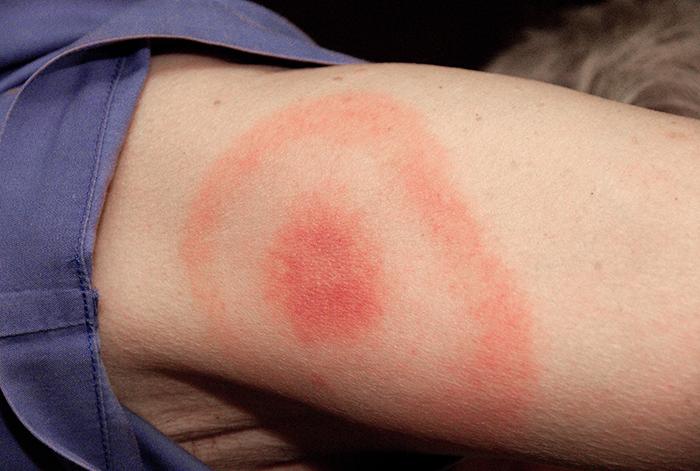
Коли Кайла описала свої симптоми, її лікар спочатку запідозрив бактеріальний менінгіт, який узгоджується з її головними болями і жорсткою шиєю. Однак незабаром вона виключила це як можливість, оскільки менінгіт зазвичай прогресує швидше, ніж те, що переживала Кайла. Багато її симптомів все ще паралельні з симптомами аміотрофічного бічного склерозу (БАС) та системного червоного вовчака (СЧВ), і лікар також вважав хворобу Лайма можливістю, враховуючи, скільки часу проводить Кайла в лісі. Кайла не згадувала жодних недавніх укусів кліщів (типові засоби, за допомогою яких передається хвороба Лайма) і у неї не було типової висипу яблучного ока, пов'язаної з хворобою Лайма (рис.\(\PageIndex{7}\)). Однак у 20— 30% пацієнтів з хворобою Лайма ніколи не розвивається ця висип, тому лікар не хотів її виключати.
Лікар Кайли призначив МРТ її мозку, повний аналіз крові для аналізу на анемію, аналізи крові, що оцінюють роботу печінки та нирок, а також додаткові тести для підтвердження або виключення СЧВ або хвороби Лайма. Її результати тестів не відповідали як СЧВ, так і з БАС, і результат тесту, який шукає антитіла до хвороби Лайма, був «неоднозначним», що означає непереконливий. Виключивши БАС і СЧВ, лікар Кайли вирішив провести додаткові аналізи на хворобу Лайма.
Вправа\(\PageIndex{4}\)
- Чому лікар Кайли все ще підозрює хворобу Лайма, навіть якщо результати аналізів не виявили антитіла Лайма в крові?
- Який тип молекулярного тесту може бути використаний для виявлення антитіл крові до хвороби Лайма?
Методи аналізу ДНК на основі ампліфікації
Для отримання послідовностей ДНК можуть використовуватися різні методи, які корисні для вивчення хвороботворних організмів. З появою технології швидкого секвенування наша база знань про всі геноми патогенних організмів виросла феноменально. Почнемо з опису полімеразної ланцюгової реакції, яка не є методом секвенування, але дозволила дослідникам та клініцистам отримати велику кількість ДНК, необхідну для секвенування та інших досліджень. Полімеразна ланцюгова реакція усуває залежність, яку ми колись мали від клітин, щоб зробити кілька копій ДНК, досягаючи того ж результату за допомогою відносно простих реакцій поза клітиною.
Полімеразна ланцюгова реакція (ПЛР)
Більшість методів аналізу ДНК, таких як рестрикційне засвоєння ферментів і електрофорез агарозного гелю, або секвенування ДНК, вимагають великої кількості конкретного фрагмента ДНК. У минулому велика кількість ДНК вироблялася шляхом вирощування клітин господаря геномної бібліотеки. Однак бібліотекам потрібен час і зусилля для підготовки, а зразки ДНК, що цікавлять, часто надходять у незначних кількостях. Полімеразна ланцюгова реакція (ПЛР) дозволяє швидко ампліфікувати кількість копій специфічних послідовностей ДНК для подальшого аналізу (рис.\(\PageIndex{8}\)). Одна з найпотужніших методик молекулярної біології, ПЛР була розроблена в 1983 році Карі Муллісом, перебуваючи в корпорації Cetus. ПЛР має специфічне застосування в дослідницьких, криміналістичних та клінічних лабораторіях, включаючи:
- визначення послідовності нуклеотидів в певній області ДНК
- посилення цільової області ДНК для клонування в плазмідний вектор
- виявлення джерела зразка ДНК, залишеного на місці злочину
- аналіз зразків для визначення батьківства
- порівняння зразків стародавньої ДНК з сучасними організмами
- визначення наявності важко культивуваних або некультурних мікроорганізмів у людей або зразках навколишнього середовища
ПЛР - це лабораторна методика in vitro, яка використовує переваги природного процесу реплікації ДНК. Термостійкі ферменти ДНК-полімерази, що використовуються в ПЛР, отримують з гіпертермофільних прокаріотів. ДНК-полімераза Taq, яка зазвичай використовується в ПЛР, походить від бактерії Thermus aquaticus, виділеної з гарячого джерела в Єллоустонському національному парку. Реплікація ДНК вимагає використання праймерів для початку реплікації, щоб мати вільні 3'-гідроксильні групи, доступні для додавання нуклеотидів ДНК-полімеразою. Однак, хоча праймери, що складаються з РНК, зазвичай використовуються в клітині, ДНК-праймери використовуються для ПЛР. ДНК-праймери є кращими через їх стабільність, а праймери ДНК з відомими послідовностями, орієнтованими на конкретну область ДНК, можуть бути хімічно синтезовані комерційно. Ці праймери ДНК функціонально схожі на зонди ДНК, що використовуються для різних методів гібридизації, описаних раніше, зв'язуючись із конкретними мішенями через взаємодоповнюваність між цільовою послідовністю ДНК та праймером.
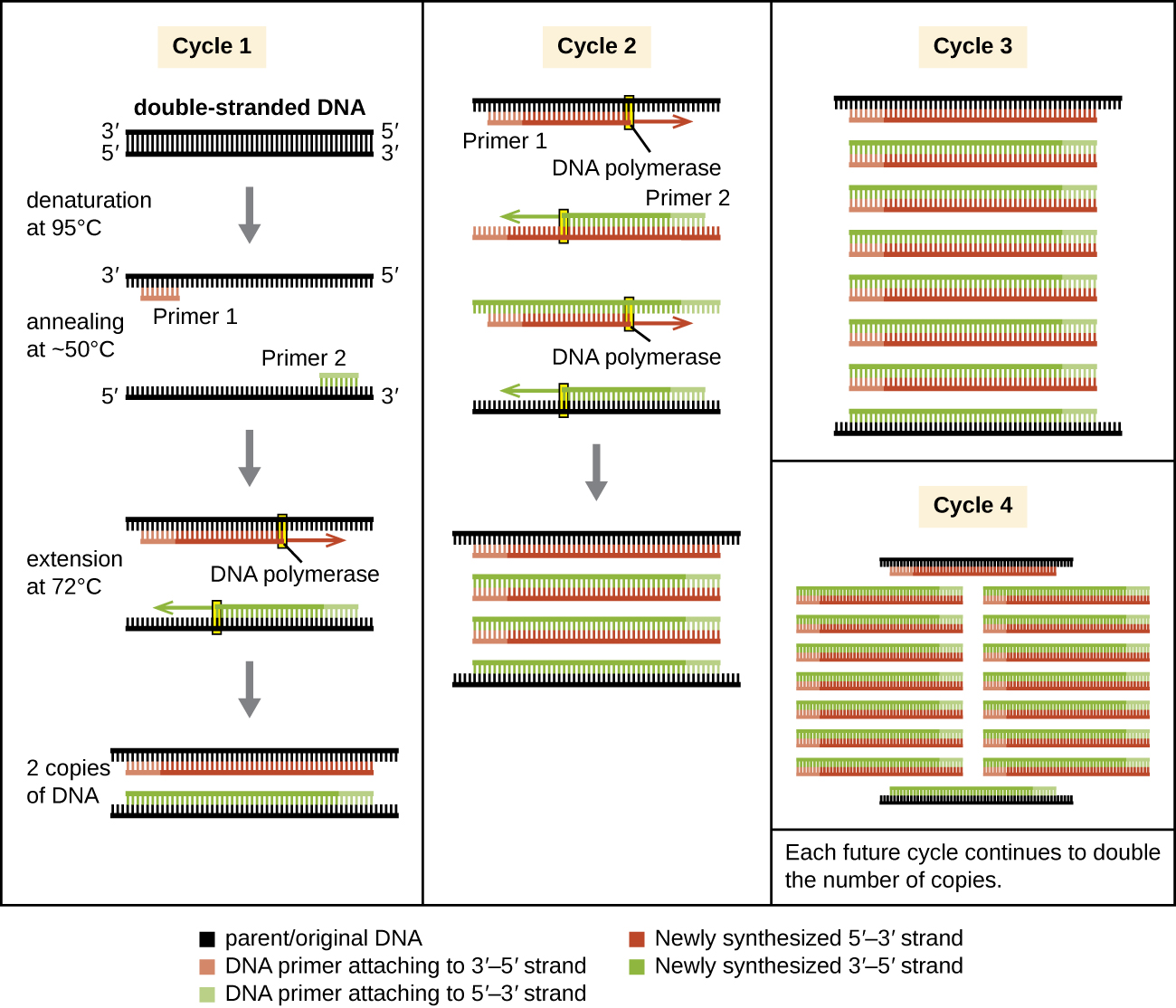
ПЛР відбувається протягом декількох циклів, кожен з яких містить три етапи: денатурацію, відпал та подовження. Машини, звані тепловими циклерами, використовуються для ПЛР; ці машини можуть бути запрограмовані на автоматичний цикл через температури, необхідні на кожному кроці (рис. 12.1). По-перше, дволанцюгова шаблонна ДНК, що містить цільову послідовність, денатурується при температурі приблизно 95° C. висока температура, необхідна для фізичного (а не ферментативного) відділення ниток ДНК, є причиною того, що потрібна термостабільна ДНК-полімераза. Далі температуру знижують приблизно до 50 °С, що дозволяє доповнюють кінці цільової послідовності ДНК-праймерів відпалювати (приклеювати) до ниток шаблону, з одним відпалом праймера до кожної пасма. Нарешті, температура підвищується до 72° C, оптимальної температури для активності термостійкої ДНК-полімерази, що дозволяє додавати нуклеотиди до праймера за допомогою однониткової мішені як шаблону. Кожен цикл подвоює кількість дволанцюгових копій ДНК мішені. Зазвичай протоколи ПЛР включають 25—40 циклів, що дозволяє посилити одну цільову послідовність на десятки мільйонів до понад трильйона.
Природна реплікація ДНК призначена для копіювання всього геному і ініціюється в одному або декількох місцях походження. Грунтовки будуються при реплікації, а не раніше, і не складаються з декількох конкретних послідовностей. ПЛР націлює конкретні ділянки зразка ДНК за допомогою праймерів, специфічних для послідовності. В останні роки були розроблені різноманітні ізотермічні методи ампліфікації ПЛР, які обходять необхідність термічного циклічного циклу, використовуючи переваги допоміжних білків, які допомагають у процесі реплікації ДНК. Оскільки розвиток цих методів триває і їх використання набуває все більшого поширення в дослідницьких, криміналістичних та клінічних лабораторіях, термічні циклери можуть застаріти.
Поглибте своє розуміння полімеразної ланцюгової реакції, переглянувши цю анімацію та працюючи через інтерактивну вправу.
Варіації ПЛР
Кілька пізніших модифікацій ПЛР ще більше збільшують корисність цієї методики. ПЛР зворотної транскриптази (ЗТ-ПЛР) використовується для отримання ДНК-копій конкретної молекули мРНК. ЗТ-ПЛР починається з використання ферменту зворотної транскриптази для перетворення молекул мРНК в кДНК. Потім ця кДНК використовується як шаблон для традиційної ампліфікації ПЛР. ЗТ-ПЛР може виявити, чи був експресований конкретний ген у зразку. Ще одним недавнім застосуванням ПЛР є ПЛР в реальному часі, також відома як кількісна ПЛР (qPCR). Стандартні протоколи ПЛР та ЗТ-ПЛР не є кількісними, оскільки будь-який з реагентів може стати обмежуючим до завершення всіх циклів у протоколі, а зразки аналізуються лише наприкінці. Оскільки неможливо визначити, коли в протоколі ПЛР або ЗТ-ПЛР даний реагент став обмежуючим, неможливо дізнатися, скільки циклів було виконано до цього моменту, і, таким чином, неможливо визначити, скільки вихідних молекул шаблону було присутнє у зразку на початку ПЛР. Однак у QPCR використання флуоресценції дозволяє контролювати збільшення дволанцюгового шаблону під час реакції ПЛР у міру її виникнення. Ці дані кінетики потім можуть бути використані для кількісної оцінки кількості вихідної цільової послідовності. Використання QPCR в останні роки ще більше розширило можливості ПЛР, дозволивши дослідникам визначити кількість копій ДНК, а іноді і організмів, присутніх у зразку. У клінічних умовах QRT-ПЛР використовується для визначення вірусного навантаження у ВІЛ-позитивних пацієнтів для оцінки ефективності їх терапії.
Секвенування ДНК
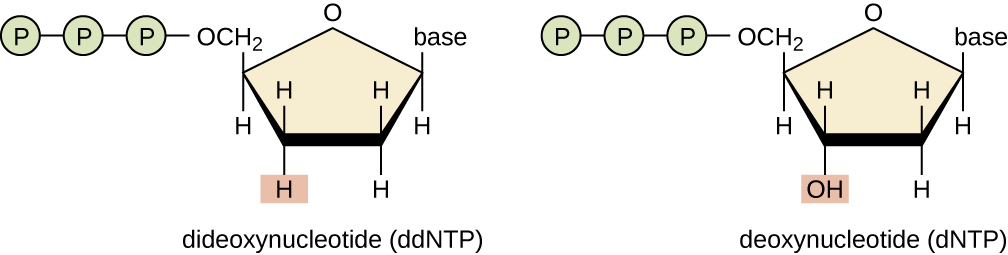
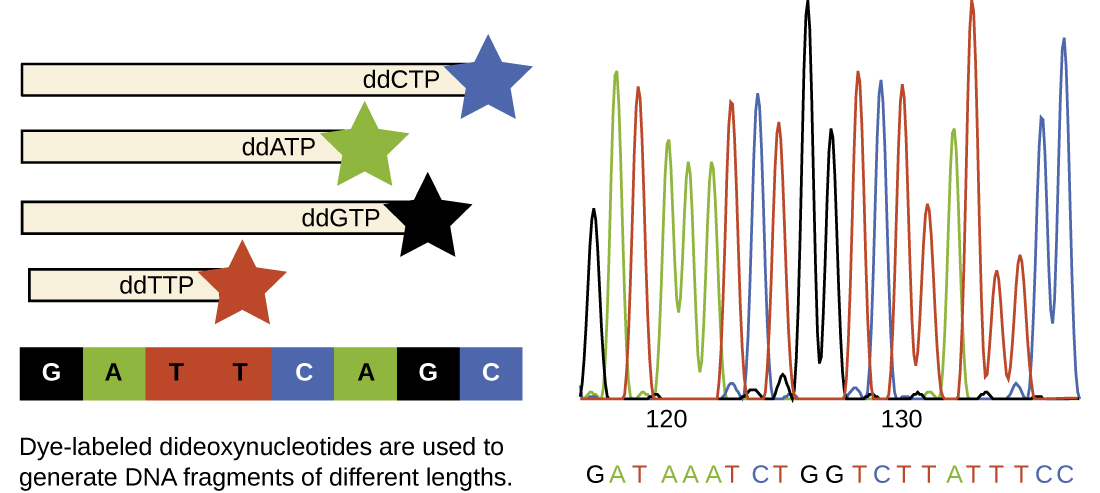
Основною технікою секвенування є метод припинення ланцюга, також відомий як метод дідеокси або метод секвенування ДНК Сангера, розроблений Фредеріком Сангером в 1972 році. Метод припинення ланцюга включає реплікацію ДНК однониткового шаблону з використанням праймера ДНК для ініціювання синтезу комплементарної нитки, ДНК-полімерази, суміші чотирьох регулярних дезоксинуклеотидних (dnTP) мономерів та невеликої частки дидезоксинуклеотидів (DDNTP), кожен з яких позначений молекулярний маяк. DDNTP - це мономери, які відсутні гідроксильна група (—OH) на місці, на якому інший нуклеотид зазвичай приєднується, утворюючи ланцюг (рис.\(\PageIndex{9}\)). Кожен раз, коли DDNTP випадковим чином включається у зростаючу додаткову нитку, він припиняє процес реплікації ДНК для цієї конкретної нитки. Це призводить до декількох коротких ниток реплікованої ДНК, які закінчуються в різній точці під час реплікації. Коли реакційна суміш піддається гелевому електрофорезу, множинні знову репліковані нитки ДНК утворюють сходи різних розмірів. Оскільки DDNTP позначені, кожна смуга на гелі відображає розмір нитка ДНК, коли DdNTP припиняє реакцію.
У день Сангера було встановлено чотири реакції для кожної секвенованої молекули ДНК, кожна реакція містить лише одну з чотирьох можливих DDNTP. Кожен DDNTP був маркований радіоактивною молекулою фосфору. Продукти чотирьох реакцій потім запускалися окремими смугами пліч-о-пліч на довгих вузьких гелів PAGE, а смуги різної довжини були виявлені авторентгенографією. Сьогодні цей процес спрощений з використанням DDNTPS, кожен з яких позначений різним кольоровим флуоресцентним барвником або фторхромом (рис.\(\PageIndex{10}\)), в одній реакції секвенування, що містить всі чотири можливі DDNTP для кожної секвенованої молекули ДНК (рис.\(\PageIndex{11}\)). Ці флюорохроми виявляються за допомогою флуоресцентної спектроскопії. Визначення кольору флуоресценції кожної смуги, коли вона проходить повз детектор, виробляє нуклеотидну послідовність шаблонної нитки.
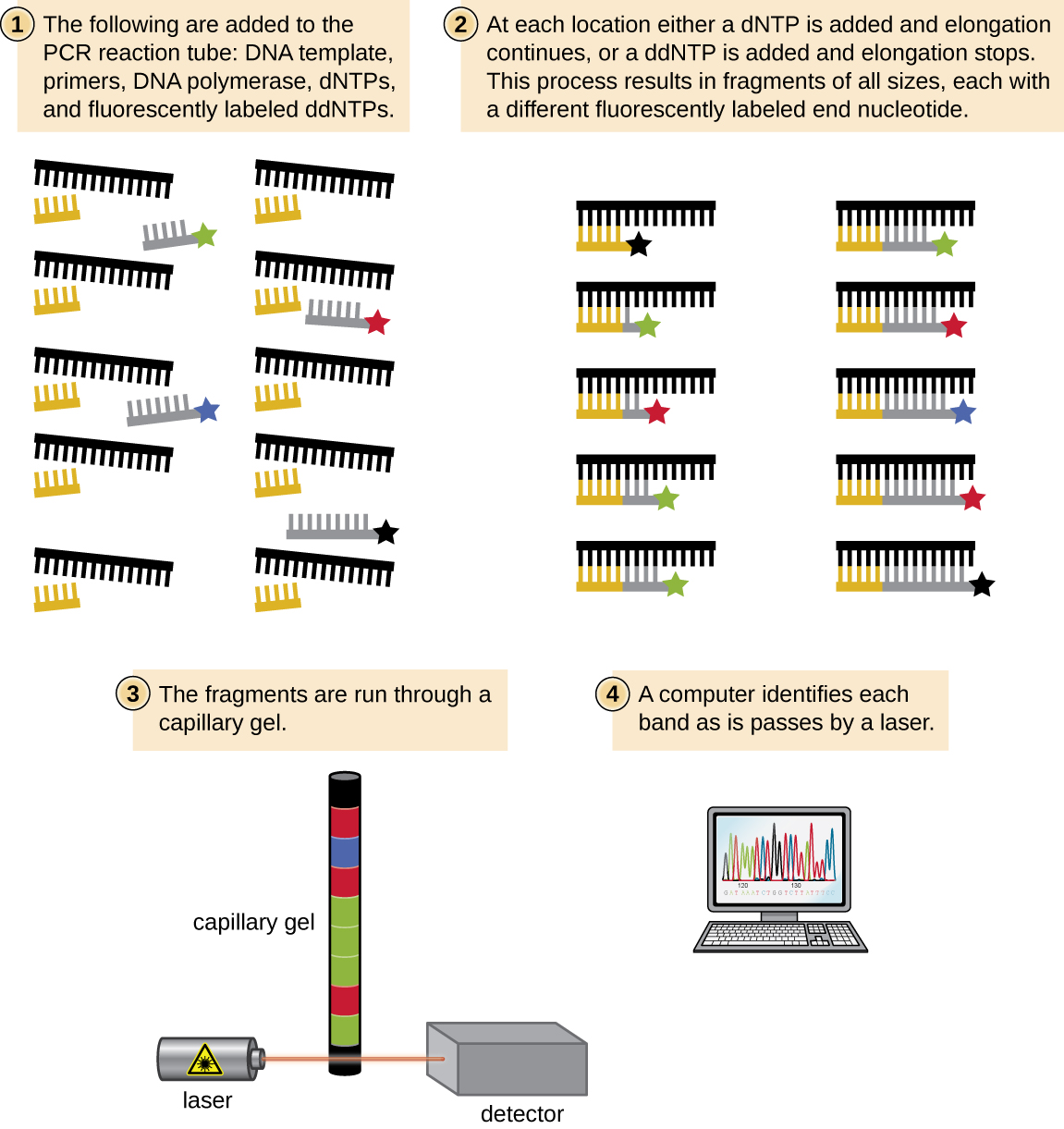
З 2005 року методи автоматизованого секвенування, що використовуються лабораторіями, підпадають під парасольку секвенування наступного покоління, яке є групою автоматизованих методів, що використовуються для швидкого секвенування ДНК. Ці методи зробили революцію в області молекулярної генетики, оскільки недорогі секвенсори можуть генерувати послідовності сотень тисяч або мільйонів коротких фрагментів (від 25 до 600 пар основи) лише за один день. Хоча кілька варіантів технологій секвенування наступного покоління виробляються різними компаніями (наприклад, піросеквенування 454 Life Sciences та технологія Solexa Illumina), всі вони дозволяють швидко секвенувати мільйони баз, що робить секвенування цілих геномів відносно легким, недорогим, і буденність. У 454 секвенування (піросеквенування), наприклад, зразок ДНК фрагментується на 400-600-рп однониткові фрагменти, модифіковані з додаванням адаптерів ДНК до обох кінців кожного фрагмента. Потім кожен фрагмент ДНК іммобілізується на намистину і посилюється ПЛР, використовуючи праймери, призначені для відпалу до адаптерів, створюючи кульку, що містить багато копій цього фрагмента ДНК. Потім кожну кульку кладуть в окрему лунку, що містить секвенуючі ферменти. До свердловини кожен з чотирьох нуклеотидів додається один за одним; при включенні кожного пірофосфат виділяється як побічний продукт полімеризації, випромінюючи невеликий спалах світла, який реєструється детектором. Це забезпечує порядок нуклеотидів, включених у міру створення нового ланцюга ДНК, і є прикладом секвенування синтезу. Секвенсори наступного покоління використовують складне програмне забезпечення, щоб пройти громіздкий процес приведення всіх фрагментів в порядок. Загалом, ці технології продовжують швидко розвиватися, зменшуючи вартість секвенування та швидко збільшуючи доступність даних послідовності від найрізноманітніших організмів.
Національний центр біотехнологічної інформації розміщує широко використовувану базу даних генетичних послідовностей під назвою GenBankДе дослідники здають генетичну інформацію для загального користування. Після публікації даних послідовності дослідники завантажують їх у GenBank, надаючи іншим дослідникам доступ до інформації. Співпраця дозволяє дослідникам порівнювати нещодавно виявлену або невідому інформацію про послідовність зразків із величезним масивом даних послідовності, які вже існують.
Перегляньте анімацію про 454 секвенування, щоб поглибити розуміння цього методу.
Використання NAAT для діагностики C. difficile інфекції
Хав'єр, 80-річний пацієнт з історією серцевих захворювань, нещодавно повернувся додому з лікарні після проведення процедури ангіопластики для введення стента в серцеву артерію. Щоб мінімізувати можливість зараження, Хав'єру вводили внутрішньовенно антибіотики широкого спектру дії під час і незабаром після його процедури. Його відпустили через чотири дні після процедури, але через тиждень він почав відчувати легкі спазми в животі і водянисту діарею кілька разів на день. Він втратив апетит, сильно зневоднювався, розвинулася лихоманка. Він також помітив кров у своєму калі. Дружина Хав'єра подзвонила лікарю, який доручив їй негайно відвезти його до відділення швидкої допомоги.
Співробітники лікарні провели кілька тестів і виявили, що рівень креатиніну в нирках Хав'єра був підвищений порівняно з рівнем у його крові, що свідчить про те, що його нирки не функціонують належним чином. Симптоми Хав'єра припускали можливе зараження Clostridium difficile, бактерією, стійкою до багатьох антибіотиків. Лікарня зібрала та культивувала зразок стільця, щоб шукати вироблення токсинів A та B C. difficile, але результати повернулися негативними. Однак негативних результатів було недостатньо, щоб виключити інфекцію C. difficile, оскільки культивування C. difficile та виявлення його характерних токсинів можуть бути важкими, особливо в деяких типах зразків. Щоб бути безпечним, вони продовжили діагностичний тест на ампліфікацію нуклеїнових кислот (NAAT). В даний час NAATs є золотим стандартом клінічного діагноста для виявлення генетичного матеріалу збудника. У випадку Хав'єра QPCR використовувався для пошуку гена, що кодує C. difficile токсин B (TCdB). Коли аналіз qPCR повернувся позитивним, лікуючий лікар зробив висновок, що Хав'єр дійсно страждав інфекцією C. difficile і негайно призначив антибіотик ванкоміцин, який слід вводити внутрішньовенно. Антибіотик очистив інфекцію і Хав'єр зробив повне одужання.
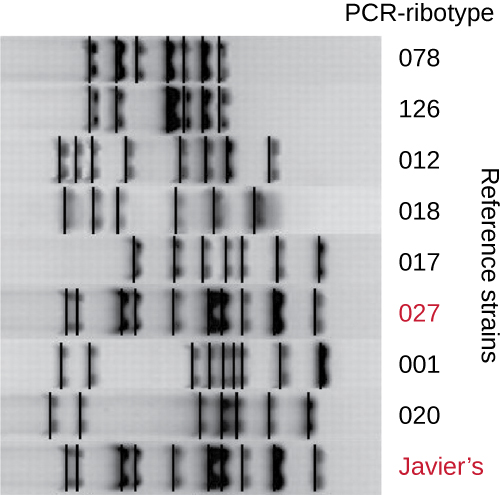
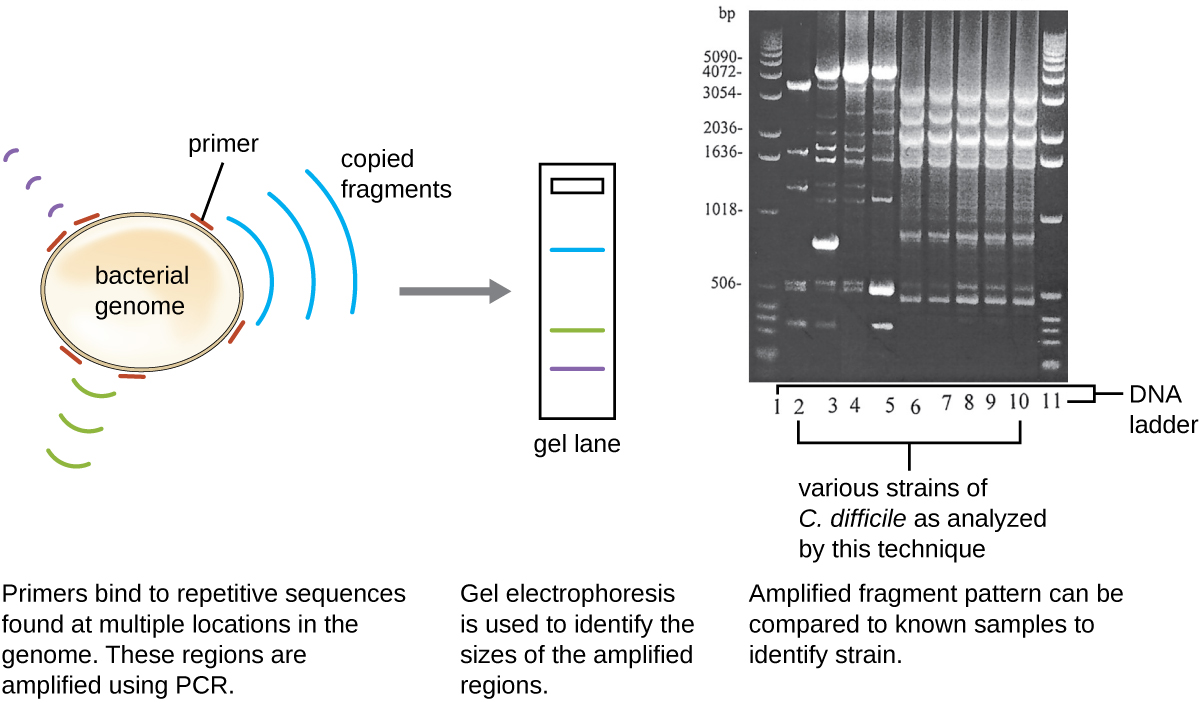
Оскільки інфекції C. difficile набули широкого поширення в громаді Хав'єра, його зразок був додатково проаналізований, щоб побачити, чи можна визначити специфічний штам C. difficile. Зразок калу Хав'єра піддавався риботипуванню та повторюваному ПЛР-аналізу на основі послідовності (REP-PCR). При риботипуванні коротка послідовність ДНК між генами 16S рРНК і 23S рРНК посилюється і піддається рестрикційному травленню (рис.\(\PageIndex{12}\)). Ця послідовність варіюється між штамами C. difficile, тому рестрикційні ферменти будуть скорочуватися в різних місцях. У реп-ПЛР для ПЛР використовували праймери ДНК, призначені для зв'язування з короткими послідовностями, які зазвичай повторюються в геномі C. difficile. Після обмеження травлення, агарозний гель електрофорез був проведений в обох типах аналізу для вивчення смуг шаблонів, що виникли в результаті кожної процедури (рис.\(\PageIndex{13}\)). Реп-ПЛР може бути використаний для подальшого підтипу різних риботипів, збільшуючи роздільну здатність для виявлення відмінностей між штамами. Встановлено, що риботип штаму, що заражає Хав'єра, є риботипом 27, штамом, відомим своєю підвищеною вірулентністю, резистентністю до антибіотиків та підвищеною поширеністю в США, Канаді, Японії та Європі. 1
Вправа\(\PageIndex{5}\)
- Чим відрізняються смугові візерунки між штамами C. difficile?
- Чому, на вашу думку, лабораторні тести не змогли виявити вироблення токсину безпосередньо?
Вправа\(\PageIndex{6}\)
- Як ПЛР схожа на природний процес реплікації ДНК в клітині? Чим вона відрізняється?
- Порівняйте RT-PCR та qPCR з точки зору їх відповідних цілей.
- Як визначається ідентичність кожного нуклеотиду в послідовності у послідовності у послідовності?
Ключові поняття та резюме
- Пошук цікавить гена всередині зразка вимагає використання одноцепочечного зонда ДНК, поміченого молекулярним маяком (як правило, радіоактивністю або флуоресценцією), який може гібридизувати з додатковою одноцепочечной нуклеїновою кислотою у зразку.
- Електрофорез агарозного гелю дозволяє розділити молекули ДНК на основі розміру.
- Аналіз поліморфізму довжини рестрикційного фрагмента (RFLP) дозволяє візуалізувати методом агарозного гелю електрофорезу різних варіантів послідовності ДНК, спричинених відмінностями в рестрикційних ділянках.
- Аналіз Південного блота дозволяє дослідникам знайти певну послідовність ДНК у зразку, тоді як аналіз північного блота дозволяє дослідникам виявити певну послідовність мРНК, виражену у зразку.
- Технологія мікромасиву - це техніка гібридизації нуклеїнових кислот, яка дозволяє досліджувати відразу багато тисяч генів, щоб знайти відмінності в генах або схемах експресії генів між двома зразками геномної ДНК або кДНК,
- Електрофорез поліакриламідного гелю (PAGE) дозволяє розділити білки за розміром, особливо якщо нативні білкові заряди маскуються шляхом попередньої обробки SDS.
- Полімеразна ланцюгова реакція дозволяє швидко ампліфікувати певну послідовність ДНК. Варіації ПЛР можуть бути використані для виявлення експресії мРНК (ПЛР зі зворотною транскриптазою) або для кількісної оцінки певної послідовності в вихідному зразку (ПЛР в реальному часі).
- Хоча розвиток секвенування ДНК Сангера був революційним, досягнення в секвенуванні наступного покоління дозволяють швидко і недорого секвенувати геноми багатьох організмів, прискорюючи обсяг нових даних послідовності.
Виноски
- 1 Патріція Спігалья, Фабріціо Барбанті, Анна Марія Діонісі та Паола Мастрантоніо. «Ізоляти Clostridium difficile, стійкі до фторхінолонів в Італії: поява ПЛР-риботипу 018». Журнал клінічної мікробіології 48 № 8 (2010): 2892—2896.
