12: Енергетика та окислювально-відновні реакції
- Page ID
- 6586
Метаболізм відноситься до суми хімічних реакцій, які відбуваються всередині клітини. Катаболізм - це розпад органічних і неорганічних молекул, що використовуються для вивільнення енергії та отримання молекул, які можуть бути використані для інших реакцій. Анаболізм - це синтез більш складних молекул з більш простих органічних і неорганічних молекул, що вимагає енергії.
Енергетика
Хоча деяка енергія втрачається як тепло в хімічних реакціях, вимір інтересу для клітин - це кількість вільної енергії (G) або енергія, доступна для роботи. Клітини виконують три різних типи роботи: хімічну роботу (наприклад, анаболізм), транспортну роботу (наприклад, поглинання поживних речовин) та механічну роботу (наприклад, обертання джгутика).
Зміна вільної енергії зазвичай позначається як ΔG° ', що вказує на зміну вільної енергії в стандартних умовах pH 7, 25oC, 1 атмосферного тиску (також відомий як стандартна зміна вільної енергії). Реакція, яка генерує позитивний ΔG°', вказує на те, що реакція вимагає енергії і носить ендергонічний характер. Реакція, яка генерує негативний ΔG°', вказує на те, що реакція вивільняє енергію і носить ексергонічний характер. Реакції, які є ексергонічною енергією вивільнення, яка може бути збережена клітиною, щоб зробити роботу.
Аденозинтрифосфат (АТФ)
Аденозинтрифосфат або АТФ - це високоенергетична молекула, яка використовується всіма клітинами для енергетичної валюти, частково тому, що вона легко жертвує фосфорильну групу іншим молекулам. Ексергонічна реакція вивільнить енергію, керуючи синтезом АТФ від додавання молекули фосфату (ортофосфату або P i) до аденозиндифосфату або АДФ. Ендергонічна реакція, яка вимагає енергії, з'єднається з гідролізом АТФ до АДП+P i, використовуючи виділену енергію для приводу реакції.
Ферменти
Для того щоб протікала хімічна реакція, хімічні зв'язки повинні бути розірвані. Енергія, необхідна для розриву зв'язків, називається енергією активації. Кількість енергії активації, необхідної клітині, може бути знижена за допомогою каталізатора, речовин, які допомагають реакції протікати, не змінюючи себе реакцією. Клітини використовують білкові каталізатори, відомі як ферменти.
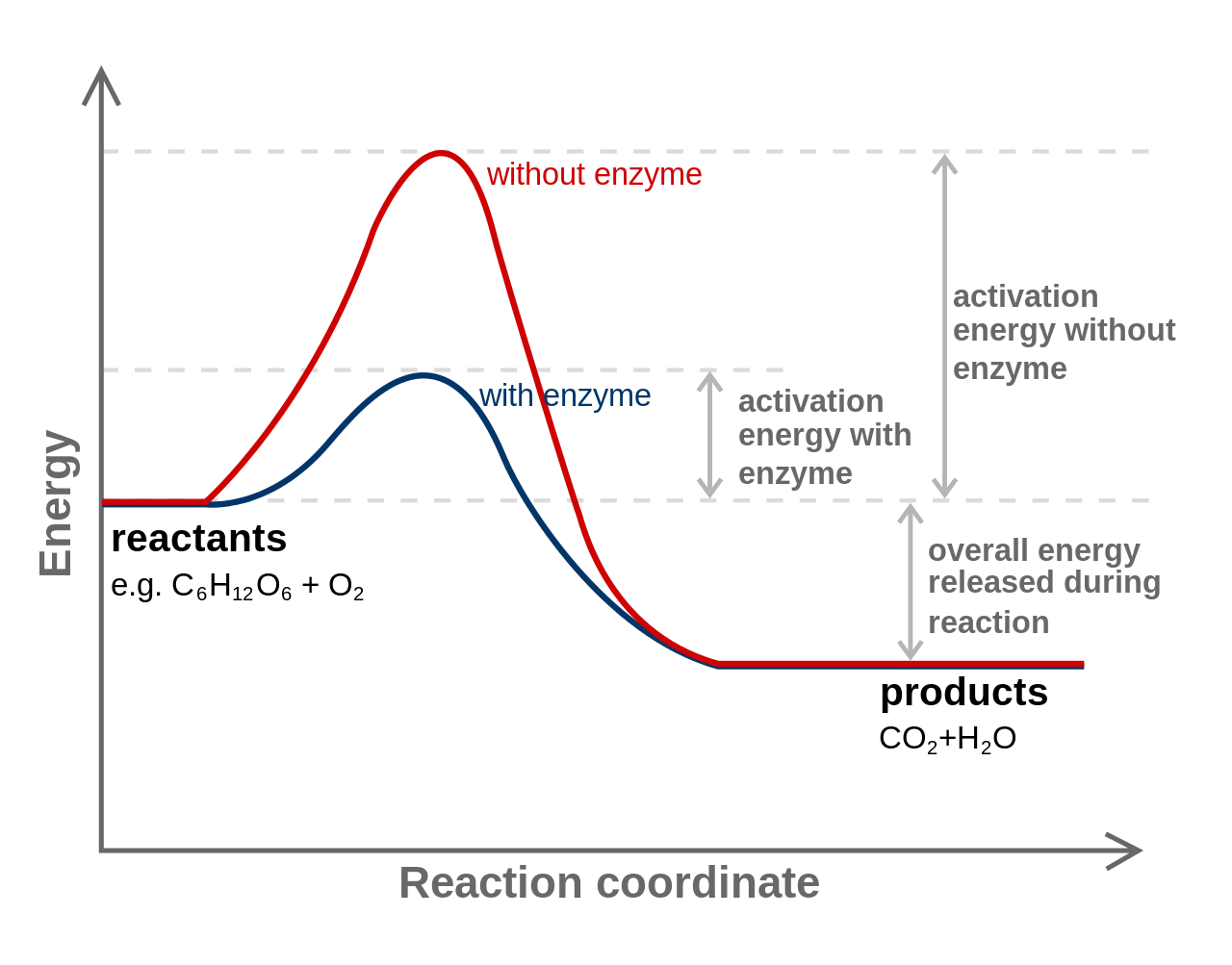
Енергія активації. За Спочатку завантажено Джеррі Багряний Манн, векторизований Тутмозом, виправлено Fvasconcellos (uk: Image:Activation2.png) [GFDL або CC-BY-SA-3.0], через Wikimedia Commons
Окислювально-відновні реакції
Клітини зберігають енергію у вигляді АТФ, зв'язуючи її синтез з вивільненням енергії за допомогою окислювально-відновних (окислювально-відновних) реакцій, де електрони передаються від донора електронів до акцептора електронів. Окислення молекули відноситься до втрати її електронів, тоді як зменшення молекули відноситься до її посилення електронів. Органічні хіміки часто посилаються на процес мнемонічної OIL RIG: Окислення - це втрата, зменшення - це посилення. Окислювана молекула діє як донор електронів, тоді як відновлювана молекула діє як акцептор електронів. Оскільки електрони представляють енергію, речовина з багатьма електронами для пожертвування може розглядатися як багата енергією.
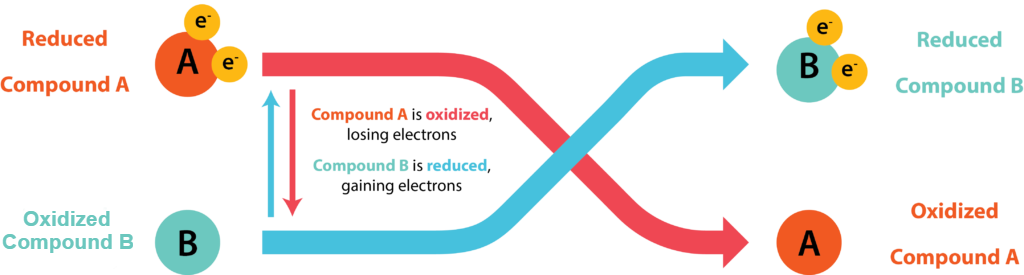
Поєднана окислювально-відновна пара
Електрони не існують вільно в розчині, вони повинні бути з'єднані з атомами або молекулами. Кожна окислювально-відновна реакція складається з двох половин реакції, де одна речовина дарує електрони і, таким чином, стає окисленим продуктом, тоді як інша речовина приймає електрони і, таким чином, стає відновленим продуктом. Кон'югатна окислювально-відновна пара відноситься до акцептора і донора половинної реакції.
Речовина може бути як донором електронів, так і акцептором електронів, залежним від інших речовин в реакції. Окислювально-відновна пара являє собою обидві форми речовини в половині реакції, при цьому окислена форма (акцептор електронів) завжди розміщена зліва, а відновлена форма (донор електронів) праворуч. Прикладом може бути ½ O2/H2O, де H2O може служити донором електронів, а O2 може служити акцептором електронів. Кожній половині реакції дається стандартний потенціал відновлення (E'0) в вольтах або мілівольтах, що є вимірюванням тенденції донора в реакції відмови від електронів. Речовина з більшою схильністю до здачі електронів в відновленому вигляді має більш негативний E'0, тоді як речовина зі слабкою тенденцією до здачі електронів в зменшеному вигляді має менш негативний або навіть позитивний E'0. Речовина з негативним E'0 робить дуже хороший донор електронів, в відновленому вигляді.
Окислювально-відновна вежа
Інформація щодо стандартних потенціалів зменшення для різних окислювально-відновних пар відображається у вигляді окислювально-відновної вежі, яка перераховує пари у вертикальній формі на основі їх E'0. Окислювально-відновлювальні пари з найбільш негативним E'0 у списку вгорі, тоді як ті, у кого найбільш позитивний E'0, перераховані внизу. Редукована речовина з найбільшою тенденцією до здачі електронів було б знайдено у верхній частині вежі праворуч, тоді як окислена речовина з найбільшою тенденцією приймати електрони буде знайдено внизу вежі зліва. Окислювально-відновні пари посередині можуть служити або донорами електронів, або акцепторами, залежно від того, з якою речовиною вони співпрацюють для реакції. Різниця між відновними потенціалами донора та акцептора (ΔE'0) вимірюється як акцептор E'0 мінус донор E'0. Чим більше значення для ΔE'0, тим більше потенційна енергія для клітини. Більші значення виводяться, коли між донором і акцептором є найбільша відстань (або більше падіння вниз по вежі).
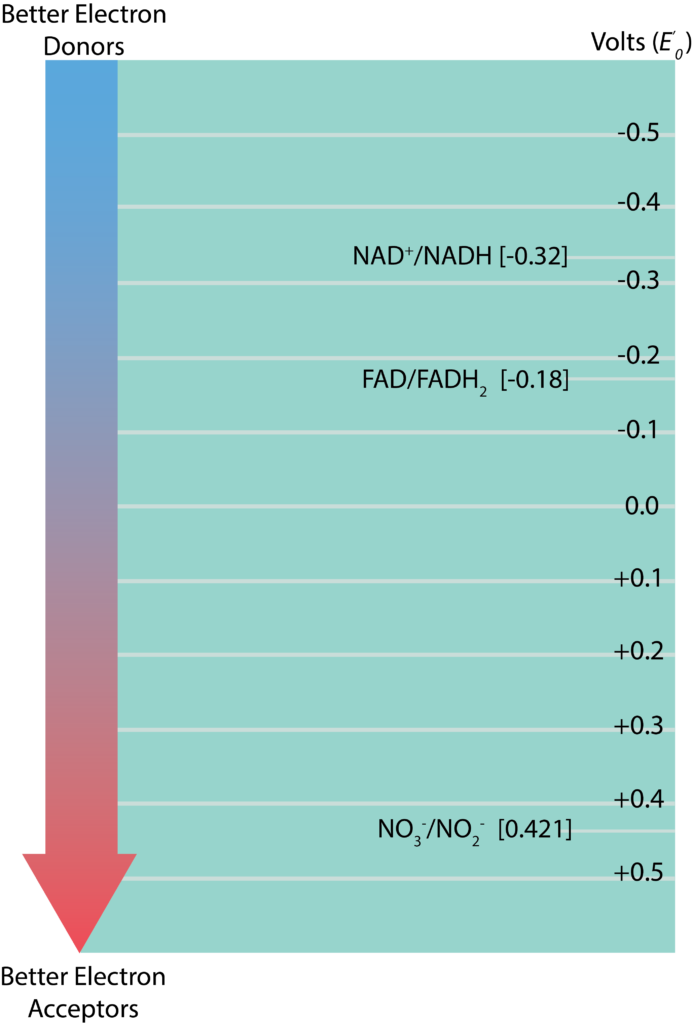
Електронна вежа.
Хоча ΔE'0 пропорційний ΔG° ', кількість електронів, які речовина повинна пожертвувати, теж важлива. Фактична формула така:
\[\Delta \mathrm{G}^{\circ\prime} = -nF \cdot \Delta {\mathrm{E}^{\prime}}_{0}\]
де n - кількість електронів, що переносяться, а F - постійна Фарадея (23 062 кал/моль-вольт, 96, 480 Дж/моль-вольт).
Електронні носії
Перенесення електронів від донора до акцептора не відбувається безпосередньо, оскільки хімічно несхожі донори електронів і акцептори ніколи не можуть взаємодіяти один з одним. Натомість багато клітинних проміжних продуктів беруть участь у процесі, з можливістю захоплення енергії, що відбувається по шляху. Ці проміжні продукти називаються електронними носіями, і вони йдуть туди-сюди між відновленою формою (коли вони несуть електрон) та окисленою формою (після того, як вони пройшли електрон), не споживаючись у самій реакції.
Для того, щоб реакція була енергетично сприятливою для клітини, носії повинні бути розташовані в порядку їх стандартного відновного потенціалу (тобто спускаючись по окислювально-відновній вежі), при цьому електрон передається від носія з найбільш негативним E'0 до носія з менш негативним E'0. Важливо відзначити, що деякі носії приймають як електрони, так і протони, тоді як інші носії приймають тільки електрони. Цей факт набуде вирішального значення пізніше, при обговоренні того, як генерується енергія.
Хоча існує багато різних носіїв електронів, деякі унікальні для конкретних організмів або груп організмів, давайте розглянемо деякі з найбільш поширених з них:
- Нікотинамід аденіндинуклеотид (NAD+/NADH) — кофермент, який переносить як електрони (е-), так і протони (Н+), по два кожного. Тісно спорідненою молекулою є нікотинамід аденіндинуклеотидфосфат (NADP+/ NADPH), який приймає 2 електрони і 1 протон.
- Флавін аденін-динуклеотид (FAD/FADH) і флавін мононуклеотид (FMN/FMNH) - несуть 2 електрони і 2 протони кожен. Білки з цими молекулами називаються флавопротеїнами.
- Коензим Q (CoQ) /убихінон — несе 2 електрона і 2 протони.
- Цитохроми - використовувати атоми заліза як частину групи гемів для перенесення 1 електрона за раз.
- Білки залізо-сірки (Fe-S), такі як ферредоксин - використовують атоми заліза, які не входять до групи гемів, для перенесення 1 електрона за раз.
Ланцюг транспорту електронів
Процес починається з початкового донора електронів, речовини ззовні клітини, і закінчується кінцевим акцептором електронів, іншою речовиною ззовні клітини. В середині електрони передаються від носія до носія, оскільки електрони працюють своїм шляхом вниз по електронній вежі. Для того, щоб зробити процес більш ефективним, більшість носіїв електронів вбудовані в мембрану клітини, в тому порядку, що вони розташовані на окислювально-відновній вежі. Ці ланцюги транспорту електронів знаходяться всередині клітинної мембрани бактерій та археї, а також всередині мітохондріальної мембрани еукаріотів.
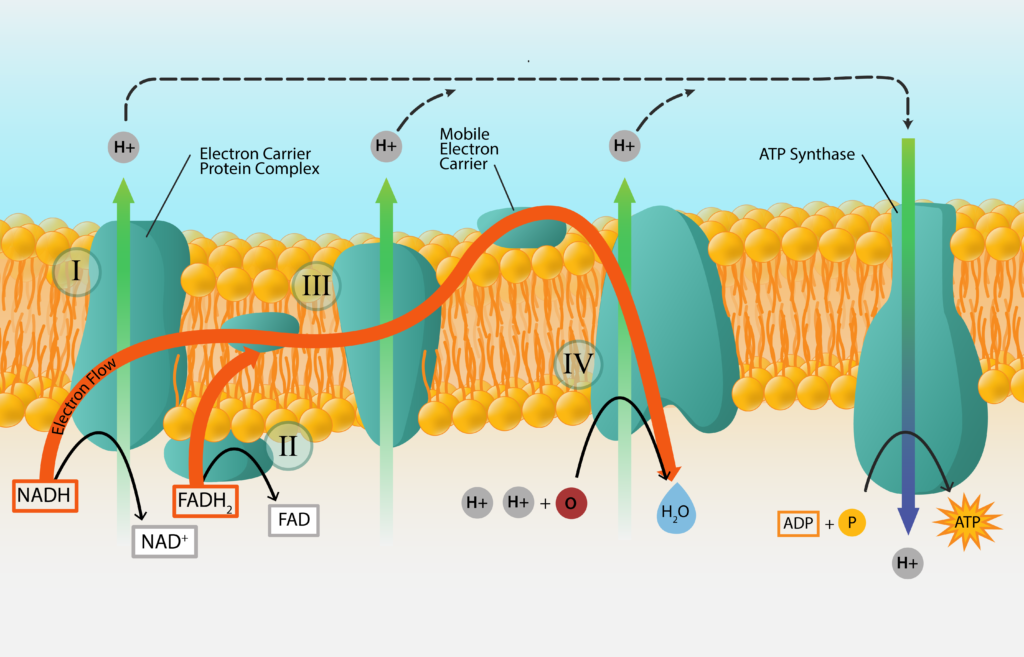
Ланцюг транспорту електронів.
Ключові слова
метаболізм, катаболізм, анаболізм, вільна енергія (G), хімічна робота, транспортна робота, механічна робота, ΔG°', стандартна зміна вільної енергії, ексергонічний, ендергонічний, аденозинтрифосфат (АТФ), ортофосфат (P i), енергія активації, каталізатор, фермент, окислювально-відновна (окислювально-відновна) реакція, донор електронів, електронний акцептор, OIL RIG, кон'югатна окислювально-відновна пара, окислювально-відновна пара, стандартний потенціал відновлення (E'0), окислювально-відновна вежа, ΔE'0, носії електронів, нікотинамід аденін-динуклеотид (NADP+/ NADPH), флавін аденін-динуклеотид (FAD/NADPH) FADH), флавін мононуклеотид (FMN/ FMNH), коензим Q (CoQ) /убихінон, цитохром, білки залізо-сірка (Fe-S), ферредоксин, ланцюг транспорту електронів (ETC).
Навчальні питання
- Як визначаються метаболізм, катаболізм та анаболізм?
- Які 3 основні види робіт виконуються клітинами? Який приклад кожного типу?
- Що таке вільна енергія? Що таке стандартна вільна енергія?
- Які характеристики ендергонічної і ексергонічної реакції? Як клітини можуть зберегти енергію, що виділяється реакціями?
- Яка роль АТФ в клітині і чому він є хорошим з'єднанням для цієї ролі?
- Що таке ферменти? Яку роль відіграють ферменти в енергозбереженні?
- Що таке окислення і відновлення? Що являє собою стандартний потенціал відновлення, наприклад 2H+/H2 = -0,42V? Вкажіть, що являє собою кожен член в цьому рівнянні. У окисно-відновних парах з більш негативним потенціалом O-R відновлена форма швидше є електроном ____________________ і має __________________________ потенційну енергію. Що таке сполучена окислювально-відновна пара?
- Що таке електронна вежа і як це поняття допомагає пояснити енергетичний обмін в клітині?
- Що таке ΔG0'? Що він являє собою і як розраховується?
- Що таке носій електронів, яку роль вони відіграють, які найпоширеніші носії електронів в клітці і чому їх потрібно постійно переробляти?
- Що таке ланцюг транспорту електронів і як вона функціонує для збереження енергії для клітини?