3.2: Ферменти
- Page ID
- 6541
Енергетика та каталізатори
У біологічних системах енергія приблизно визначається як здатність виконувати роботу. Молекули утримуються електронами. Розрив і побудова цих зв'язків вимагає введення енергії. Енергія, необхідна для ініціювання таких реакцій, називається енергією активації (Е А). Іноді необхідна енергія для ініціювання реакції настільки велика, що вона значно обмежує ймовірність того, що реакція коли-небудь відбувається. Каталізатори - це хімічні речовини, які беруть участь в полегшенні реакцій за рахунок зниження енергії активації. Якщо енергія активації знижується, ймовірність виникнення реакції значно підвищується. У клітині каталізатори часто складаються з білків і називаються ферментами.

Реакційна координата екзотермічної реакції з ферментом і без нього. Фермент зменшив Е А, щоб полегшити ймовірність того, що реакція відбудеться. Ця катаболічна реакція руйнує складні речі вниз, тим самим збільшуючи ентропію і вивільняючи енергію в систему.
Ферменти
Реагенти в ферментативних реакціях називаються субстратами. Вони мають недосконале прилягання до зв'язуючого домену ферменту, званого активною ділянкою. Зв'язування субстрату з цим активним ділянкою викликає зміну форми білка, який координує субстрат в перехідний стан, що зменшить кількість Е А, необхідне для того, щоб реакція пішла до завершення. Індукований прилягання білка також допомагає в координації інших кофакторів або коферментів, які допоможуть в реакції.
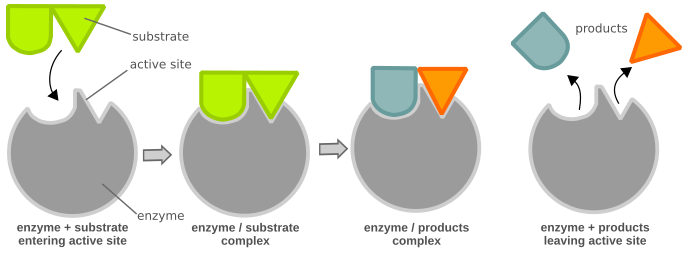
Індукована модель придатності ферментів і субстратів. Активна ділянка білка є недосконалою відповідністю для субстрату. Міжмолекулярні взаємодії між ферментом і субстратом індукують нове прилягання, що полегшує формування перехідного стану і призводить до каталізу реакції.
Реакція слідує за стандартним потоком, де фермент (E) та субстрат (S) взаємодіють, утворюючи комплекс фермент-субстрат (ES). Потім ES дисоціює на фермент і результуючий продукт (P).
Е + С ⇒ ЕС ⇒ Е + Р
Індукований прилягання ферментно-субстратного комплексу координує перехідний стан для полегшення реакції. Цей індукований припадок відбувається за допомогою нековалентних засобів, які призводять до перетягування молекул (застосування енергії), тоді як молекули коаксируются в реакції.
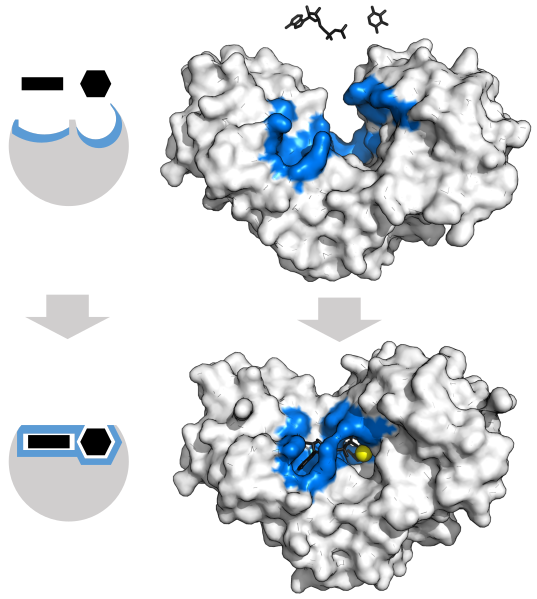
Фермент гексокінази взаємодіє з АТФ і гексозою. Ці взаємодії трохи змінюють структуру ферменту (індукована посадка). Це витягування ферменту та субстратів допомагає каталізувати реакцію шляхом координації молекул, іноді за допомогою кофакторів та коферментів. Жовта сфера являє собою кофактор Mg 2+.
Коензими можуть бути ковалентно пов'язані з амінокислотними бічними ланцюгами ферменту, а також називаються протезними групами. Хоча протезні групи мають органічну природу, вони також можуть включати координацію іонів металів, як група гемів, яка зв'язується з залізом. Ці протезні групи підсилюють репертуар амінокислот, щоб забезпечити додаткове функціонування всього білка. Ранні коферменти були описані як життєво важливі для нормального функціонування і характеризувалися як органічні молекули з амінними групами. Через цей збіг їх називали вітамінами (для життєво важливих амінів), хоча не всі вітаміни мають групи амінів. Іони мікрометалів, які працюють з цими групами, також необхідні і представляють мінерали на харчових продуктах.
