2.9: Білки
- Page ID
- 6570
Білки - це полімери амінокислот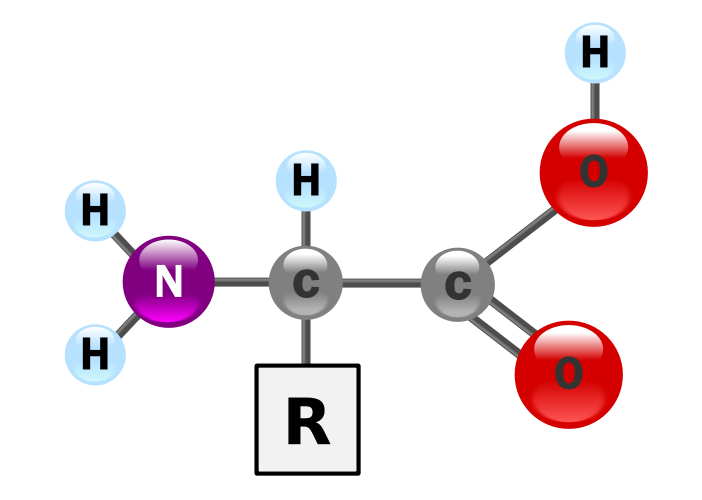
Білки забезпечують значну частину структурної та функціональної здатності клітин. Білки складаються з мономерів, званих амінокислотами. Амінокислоти - це вуглеводні, які мають аміногрупу (-NH 2) і кислу карбоксильну групу (-СООН). Група R являє собою вуглеводневий ланцюг з модифікацією, яка змінює властивості амінокислоти. Для побудови білків використовуються 20 універсальних амінокислот. Зміна функціональних груп по амінокислотному ланцюжку породжує функціональне різноманіття білків.

20 амінокислот і їх властивості. 21-а амінокислота на цій таблиці являє собою неповсюдно знайдений селеноцистеїн.
Мономери зв'язуються між собою через реакцію синтезу зневоднення між сусідніми амінокарбоксильними групами, щоб отримати пептидний зв'язок.
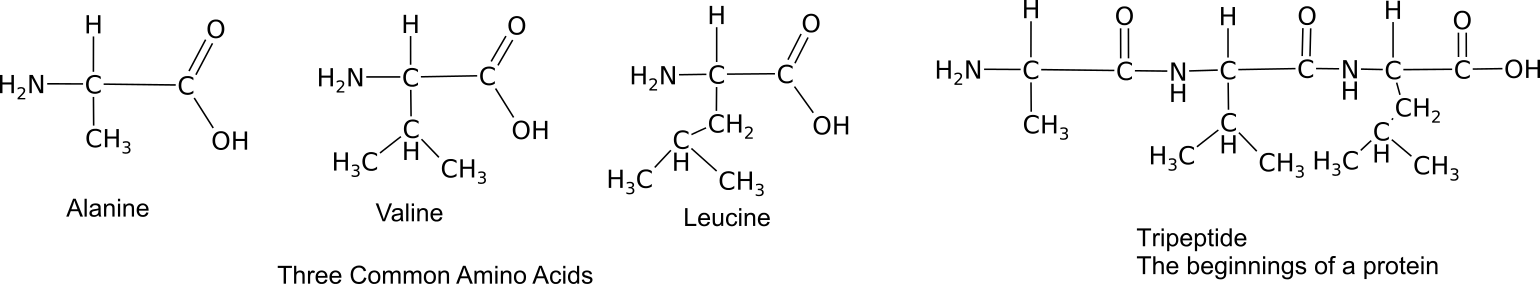
Три амінокислоти, пов'язані в трипептид.
Як амінокислоти взаємодіють один з одним і навколишнім середовищем
Використовуйте наступне моделювання, щоб перевірити, як поліпептидний ланцюг зі складкою на основі типу розчину, в якому він знаходиться, і складу амінокислот.
- Моделювання складання білка (Консорціум CC BY 4.0 Concord)
Рівні структури

- Первинна структура (1°): Послідовність амінокислот, зчитуваних з амінокислоти або N-кінцевого кінця молекули до карбоксильного або C-кінцевого кінця
- Тир-Цис-Арг-Пхе-Лей-Валь-...
- Вторинна структура (2°): місцеві тривимірні структури, що утворюються від взаємодій амінокислот, таких як водневий зв'язок
- Alpha Helix — котушки, що виникають з H-зв'язків між N-H та C=O групами вздовж хребта білка

Вид збоку α-спіралі, що ілюструє Н-зв'язки в пурпуровому кольорі між карбоксильним киснем (червоний) та амінним азотом (синій)

Вид на α-спіраль зверху вниз

Вид збоку стрічкової діаграми α-спіралей, що проходять мембрану.
- Бета-листи - латерально з'єднані нитки або листи амінокислот, що відбуваються з Н-зв'язків між N-H і C = O групами вздовж хребта білка
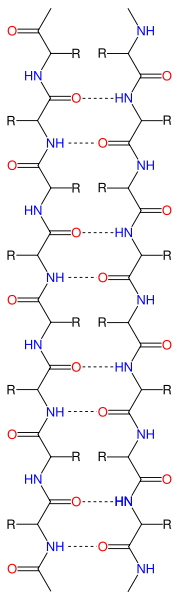


Стрічкова діаграма β-аркушів
- Третинна структура (3°): загальна 3-D структура пептидного ланцюга
- Четвертинна структура (4°): мультимерна білкова структура з складання декількох пептидних субодиниць
Виявлення білка (активність)
Теорія виявлення білка:
Білки можна виявити за допомогою застосування тесту Біурета. Зокрема, пептидні зв'язки (C-N зв'язки) в білках комплексу з Cu 2+ в реагенті Biuret і виробляють фіолетовий колір. Cu 2+ повинен складатися з чотирма до шести пептидних зв'язків для отримання кольору; отже, вільні амінокислоти не реагують позитивно. Довгі поліпептиди (білки) мають багато пептидних зв'язків і виробляють позитивну реакцію на реагент. Реагент Біурет являє собою лужний розчин 1% CuSo 4, мідного купоросу. Фіолетовий колір є позитивним тестом на наявність білка, а інтенсивність кольору пропорційна кількості пептидних зв'язків в розчині.


Тест Біурета
- Вивчіть таблицю нижче. Вкажіть, чи є зразок негативним контрольним, позитивним або експериментальним.
- Передбачте зміну кольору розчину.
- Сформулюйте гіпотезу про складові експериментів.
- Отримайте 6 пробірок і пронумеруйте їх 1-6.
- Додайте матеріали, зазначені в таблиці.
- Додайте 3 краплі реагенту Biuret (1,0% CuSO 4 з NaOH) в кожну пробірку і перемішайте.
- Запишіть колір вмісту труб у табл.
Висновки про зразки сечі
Виходячи з результатів тесту Бенедикта та тесту Біурета, чи можемо ми зробити якісь висновки?