2,5: рН
- Page ID
- 6577
рН
Кислоти та основи
Будь-яку сполуку, яка додає в розчин іони Н + (вільний протон), ми можемо назвати кислотою. Поряд з цим ми очікуємо, що будь-яка сполука, яка зменшить концентрацію вільного Н + розчину в якості основи. рН - потужність Н + розчину. Визначимо цю потужність як молярну концентрацію Н + в розчині. Ця концентрація незмінно закінчується відносно невеликим числом (хоча великим в абсолютних числах) і виражається як десяткове число. Оскільки діапазон концентрацій настільки великий, ми виражаємо ці числа як логарифмічні числа, щоб уникнути запису багатьох 0 після десяткового і полегшити спілкування концентрації. Оскільки ці числа настільки (відносно) малі, ми використовуємо негативний логарифм для опису цієї концентрації.
Математично визначені,
Шкала рН коливається так, що все, що нижче рН 7, є кислим, а все, що вище рН 7, є лужним. Так менша кількість є більш кислим. Але хіба ми не просто стверджували, що щось кислотне містить більше іонів H +? Пам'ятайте, оскільки ми маємо справу з негативним логарифмом, це означає, що концентрація вище.
Логарифмічні шкали
Якщо у нас є кількість, яка дорівнює 10 2, ми знаємо, що перекладається на 100. Так само, як якщо у нас є кількість 10 4, ми знаємо, що перекладається на 10000. Так само, як стає незручно тримати писати всі ці 0, це дійсно недоцільно писати багато 0 після десяткової. Про це дуже важко говорити теж! Таким чином, ми також будемо виражати числа, як 0,0001 як 10 -4. Логарифм - це зворотна функція показника. Тому:
Отже, як ми визначаємо розчин, який є pH 2? Ну, ми вже вирішили, що цей розчин нижче рН 7 - робить його кислотою. Але що це означає з точки зору концентрації іонів Н +?
Давайте розберемо це алгебраїчно:
Давайте перенесемо (-) на іншу сторону
Тепер повернемо Log → base 10
Підключіть рН → молярна концентрація [H +]
Як ми зараз бачимо, розчин pH 2 є кислим, оскільки молярна концентрація [H +] становить 10 -2 моль/л або 0,01 М
Дисоціація іонів: Це число мало!
Це не маленька кількість. Пам'ятайте, що моль - це 6.022 Х 10 23. Це дуже велика кількість! Подумайте про це! Розчин рН 4 є кислим, але якщо ми включаємо формулу, то розуміємо, що це дорівнює 0,0001M H + — менше рН 2 при 0,01 М!
Але давайте порівняємо його з вмістом [H +] H 2 O. Тепер я буду звучати божевільніше! Воду можна вважати, що знаходиться в рівновазі, де деякі молекули іонізуючі та деіонізуючі. Ми можемо висловити це двома способами:
- Н 2 О Н + ОН —
- 2Н 2 О Н 3 О + ОН —
Так в будь-якій заданій точці літр Н 2 О при нейтральному pH (7) має 10 -7 моль іонів Н +. До речі, він також має 10 -7 молів OH - в розчині. Другий вираз вказує на утворення іона гідронію (H 3 O +) замість вільного протона в розчині. Тож щось, що є pH 2, є сильнішою кислотою, ніж рН 4, чи не так? Ні. Це якраз вказує на кількість вільних протонів у розчині. Він більш кислий, але кислотна сила означає щось інше. Коли ми говоримо про сильних кислотах, це означає, що швидше за все пожертвувати протон в розчин, оскільки він швидше іонізується. Давайте розглянемо наступне:
- HA H + (aq) + A — (aq) Де HA - кислота, що дисоціює в розчині
Якщо ця дисоціація дуже висока, то ми говоримо, що це сильна кислота. Аналогічно, така сполука, як NaOH, легко дисоціює повністю в розчині і забезпечує OH - іони, які можуть легко видалити H + з розчину - міцну основу! Ми говоримо про дисоціацію з точки зору показників, і ми виражаємо це як константа дисоціації кислоти, K a. Це обчислюється за допомогою концентрацій [H +] (протон), [A —] (кон'югатна основа) та [HA] (недисоційована) при рівновазі:
Так само, як і порядки, які ми маємо при обговоренні рН, швидкості дисоціації зручніше повідомляти за логарифмічною шкалою.
Подумайте про це так, якщо концентрація дисоційованих іонів дуже висока, чисельник в швидкості дуже високий → К а великий. Іншими словами, при рівновазі реакція дисоціації виглядає більш односпрямованою, ніж двонаправленої, оскільки з'єднання легко іонізується:
- ГА → Н + (aq) + А — (aq)
У цій шкалі ми називаємо що-небудь з pK a < -2 як сильну кислоту, оскільки вона буде легко дисоціювати в розчині. Ця форма константи дисоціації надзвичайно корисна при оцінці рН буферизованих розчинів і для знаходження рівноважного рН кислотно-лужної реакції (між протоном і сполученим підставою). Ми можемо оцінити рН, використовуючи рівняння Гендерсона-Хассельбальха:
Буферні рішення
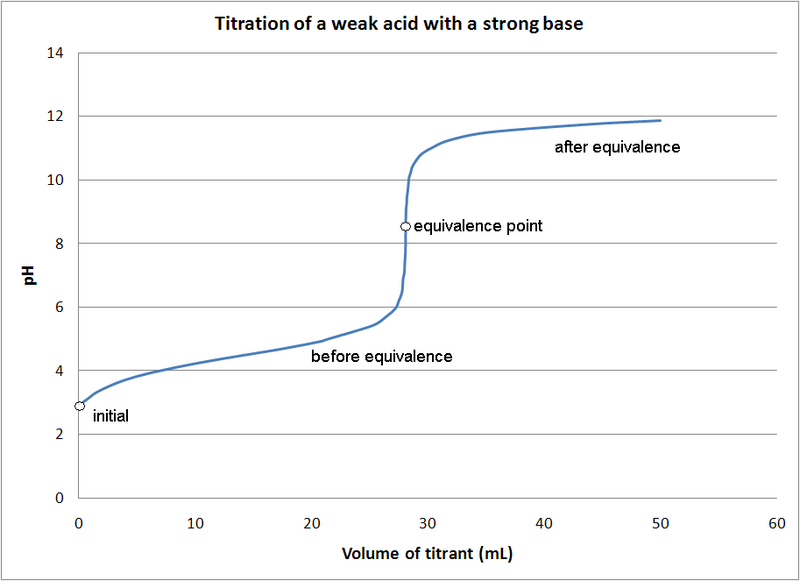
Буфер - це те, що чинить опір змінам. Буферний розчин - це той, який складається зі слабкої кислоти або слабкої основи, яка буде контролювати рН розчину. Уявіть собі буфер, який буде резервуаром наявних іонів H+ або OH-. Якщо буферний розчин має рН 2, додавання до нього основного розчину не призведе до різкої зміни рН, оскільки резервуар H+ буде безперервно нейтралізувати основу. Зрештою, це сховище або резервуар H+ буде виснажений. Коли це станеться, рН раптово зміниться. Діапазон, в якому додається кислота або основа без значної зміни рН, називається буферной зоною або буферною здатністю. Коли цей магазин H+ або буферної ємності витрачається, ми досягли точки еквівалентності, яка описує точку, в якій основа повністю нейтралізувала слабку кислоту.

Титрування кислоти основою Розчин має хорошу буферну здатність між рН 3 і рН 5
моделювання рН

Натисніть тут, щоб запустити моделювання на шкалах рН
Скористайтеся таблицею нижче, щоб вказати, чи є елемент кислотою чи основою, і який ви прогнозуєте рН. Ми можемо визначити їх у класі за допомогою вимірювання.
|
Рішення |
Кислота або основа |
Прогнозований рН |
Фактичний рН |
|
Кава |
|||
|
Кола |
|||
|
Дистильована |
|||
|
Миючий засіб |
|||
|
Відбілювач |
|||
|
Яблучний сік |
|||
| антацидний розчин |