6.2: Реальні гази
- Page ID
- 76260
Наскільки добре справжні гази відповідають рівнянню стану для ідеального газу? Відповідь досить добре в великому діапазоні P, V і T, за умови, що температура значно вище критичної температури. Нам доведеться незабаром побачити, що мається на увазі під критичною температурою; на даний момент ми скажемо, що ідеальне рівняння газу дотримується досить добре за умови, що температура значно вище температури, при якій вона може бути зріджена, просто стискаючи її. Повітря кімнатної температури цілком добре підпорядковується закону. Гази в зоряних атмосферах також добре підкоряються закону, тому що там немає ніякої небезпеки розрідження газу. (Однак у ядрах зірок, де щільності дуже великі, гази підкоряються зовсім іншому рівнянню стану.)
Однією з мір того, наскільки добре закон підкоряється реальним газам, є вимірювання P, V і T, і подивитися, наскільки\( \frac{PV}{RT}\) близький до 1. Величина\( \frac{RT}{PV}\) відома як коефіцієнт стиснення, і часто дається символ Z. Для більшості реальних газів при дуже високих тисках (кілька сотень атмосфер) встановлено, що Z скоріше більше 1. У міру зниження тиску Z стає нижче, а потім, на жаль, воно переростає і виявляється трохи менше 1. Потім при ще більш низьких тисках Z знову піднімається. Точна форма кривої Z: P відрізняється від газу до газу, як і тиск, при якому Z є мінімальним. І все ж для всіх газів, як тиск наближається до нуля, ПВ/Т наближається до R точно. З цієї причини R іноді називають універсальною газовою постійною, а також ідеальною газовою постійною. У межі дуже низького тиску всі гази поводяться дуже близько до поведінки ідеального газу. У розділі 6.3 ми детальніше розглянемо, як коефіцієнт стиснення змінюється залежно від тиску.
Ще один спосіб подивитися на те, наскільки тісно реальні гази підкоряються ідеальному рівнянню газу, - це побудувати P проти V для ряду різних температур. Тобто малюємо набір ізотерм. Для ідеального газу ці ізотерми, PV = постійні, є прямокутними гіперболами. Так вони для справжніх газів при високих температурах. При більш низьких температурах відзначаються відступи від ідеального рівняння газу. Типові ізотерми намальовані на малюнку VI.1. На жаль, мої обмежені навички з цим пекельним комп'ютером переді мною дозволяють мені лише грубо накидати ці ізотерми вручну.
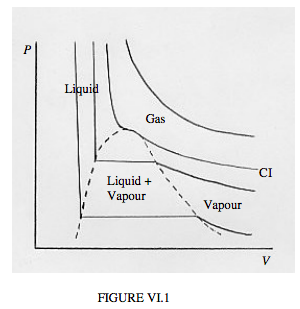
У площині PV малюнка VI.1 ви побачите кілька областей, позначених «газ», «рідина», «пар», «рідина+пара». Ви можете стежити за поведінкою при заданій температурі, починаючи з правого кінця кожної ізотерми, і поступово рухаючись вліво — тобто збільшувати тиск і зменшувати гучність. Найгарячіша ізотерма майже гіперболоїдна. Нічого особливого не відбувається поза зменшенням обсягу, коли тиск збільшується, згідно із законом Бойла. При трохи більш низьких температурах в ізотермі розвивається злам, а при критичній температурі злом розвивається локальна горизонтальна точка перегину. Ізотерма для критичної температури - критична ізотерма, позначена CI на ескізі. Досі нічого особливого не відбувається, крім зменшення V, оскільки P збільшується, хоча і не зараз відповідно до закону Бойла.
Для температур нижче критичної температури ми називаємо газ парою. У міру зменшення гучності тиск поступово збільшується, поки ви не досягнете пунктирної кривої. У цей момент частина пари розріджується, і, як ви продовжуєте зменшувати обсяг, все більше і більше парів розріджується, тиск залишається постійним, поки це робить. Це горизонтальна частина ізотерми. У цій області (тобто окресленої пунктирною кривою) ми маємо рідину та пару в рівновазі. Біля правого кінця горизонтальної частини є лише невелика кількість рідини; на лівому кінці велика частина речовини є рідкою, при цьому залишається лише невелика кількість пари.
Після того, як вона вся рідка, подальше підвищення тиску ледь зменшує обсяг, тому що рідина навряд чи взагалі стискається. Ізотерма тоді майже вертикальна.
Температура критичної ізотерми є критичною температурою. Тиск і молярний об'єм в горизонтальній точці перегину критичної ізотерми є критичним тиском і критичним молярним об'ємом. Горизонтальна точка перегину є критичною точкою.
