8.11: Використання символів атомного терміна для інтерпретації атомних спектрів
- Page ID
- 26747
- Продемонструйте, як експериментально спостерігається спін-орбітальна зв'язок в атомних спектрах
- Використовуйте символи атомних термінів для присвоєння переходів до конкретних кутових станів моментів, описаних атомними терміновими символами
Близько 1930 року кілька спектроскопістів, які використовують прилади з високою роздільною здатністю, виявили, що лінії в спектрі атомів водню насправді не є поодинокими лініями, але вони є мультиплетами, як показано для ізотопної суміші водню\((H^1_{\alpha})\) та дейтерію, (\(H^2_{\alpha}\)), на малюнку Template:index. Мультиплет складається з двох або більше тісно розташованих ліній. Два рядки разом утворюють дуплет, три триплет і т.д. мультиплети також називають тонкою структурою. Термін тонка структура означає, що лінії розташовані близько один до одного, тобто тонко розташовані. Така тонка структура також була виявлена в спектрах одноелектронних іонів, таких як\(\ce{He^{+}}\).

Слід нагадати, що\(H^1_{\alpha}\) лінія в ряді Бальмера на рівні 656,279 нм розумілася як отримана в результаті одного переходу електрона від рівня енергії n = 3 до рівня n = 2. Спостереження тонкої структури показало, що орбітальна діаграма рівня енергії не повністю описує енергетичні рівні атомів. Ця тонка структура також надала ключові докази на той час існування електронного спіна, який використовувався не тільки для якісного пояснення мультиплетів, але й для надання високоточних розрахунків розщеплення мультиплетів.
Спін-орбіта
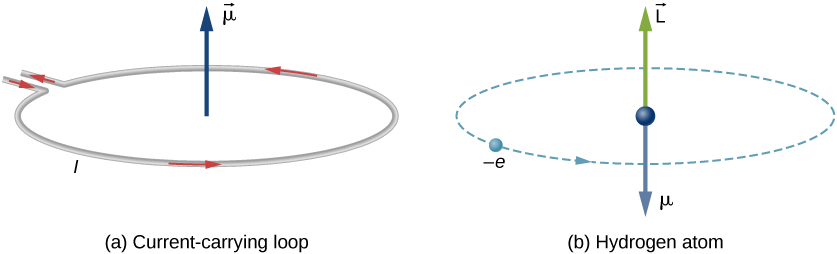
Вказівка орбітальної конфігурації атома не однозначно ідентифікує електронний стан атома, оскільки орбітальний кутовий імпульс, спіновий кутовий імпульс та загальний момент моменту точно не вказані. Наприклад, у конфігурації водню 2p 1 електрон може знаходитися в будь-якій з трьох p-орбіталей,\(m_l\) = +1, 0 і —1, і мати спини з\(m_s\) = +1/2 або —1/2. Таким чином, існує 3 рази 2 різних можливості або стану. Також орбітальний і спіновий кутовий імпульс електронів об'єднують різними способами для отримання векторів кутового імпульсу, які характерні для всього атома не тільки окремих електронів, а ці різні комбінації можуть мати різну енергію. Це з'єднання орбітального і спінового кутового імпульсу відбувається тому, що як електронний спін, так і орбітальний рух виробляють магнітні дипольні моменти. Як ми бачили раніше, зв'язок між моментом і магнітним моментом задається гіромагнітним співвідношенням. Ці магнітні диполі взаємодіють так само, як два крихітних барних магніти, що притягують і відштовхують один одного Ця взаємодія називається спін-орбітальної взаємодією. Енергія взаємодії пропорційна скалярному добутку магнітних дипольних моментів, які пропорційні векторам моменту моменту моменту.
\[E_{s-o} \propto S \cdot L \label{8.11.1} \]
з наступними термінами, доданими до гамільтоніана
\[\hat {H} _{s-o} \propto \hat {S} \cdot \hat {L} \label{8.11.2} \]
де константа пропорційності називається константою спін-орбітального зв'язку. Спін-орбітальна взаємодія з'єднує спіновий рух і орбітальний рух всіх електронів разом. Ця зв'язок означає, що точні хвильові функції не є власними функціями операторів спіна та орбітального моменту окремо. Швидше загальний кутовий імпульс\(J = L+S\), векторна сума спіна та орбітального моменту, потрібно з'єднати для абсолютно точного опису системи. Спроба описати зв'язану систему з точки зору спіна і орбітального моменту окремо аналогічна спробі описати положення двох зв'язаних стрижневих магнітів незалежно. Це неможливо зробити; їх взаємодія повинна бути врахована (Рисунок Template:index).
Атомна спектроскопія
Також існують більш високі енергетичні або збуджені орбітальні конфігурації. Атом водню може поглинати енергію, а електрон може бути підвищений до більш високої енергії орбіталі. Електронні стани, що виникають внаслідок цих збуджених орбітальних конфігурацій, також характеризуються або позначені терміновими символами. Детально про те, як визначити термінові символи для багатоелектронних атомів і для випадків, коли як орбітальний, так і спіновий кутовий імпульс відрізняються від нуля, наведені в інших місцях, поряд з правилами визначення відносних енергій термінів.
Ми виявили, що правила вибору для просування одного електрона, що рухається з однієї атомної орбіти в іншу за допомогою поглинання або випромінювання світла, є
\[ \Delta l = \pm 1 \label {8.11.6} \]
\[ \Delta m_l = 0, \pm 1 \label{8.11.7} \]
Ці правила вибору виникають внаслідок збереження кутового моменту під час спектроскопічного переходу і того факту, що фотон має спін 1. У межах зв'язку L-S ці правила можуть бути виражені термінами атомних позначень, що призводять до результуючих правил вибору Рассела-Сондерса:
\[ \begin{align} \Delta S &= 0 \label {8.11.8} \\[4pt] \Delta L &= 0, \pm 1 \label {8.11.9} \\[4pt] \Delta J &= 0, \pm 1,\label {8.11.10} \end{align} \]
але\(J =0\) до\(J= 0\) переходу заборонено
\[\Delta m_J = 0, \pm 1 \label {8.11.11} \]
але\(m_J = 0\) до\(m_J = 0\) переходу заборонено, якщо\(\Delta J = 0\).
Ці правила вибору є результатом загальних властивостей кутового моменту, таких як збереження кутового моменту та комутаційних відносин. \(\Delta L =0\)Опція в Рівняння\(\ref{8.11.9}\) не порушує збереження кутового моменту, розглянутого раніше,\(\Delta l = \pm 1\) оскільки все ще потрібно. Орбітальний момент імпульсу електрона повинен змінюватися при поглинанні, але це не обов'язково впливає на загальний імпульс стану, заданого рівнянням\(\ref{8.11.9}\).
Правила вибору застосовуються лише до атомів, які можна описати за допомогою зв'язку Расселла-Сондерса (LS). Ці правила зазнають невдачі, оскільки атомний номер збільшується, оскільки\(L\) квантові числа\(S\) та квантові числа стають «поганими» квантовими числами; це відбувається, коли підхід з'єднання jj-зв'язку є більш застосовним. Наприклад, у важких атомах допускається перехід між одиночними (\(S=1/2\)і триплетними\(S=1\) станами (volition of selection правило в Equation\(\ref{8.11.8}\)) і експериментально спостерігається.
Прикладом цієї тонкої структури є викид атомів натрію.

| 616,07 нм | 615,42 нм | 589.00 нм | 589.59 нм | 568.82 нм | 568.26 нм |
Як можна описати ці переходи з точки зору переходів між мікростанами?
Рішення
Ми повинні обговорювати стани з точки зору не тільки електронних конфігурацій, але з точки зору мікростанів (тобто термінових символів) і основного квантового числа валентного електрона,\(n\):
- Заземлений стан має\((Ne]ns^1\) конфігурацію, яка має тільки один мікростан\(^2S_{1/2}\)
- Збуджений стан з валентним електроном в р-орбіталі має електронну конфігурацію\([Ne]np^1\), яка має два мікростану:\(^2P_{3/2}\) і\(^2P_{1/2}\)
- Збуджений стан з валентним електроном в р-орбіталах має електронну конфігурацію\([Ne]nd^1\), яка має два мікростану\(^2D_{5/2}\) і\(^2D_{3/2}\)
Спостережувані лінії можна пояснити:
- \(5S \rightarrow 3P\)дає дві лінії, так як початкова конфігурація має два мікростану: 616.07, 615,42 нм
- \(3P \rightarrow 3S\)дає два рядки, оскільки конфігурація терміналу має два мікростану: 589.00, 589.59 нм
- \(4D \rightarrow 3P\)дає два рядки, оскільки конфігурація терміналу має два мікростану: 568.82, 568.26 нм
Однією з помітних атомних спектральних ліній парів натрію є так звана D-лінія, яка може спостерігатися безпосередньо як лінія випробування полум'я натрію, а також основний світловий потік натрієвих ламп низького тиску (вони виробляють натрієві лампи тиску (вони виробляють неприродний жовтий). D-лінія є однією з класифікованих ліній Фраунгофера в парах натрію у верхніх шарах ліній. Пари натрію у верхніх шарах сонця створюють темну лінію в випромінюваному спектрі електромагнітного випромінювання, поглинаючи видиме світло в смузі довжин хвиль близько 589,5 нм. Ця довжина хвилі відповідає переходам в атомному натрію, в якому валентні-електрон переходить з електронного стану 3s в 3p.
Більш детальний огляд видимого спектра атомного натрію виявляє, що D-лінія насправді складається з двох ліній, званих\(D_2\) лініями\(D_1\) і на 589 6 нм і 589,0 нм відповідно. Розщеплення між цими лініями виникає через спін-орбітального зв'язку. Na має один непарний електрон (\(S = ½\)). Якщо розглядати\(S \rightarrow P\) перехід, то для збудженого стану\(P\), у нас є\(L = 1\). Таким чином,\(J = 3/2\) або\(J=1/2\).
Тепер ми хочемо застосувати ці ідеї, щоб зрозуміти, чому мультиплетна структура знаходиться в спектрі люмінесценції водню та одиночних електронних іонів. Як ми вже говорили,\(H_{\alpha}\) лінію в серії Бальмера на рівні 656,279 нм можна зрозуміти через перехід електрона в атомну орбіту n = 3 в атомну орбіталь n = 2. Коли ця спектральна лінія досліджувалася за допомогою приладів високої роздільної здатності, було виявлено, що вона насправді є дублетом, тобто двома лініями, розділеними на 0,326 см -1.
Існує 9 вироджених орбіталів, пов'язаних з рівнем n = 3, і 4, пов'язані з рівнем n = 2. Оскільки електрон може перебувати в будь-якій орбіті з будь-яким з двох спинив, ми очікуємо, що загальна кількість станів буде вдвічі більшою за кількість орбіталей. Кількість орбіталей задається\(n^2\) таким чином має бути 8 станів, пов'язаних з n = 2 і 18 станів, пов'язаних з n = 3. Використовуючи ідеї векторного додавання моменту моменту, терміни, що виникають внаслідок наявності електрона на будь-якій з цих орбіталей, наведені в таблиці Template:index.
|
|
|
|
|---|---|---|
| 1 с 1 | \(^2S_{1/2}\) | 2 |
| 2 с 1 | \(^2S_{1/2}\) | 2 |
| 2п 1 | \(^2P_{1/2}\),\(^2P_{3/2}\) | 2, 4 |
| 3s 1 | \(^2S_{1/2}\) | 2 |
| 3п 1 | \(^2P_{1/2}\),\(^2P_{3/2}\) | 2, 4 |
| 3d 1 | \(^2D_{3/2}\),\(^2D_{5/2}\) | 4, 6 |
Таблиця Template:index показує, що існує три терміни, пов'язані з n = 2, і 5 термінів, пов'язаних з n = 3. В принципі, кожен термін може мати різну енергетику. Виродження кожного члена визначається кількістю проекцій, які має сумарний вектор кутового моменту на вісь z. Ці проекції залежать від\(m_J\) квантового числа, яке коливається від\(+J\) до\(–J\) цілими кроками. J - сумарне квантове число моменту моменту, яке задається індексом у терміновому символі. Це співвідношення між\(m_J\) і J (\(m_J\)варіюється від\(+J\) до\(–J\) цілими кроками) вірно для будь-якого вектора кутового моменту.
Переконайтеся, що дев'ять символів терміна в таблиці Template:index є правильними.
Переконайтеся, що значення для виродження у таблиці Template:index є правильними і що загальна кількість станів складає до 8 для n = 2 і 18 для n = 3.
Енергії термінів залежать від спін-орбітального зв'язку та релятивістських поправок, які необхідно включити в гамільтонівський оператор, щоб забезпечити більш повний опис атома водню. Як наслідок цих ефектів, всі терміни з однаковими\(n\) і (J\) квантовими числами мають однакову енергію, тоді як терміни з різними значеннями для\(n\) або\(J\) мають різні енергії. Теоретичний термін розщеплення, наведений H.E. White, Вступ до атомних спектрів (McGraw-Hill, New York, 1934) pp. 132-137 і показані на малюнку Template:index.

На малюнку Template:index показано 5 дозволених переходів електрона в станах, пов'язаних з n = 3, до станів, пов'язаних з n = 2. З цих п'яти два найбільш інтенсивні і відповідають за дублетну структуру. Ці два переходи позначені широкими чорними лініями внизу малюнка, щоб відповідати лініям, що спостерігаються у фотографічному спектрі, показаному на малюнку Template:index. Інші переходи сприяють ширині цих ліній або не дотримуються. Теоретичне значення для дублетного розщеплення становить 0,328 см -1, що відмінно узгоджується з виміряним значенням 0,326 см -1. Значення 0,328 см -1 отримують, взявши різницю, 0,364 - 0,036 см -1, в термін розщеплення.
Як ми щойно бачили, електронні стани, визначені терміном символи, мають важливе значення для розуміння спектрів та структури енергетичного рівня атомів, але також важливо пов'язати термінові символи та стани з орбітальними електронними конфігураціями. Орбітальні конфігурації допомагають нам зрозуміти багато загальних або грубих особливостей спектрів і необхідні для створення фізичної картини того, як змінюється електронна щільність через спектроскопічний перехід.
Використовуйте правила вибору Расселла-Сондерса, щоб визначити, які переходи сприяють\(H_{\alpha}\) лінії у водневому спектрі.