8.10: Правила гунда визначають термінові символи наземних електронних держав
- Page ID
- 26750
- Визначте три правила хаунда
- Використовуйте три правила Hunds для прогнозування найнижчої конфігурації енергії та термінових символів для багатоелектронних систем
У розділі Ауфбау обговорювалося, як електрони спочатку заповнюють орбіталі найнижчої енергії, а потім рухаються до орбіталів вищої енергії лише після того, як нижчі енергетичні орбіталі заповнені. Однак є проблема з цим правилом. Звичайно, 1s орбіталі повинні бути заповнені перед 2s орбіталями, тому що 1s орбіталі мають більш низьке значення n, і, отже, меншу енергію. А як щодо трьох різних орбіталів 2p? В якому порядку вони повинні бути заповнені? Відповідь на це питання передбачає правило Гунда, які мають набагато більше сенсу в контексті сформованих термінових символів, які використовуються для поєднання різних,\(L\) а\(S\) значення представляють векторні доповнення можливих мікростанів.
Правила Гунда
- Стан з найбільшим значенням\(S\) є найбільш стабільним, а стабільність зменшується зі зменшенням\(S\).
- Для держав з однаковими значеннями\(S\), держава з найбільшим значенням\(L\) є найбільш стабільним.
- Якщо стани мають однакові значення,\(L\) а\(S\) потім, для підоболонки, яка менше ніж наполовину заповнена, стан з найменшим\(J\) є найбільш стабільним; для підоболонок, які заповнені більш ніж наполовину, стан з найбільшим значенням\(J\) є найбільш стабільним.
Оцініть ці терміни, пов'язані з електронною конфігурацією атома на основі енергії (за правилами Гунда):
\(^3D\),\(^3P\),\(^3S\),\(^1D\),\(^1P\),\(^1S\)
Перше правило Гунда (Максимізувати кратність спина)
Згідно з першим правилом, електрони завжди потрапляють в порожню орбіталь перед тим, як вони з'єднуються. Електрони негативно заряджені і, як наслідок, відштовхуються один одного. Електрони, як правило, мінімізують відштовхування, займаючи власні орбіталі, а не діляться орбіталлю з іншим електроном. Крім того, квантово-механічні розрахунки показали, що електрони на однозайнятих орбіталах менш ефективно екрановані або екрановані від ядра.
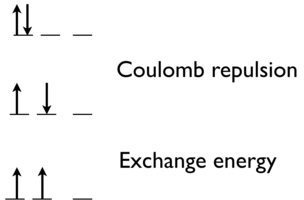
Існує кулонівське відштовхування між двома електронами, щоб поставити їх в одну орбіту (енергія спінового сполучення часто обговорюється в теорії кришталевого поля). Однак існує також квантовий механічний ефект. Енергія обміну (що сприятливо) збільшується з кількістю можливих обмінів між електронами з однаковим спіном і енергією. При переході від верхнього стану до середнього стану Figure Template:index, ми видаляємо кулонівське відштовхування між електронами в тій самій орбіталі. Більш того, при переході з середнього стану в нижній стан (найбільш стабільний стан, передбачений першим правилом Гунда), ми отримуємо енергію обміну, тому що ці два електрони не відрізняються.
Друге правило Гунда (максимізація орбітальної кутової кратності)
Важливим є загальний (скалярний) момент імпульсу, а не напрямок. Негативні і позитивні ознаки відносяться тільки до напрямку моменту моменту, а не величини. Напрямок, крім того, довільний (за винятком, скажімо, магнітного або електричного поля). Так само і напрямок віджиму, до речі. За умовністю ми зазвичай малюємо перший електрон на кожній орбіті як «вгору» (позитивний спін). Однак ми могли б так само легко намалювати його «вниз». Це не має різниці - при відсутності зовнішнього ЕМ-поля енергія однакова хоча б тому, що молекули/атоми все одно обертаються щодо лабораторного кадру. «Вгору» і «вниз», іншими словами, штучно. Важливим є відносні вектори імпульсу різних електронів у системі, а отже, і їх сума загальна.
Третє правило Гунда (Мінімізувати менше, ніж наполовину заповнені або максимізувати більше половини заповнених оболонок)
Давним-давно хтось пропонував досить просте пояснення, пов'язане з тим, що коли оболонка заповнена більш ніж наполовину, легше візуалізувати систему як взаємодію між спіновим і орбітальним моментами дірок, а не електронами, і в цьому випадку термін енергійної стабілізації змінюється в знак. Це було б тому, що спіновий кутовий імпульс одного отвору був би протилежним за знаком порівняно зі спіновим кутовим імпульсом одного електрона. Беручи в якості прикладу - три р-орбіталі. Ситуація з 1 електроном і 5 електронами функціонально схожа, за винятком того, що один має один електрон, а один має одну дірку. При рівних умовах загальний спіновий момент імпульсу електронної системи 1 був би протилежним за знаком будь-якого загального спінового кутового імпульсу електронної системи 5. Тож очікування щодо правил Гунда будуть змінені. Ви можете побачити це, якщо ви витягнете всі мікростани 1-електронної та 5-електронної конфігурацій: все в значній мірі змінилося в знаку в останньому випадку.
Які терміни та рівні можуть виникнути у атома з конфігурацією наземного стану\(1s^22s^22p^6 3s^2 3p^6 4s^2 4p^1 3d^1\)? Яке найстабільніше (найнижче за енергією) стан?
Рішення
Можливі стани включають:
\(^1F_3\),\(^1D_2\),\(^1P_1\),\(^3F_4\),\(^3F_3\),\(^3F_2\),\(^3D_3\),\(^3D_2\),\(^3D_1\),\(^3P_2\),\(^3P_1\),\(^3P_0\).
У цій системі є два непарних електрона з електронної конфігурації.
- Правило 1 передбачає, що наземний стан буде трійкою з\(S=1\) таким\(2S+1=3\). Отже, основна держава з цього більш звуженого списку:\(^3F_4\),,\(^3F_3\),\(^3F_2\),\(^3D_3\),\(^3D_2\),\(^3D_1\),,\(^3P_2\),\(^3P_1\),\(^3P_0\).
- Правило 2 передбачає\(F\) стан, оскільки це найвища кратність з\(L= 3\): Отже, стан землі з цього більш звуженого списку:\(^3F_4\),\(^3F_3\),\(^3F_2\)
- Правило 3 передбачає найнижчий\(J\) термін, оскільки оболонка d менше половини заповнена. Тобто\(J=2\) держава.
Тому для цієї системи атом матиме наземну структуру
\(^3F_2\)
Конфігурація грунту\(\ce{Ti^{2+}}\) іона є\([Ar]3d^2\). Що таке термін найнижчого енергетичного стану?
Рішення
- Правило 1: два непарних електрона ⇒ найвищий S = 1 ⇒ 2S + 1 = 3
- Правило 2: два в d паралельно спина ⇒ найвищий L = 1 + 2 = 3 ⇒ 3F
- Правило 3: .L = 3, S = 1 ⇒ J = 4, 3, 2; менше наполовину заповненого ⇒\(^3F_2\)
Що таке термін найнижчого енергетичного стану для наступних атомів і іонів.
- \(\ce{C}\):\([He]2s^2 2p^2\)
- \(\ce{N}\):\([He]2s^2 2p^3\)
- \(\ce{O}\):\([He]2s^2 2p^4\)
- \(\ce{Cr^{3+}}\):\([Ar]3d^3\)
- \(\ce{Mn^{3+}}\):\([Ar]3d^4\)
- \(\ce{Fe^{3+}}\):\([Ar]3d^5\)
- Відповідь
-
\(^3P_0\),\(^4S_{3/2}\),\(^3P_2\),\(^4F_{3/2}\),\(^5D_0\), і\(^6S_{5/2}\), відповідно.