6.5: s-орбіталі сферично симетричні
- Page ID
- 27331
Хвильові функції атома водню називаються атомними орбіталями.\(\psi (r, \theta , \varphi )\) Атомна орбітальна - це функція, яка описує один електрон в атомі. Хвильова функція з\(n = 1\),\(l\) = 0 називається орбітальною 1s, а електрон, який описується цією функцією, вважається «в» орбіталі ls, тобто має 1s орбітальний стан. Обмеження на n\(l\), і\(m_l\) які накладаються під час розв'язання рівняння атома водню Шредінгера пояснюють, чому існує одна 1s орбіталь, чому існує три 2p орбіталі, п'ять 3d орбіталей тощо Ми побачимо, коли розглянемо багатоелектронні атоми, ці обмеження пояснюють особливості Періодичної таблиці. Іншими словами, Періодична таблиця є проявом моделі Шредінгера та фізичних обмежень, накладених для отримання розв'язків рівняння Шредінгера для атома водню.
Візуалізація варіації електронної хвильової функції з r, і\(\varphi\) важлива\(\theta\), оскільки абсолютний квадрат хвильової функції зображує розподіл заряду (щільність ймовірності електронів) в атомі або молекулі. Розподіл заряду є центральним для хімії, оскільки він пов'язаний з хімічною реакційною здатністю. Наприклад, електронно-дефіцитна частина однієї молекули притягується в багату електронами область іншої молекули, і такі взаємодії відіграють важливу роль у хімічних взаємодіях, починаючи від реакцій заміщення та приєднання до згортання білка і взаємодії субстратів з ферментами.
Ми можемо отримати енергію і одну або кілька хвильових функцій для кожного значення\(n\), головного квантового числа, шляхом вирішення рівняння Шредінгера для атома водню. Знання хвильових функцій, або амплітуд ймовірностей\(\psi_n\), дозволяє обчислити розподіли ймовірностей для електрона в будь-якому заданому квантовому рівні. При n = 1 хвильова функція і похідна функція ймовірності не залежать від напрямку і залежать тільки від відстані r між електроном і ядром. На рисунку Template:index ми будуємо як\(r\), так\(\psi_1\) і\(P_1\) проти, показуючи варіації цих функцій, коли електрон рухається далі і далі від ядра в будь-якому одному напрямку. (Ці та всі наступні графіки побудовані з точки зору атомної одиниці довжини,\(a_0 = 0.529 \times 10^{-8}\, cm\).)
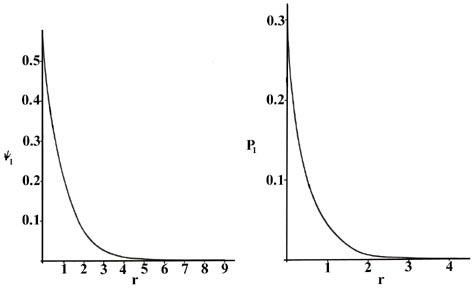
Дві інтерпретації можуть бути знову дані\(P_1\) кривої. Експеримент, призначений для виявлення положення електрона з невизначеністю, значно меншою за діаметр самого атома (з використанням світла короткої довжини хвилі), якщо повторити велику кількість разів, призведе до Figure Template:index для\(P_1\). Тобто електрон буде виявлятися близько до ядра найчастіше і ймовірність спостереження за ним на деякій відстані від ядра буде стрімко зменшуватися зі збільшенням\(r\). Атом буде іонізований при здійсненні кожного з цих спостережень, оскільки енергія фотонів з довжиною хвилі набагато менше 10 -8 см буде більшою\(K\), ніж кількість енергії, необхідної для іонізації атома водню. Якщо в експерименті буде використано світло з довжиною хвилі, порівнянною з діаметром атома, то електрон не буде збуджуватися, але наші знання про його положення будуть відповідно менш точними. У цих експериментах, в яких енергія електрона не змінюється, електрон буде здаватися «розмазаним», і ми можемо інтерпретувати\(P_1\) як надання частки загального електронного заряду, який слід знайти в кожному невеликому об'ємному елементі простору. (Нагадаємо, що додавання значення P n для кожного елемента малого об'єму по всьому простору додає до одиниці, тобто одного електрона і одного електронного заряду.)
Візуалізація хвильових функцій та розподілів зарядів є складною справою, оскільки вимагає вивчення поведінки функції трьох змінних у тривимірному просторі. Ця візуалізація полегшується, розглядаючи радіальні та кутові частини окремо, але побудова радіальної та кутової частин окремо не дуже добре виявляє форму орбіти. Форма може бути розкрита краще на графіку щільності ймовірності. Щоб скласти такий тривимірний сюжет, розділіть простір вгору на невеликі об'ємні елементи, обчислите\(\psi ^* \psi \) в центрі кожного об'ємного елемента, а потім розтушуйте, пофарбуйте або розфарбуйте цей об'ємний елемент пропорційно величині\(\psi ^* \psi \).
Ми також можемо представити розподіл негативного заряду в атомі водню способом, який раніше використовувався для переміщення електрона на площині (Рисунок Template:index), шляхом відображення щільності заряду в площині за допомогою контурної карти. Уявіть собі площину через атом, включаючи ядро. Щільність розраховується в кожній точці цієї площини. Всі точки, що мають однакове значення для електронної густини в цій площині, з'єднуються контурною лінією (рис. Template:index). Так як електронна щільність залежить тільки від r, відстань від ядра, а не від напрямку в просторі, контури будуть круглими. Контурна карта корисна, оскільки вона вказує на «форму» розподілу щільності.
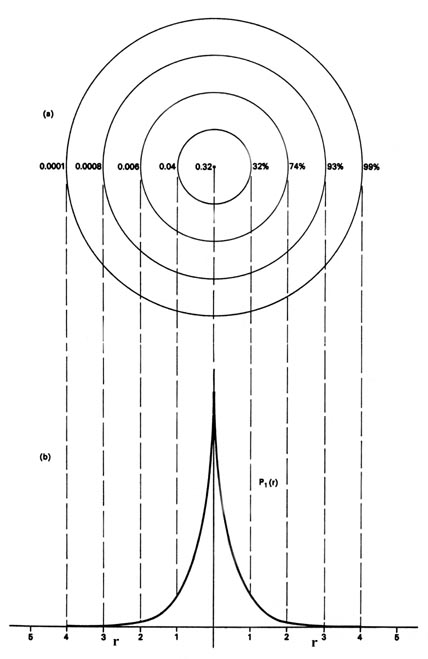
Коли електрон знаходиться на певному енергетичному рівні, ми будемо називати\(P_n\) розподіли електронної густини, оскільки вони описують спосіб розподілу загального електронного заряду в просторі. Електронна щільність виражається через кількість електронних зарядів на одиницю об'єму простору, е -/В. Об'єм V зазвичай виражається в атомних одиницях довжини в кубі, а одна атомна одиниця електронної щільності тоді е -/a 0 3. Щоб дати уявлення про порядок одиниці атомної щільності, 1 ау щільності заряду e -/a 0 3 = 6,7 електронних зарядів на кубічний Ångstrom. Тобто куб довжиною\(0.52917 \times 10^{-8}\; cm\), якщо рівномірно заповнити електронну щільність заряду 1 ау, містив би 6,7 електронних зарядів.
Для кожного значення енергії E n, для атома водню, існує виродження, рівне\(n^2\). Тому для n = 1 існує лише одна атомна орбіта та один розподіл електронної густини. Однак для n = 2 існують чотири різні атомні орбіталі та чотири різні розподіли електронної густини, всі з яких мають однакове значення для енергії, Е 2. Таким чином, для всіх значень головного квантового числа n існує n 2 різних способів, за допомогою яких електронний заряд може розподілятися в тривимірному просторі і при цьому мати однакове значення для енергії. Для кожного значення основного квантового числа одна з можливих атомних орбіталей не залежить від напрямку і дає сферичний розподіл електронної густини, який може бути представлений круговими контурами, як це було показано вище для випадку n = 1. Інші атомні орбіталі для заданого значення n виявляють спрямовану залежність і прогнозують розподіли щільності, які не є сферичними, а зосереджені в площині або вздовж певних осей. Кутова залежність атомних орбіталей для атома водню і форми контурів відповідних розподілів електронної густини тісно пов'язані з кутовим імпульсом, яким володіє електрон.
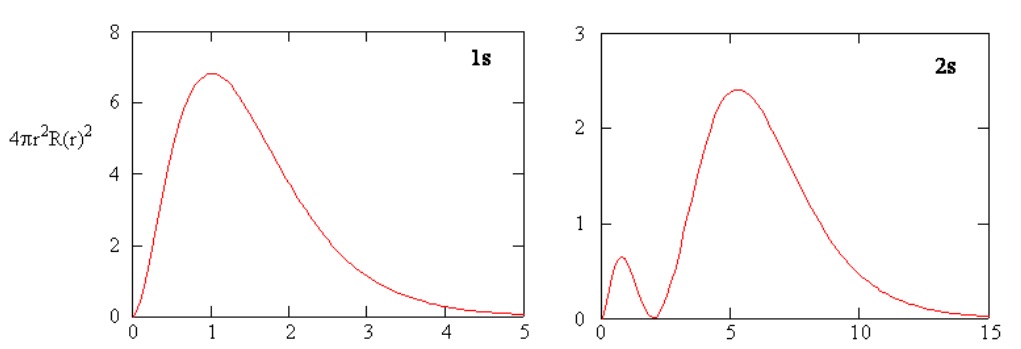
Методи окремого дослідження радіальних ділянок атомних орбіталей дають корисну інформацію про розподіл щільності заряду всередині орбіталей. Графіки радіальних функцій для 1s та 2s орбіталей побудовані на рисунку Template:index.\(R(r)\) Функція 1s на малюнку\(\PageIndex{3; left}\) починається з високого позитивного значення в ядрі і експоненціально розпадається до практично нуля після радіусів Бора 5. Висока величина в ядрі може бути дивною, але, як ми побачимо пізніше, ймовірність знаходження електрона в ядрі зникає мала.
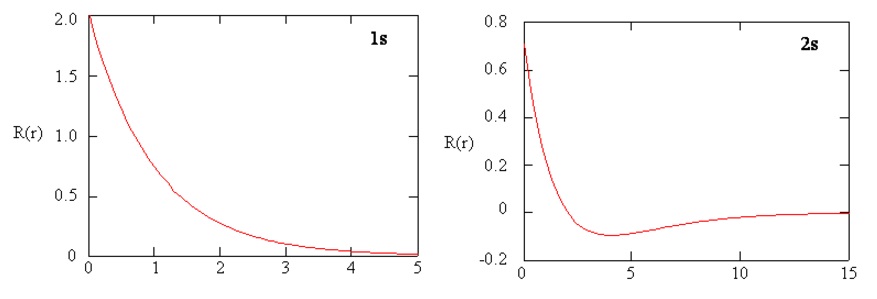
Далі зверніть увагу, як радіальна функція для 2s орбіталі, рис.\(\PageIndex{3; right}\), переходить до нуля і стає негативною. Така поведінка виявляє наявність радіального вузла у функції. Радіальний вузол виникає, коли радіальна функція дорівнює нулю, крім at\(r = 0\) або\(r = ∞\). Вузли та обмежувальна поведінка атомних орбітальних функцій є корисними для визначення того, яка орбітальна описується якою хвильовою функцією. Наприклад, всі функції s мають ненульові значення хвильової функції в\(r = 0\).
Вивчіть математичні форми радіальних хвильових функцій. Яка особливість у функціях змушує деякі з них йти до нуля при початку, тоді як функції s не йдуть до нуля у початку?
Яка математична особливість кожної з радіальних функцій керує кількістю радіальних вузлів?
При якому значенні\(r\) має місце 2s радіальний вузол?
Складіть таблицю, яка забезпечує енергію, кількість радіальних вузлів, а також кількість кутових вузлів і загальну кількість вузлів для кожної функції з\(n = 1\)\(n=2\), і\(n=3\). Визначте взаємозв'язок між енергією і кількістю вузлів. Визначте залежність між кількістю радіальних вузлів і кількістю кутових вузлів.
- Відповідь
-
Енергетика
1. Частинка в коробці (h 2 n 2 /8m e L 2)
2. Гармонічний осцилятор ((n+0.5) Ω)
3. Водень (-13,6 еВ/Н 2)
Кількість радіальних вузлів
(н-л-1)
Кількість кутових вузлів
л = (н-1)
л: с = 0
р = 1
д = 2
Загальна кількість вузлів п = 1 1. 6.02*10 -38 ДЖ/Л 2
2. 1,5Ом
3. -13,6 еВ
- 0 0 п = 2 1. 6.02*10 -38 ДЖ/Л 2
2. 2,5Ω
3. -3,4 еВ
для s: 1
для р: 0
для s: 0
для р: 1
1 п = 3 1. 6.02*10 -38 ДЖ/Л 2
2. 3.5Ом
3. 1,51 еВ
для s: 2
для р: 1
за d: 0
для s: 0
для р:1
за d: 2
2 Для частинки в коробці енергія\(n\) еквівалентна\(E_n= 6.02 \times 10^{-38} n^2L^2\) де будь-яке значення більше і не дорівнює 0, а L - довжина коробки.
Радіальні густини ймовірностей для атомних орбіталей 1s та 2s побудовані на рисунку Template:index.
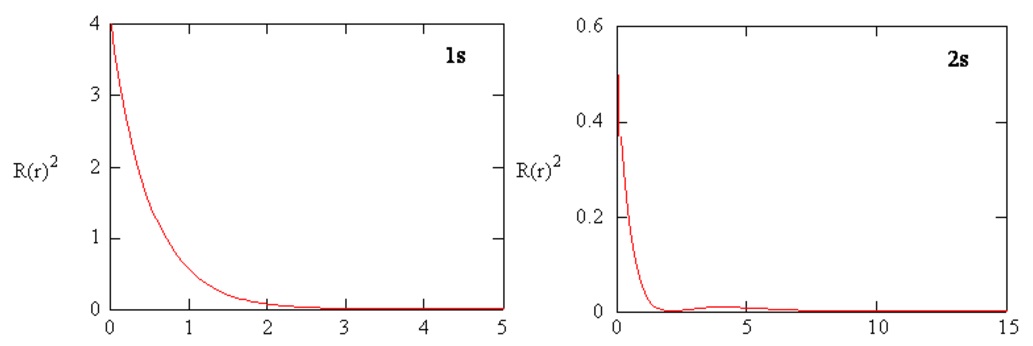
Функції радіального розподілу
Замість того, щоб розглядати кількість електронного заряду в одному конкретному невеликому елементі простору, ми можемо визначити загальну кількість заряду, що лежить в тонкій сферичній оболонці простору. Оскільки розподіл не залежить від напрямку, подумайте про складання всієї щільності заряду, яка лежить в об'ємі простору, обмеженому внутрішньою сферою радіуса\(r\) та зовнішньою концентричною сферою з радіусом лише нескінченно більшим, скажімо\(r + \Delta r\). Площа внутрішньої сфери -\(4\pi r^2\) і товщина оболонки дорівнює\(\Delta r\). Таким чином, обсяг оболонки є\(4\pi r^2 \Delta r\) і добуток цього об'єму, а щільність заряду P 1 (r), яка є зарядом або кількістю електронів на одиницю об'єму, тому є загальною кількістю електронного заряду, що лежить між сферами радіуса \(r\)і\(r + \Delta r\). Виробу\(4\pi r^2P_n\) дається спеціальна назва, функція радіального розподілу.
Читач може задатися питанням, чому обсяг оболонки не приймається за:
\[ \dfrac{4}{3} \pi \left[ (r + \Delta r)^3 -r^3 \right] \nonumber \]
різниця в об'ємі між двома концентричними сферами. Коли цей вираз для обсягу буде розширено, отримаємо
\[\dfrac{4}{3} \pi \left(3r^2 \Delta r + 3r \Delta r^2 + \Delta r^3\right) \nonumber \]
і для дуже малих значень\(\Delta r\)\(3r \Delta r^2\) і\(\Delta r^3\) терміни мізерно малі в порівнянні з\(3r^2\Delta r\). Таким чином, для малих значень\(\Delta r\), два вирази для обсягу оболонки наближаються один до одного за значенням і коли\(\Delta r\) являє собою нескінченно малий приріст в\(r\) них ідентичні.
Функція радіального розподілу побудована на рисунку Template:index} для основного стану атома водню.
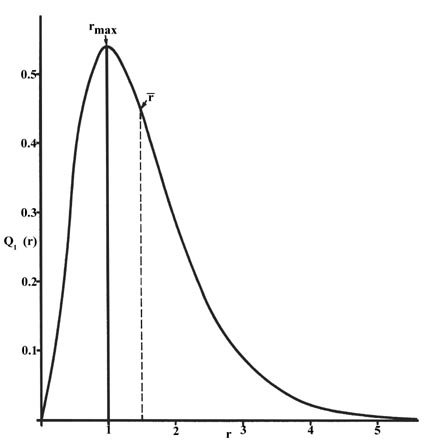
Крива проходить через нуль o at\(r = 0\) sinc e площа поверхні сфери з нульовим радіусом дорівнює нулю. Зі збільшенням радіуса сфери обсяг простору визначається d на\(4 \pi r^2Dr\) inc reases. Однак, як показано на рисунку Template:index, абсолютне значення електронної густини в заданій точці зменшується,\(r\) а результуюча крива повинна пройти через максимум. Цей максимум припадає на т\(r_{max} = a_0\). При цьому більша частина електронного заряду присутня на віддаленому льоду\(a_o\), поза ним від ядра, ніж при будь-якому іншому значенні\(r\). Так як крива несиметрична, то середнє значення\(r\), що позначається\(\bar{r}\), не дорівнює t o\(r_{max}\). Т середнє значення\(r\) позначається на малюнку пунктирною лінією. «Картина» розподілу електронної густини для електрона на\(n = 1\) рівні e l атома водню буде сферичною кулькою заряду, щільною навколо ядра і стає все більш\(r\) дифузною з збільшенням значення f.
Функція радіального розподілу дає щільність ймовірності для знаходження електрона в будь-якому місці на поверхні сфери, розташованої на відстані\(r\) від протона. Оскільки площа сферичної поверхні є\(4 \pi r^2\), то функція радіального розподілу задається\(4 \pi r^2 R(r) ^* R(r)\).
Функції радіального розподілу показані на рисунку Template:index. При малих значеннях функція радіального розподілу є низькою\(r\), оскільки мала площа поверхні для малих радіусів модулює високе значення функції густини радіальної ймовірності поблизу ядра. Зі збільшенням площа поверхні\(r\), пов'язана з заданим значенням,\(r\) збільшується, і\(r^2\) термін змушує функцію радіального розподілу збільшуватися, навіть якщо густина радіальної ймовірності починає зменшуватися. При великих значеннях\(r\) експоненціальний розпад радіальної функції переважує збільшення,\(r^2\) викликане терміном, а функція радіального розподілу зменшується.
Обчисліть ймовірність знаходження 1s електрона водню, який знаходиться на відстані\(2a_o\) від ядра.
- Рішення
-
Зверніть увагу на хвильову функцію водню 1s орбіти, яка є
\[ψ_{100}= \dfrac{1}{\sqrt{π}} \left(\dfrac{1}{a_0}\right)^{3/2} e^{-\rho} \nonumber \]
с\(\rho=\dfrac{r}{a_0} \).
Імовірність знаходження електрона на\(2a_0\) відстані від ядра складе:
\[prob= \underbrace{\int_{0}^{\pi} \sin \theta \, d\theta}_{over\, \theta} \, \overbrace{ \dfrac{1}{\pi a_0^3} \int_{0}^{2a_0} r^2 e^{-2r/a_0} dr}^{over\, r} \, \underbrace{ \int_{0}^{2\pi} d\phi }_{over\, \phi } \nonumber \]
З тих пір\( \int_0^{2\pi} d\phi=2\pi\), як\(\int_0^{\pi} \sin \theta d\theta=2\) і, ми маємо
\[ \begin{align*} prob &=2 \times 2\pi \times \dfrac{1}{\pi a_0^3} \int_0^2a_0 (-a_0/2)r^2 d e^{-2r/a_0} \\[4pt]&=\dfrac{4}{a_0^3}\left(-\dfrac{a_0}{2}\right) (r^2 e^{-2r/a_0} |_0^{2a_0} - \int_0^{2a_0} 2r e^{-2r/a_0} dr) \\[4pt]&= -\dfrac{2}{a_0^2} [(2a_0)^2 e^{-4}-0-2\int_0^{2a_0} r \left(-\dfrac{a_0}{2}\right) d e^{-2r/a_0} ] \\[4pt]&=-\dfrac{2}{a_0^2}4a_0^2 e^{-4} +\dfrac{4}{a_0^2}(-\dfrac{a_0}{2}) (r e^{-2r/a_0} |_0^{2a_0}-\int_0^{2a_0} e^{-2r/a_0} dr ) \\[4pt]&=-8e^{-4}-\dfrac{2}{a_0} \left[2a_0e^{-4}-0-(-\dfrac{a_0}{2})e^{-2r/a_0} |_0^{2a_0} \right] \\[4pt]&=-8e^{-4}-4e^{-4}-e^{2r/a_0} |_0^{2a_0} \\[4pt]&=-12 e^{-4}-(e^{-4}-1)=1-13e^{-4}=0.762 \end{align*} \nonumber \]
Існує 76.2% ймовірність того, що електрони будуть знаходитися всередині\(2a_o\) ядра в 1-му власному стані.
Резюме
На цьому опис найбільш стабільного стану атома водню, стан для якого\(n = 1\). Перш ніж приступити до обговорення збуджених станів атома водню, ми повинні ввести новий термін. Коли енергія електрона збільшується до іншого з дозволених значень, що відповідають новому значенню для\(n\),\(y_n\) і\(P_n\) змінюються також. Хвильові функції\(y_n\) для атома водню отримали особливу назву, атомні орбіталі, оскільки вони відіграють таку важливу роль у всіх наших майбутніх дискусіях про електронну структуру атомів. Взагалі слово орбітальна - це назва хвильової функції, яка визначає рух одного електрона. Якщо одноелектронна хвильова функція призначена для атомної системи, її називають атомною орбітальною.
Не варто плутати слово орбітальна з класичним словом і поняттям орбіти. По-перше, орбіта передбачає знання певної траєкторії або шляху для частинки через простір, що саме по собі неможливо для електрона. По-друге, орбітальна, як і хвильова функція, не має фізичної реальності, але є математичною функцією, яка при квадраті дає фізично вимірюваний розподіл електронної густини.