ІІ. Заміна ацилокси-групи атомом водню
- Page ID
- 28153
A. α-ацилокси кетони
α‑ацилоксикетони реагують з три-н-бутилтингідридом шляхом заміни ацилоксигрупи атомом водню (екв 1). 1 Важливість карбонільної групи для цього процесу заміни очевидна в двох реакціях, показаних в еквалайзері 2. У першому з них бензоат (1), що містить кето-групу, утворює дезокси-цукор з хорошим виходом, але у другому бензоат (2), який не має такої групи, не реагує. 1 Незважаючи на те, що реакції α-ацилоксикетонів призводять до утворення дезоксицукрів, корисність таких реакцій обмежена відносно невеликою кількістю вуглеводів, які або мають необхідні замінники, або легко можуть бути перетворені в сполуки, які роблять. 1,2
.png)
.png)
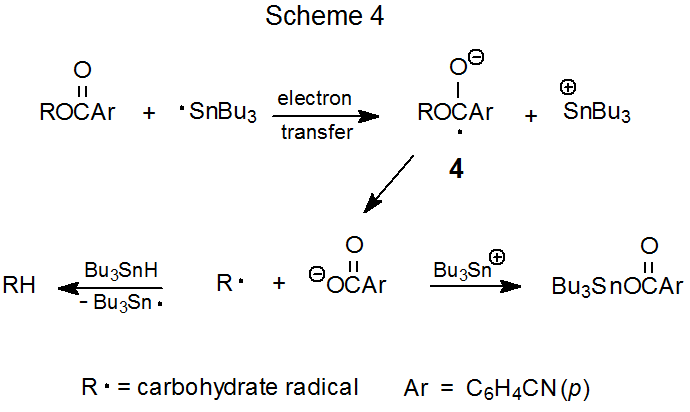
Запропонований механізм групового заміщення α-ацилоксикетонами зображено на схемі 1. Як можливості втрати ацилоксигрупи представлені як послідовності додавання/елімінації, так і послідовності передачі/елімінації електронів. Можливість додавання-елімінації була запропонована на момент відкриття цієї реакції, 1 але варіант перенесення електронів був визнаний життєздатною альтернативою пізніше, коли втрата бензоїлокси-групи з α- (бензоїлокси) ацетофенону передбачає перенесення електронів від Bu 3 Sn· до цього α-ацилоксикетону. 3 Немає вирішальних доказів, що сприяють будь-якому механізму.
B. метилоксалілові ефіри
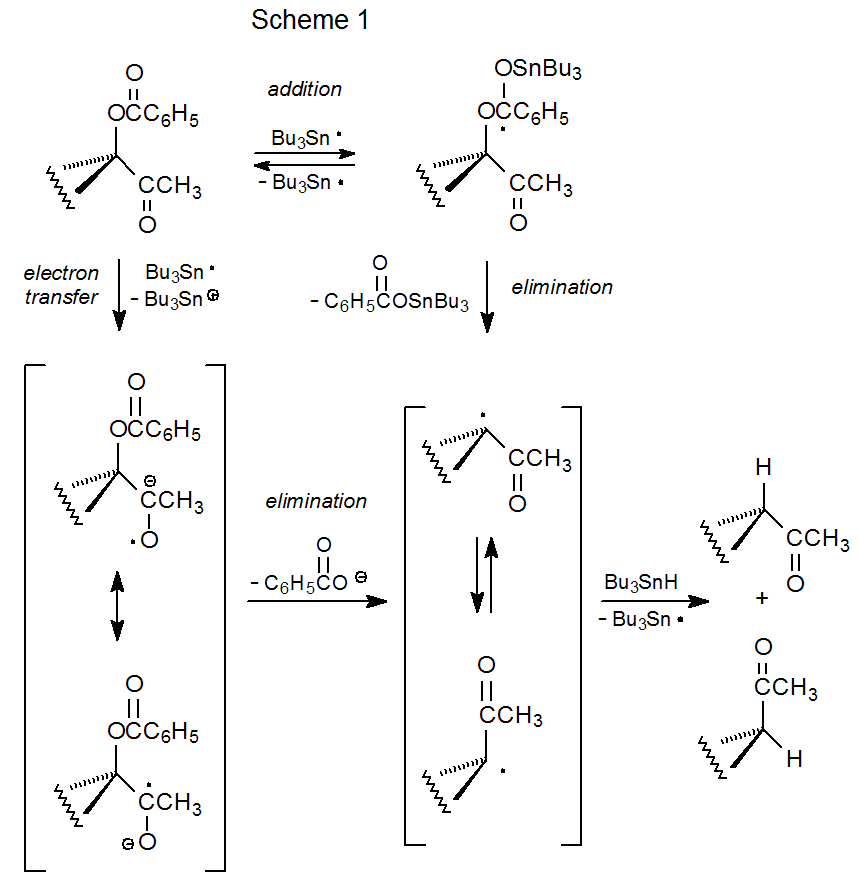
Метилоксалілові ефіри можна легко приготувати шляхом етерифікації частково захищених вуглеводів метилоксалілхлоридом (Схема 2). 4 Ці ефіри реагують з три-н-бутилтингідридом, щоб замінити метилоксалілокси-групу атомом водню. 4—19 Дослідження невуглеводних ефірів показують, що ті, що отримані з вторинних та третинних спиртів, є придатними вихідними матеріалами в цьому процесі дезоксигенації, але ефіри первинних спиртів не тому, що вони регенерують спирти, з яких вони були синтезовані. 20 Більшість реакцій метилоксалівих ефірів вуглеводів є сполуками, в яких третинна гідроксильна група була етерифікована. Багато з цих сполук є нуклеозидами. 4,7—16 Однією з причин того, що більшість метилоксалівих ефірів утворюються з третинних спиртів, є те, що О-тіокарбонільні сполуки, які зазвичай використовуються для дезоксигенації в реакції Бартона-Маккомбі (розділ II в главі 12), іноді мають труднощі з формуванням, коли алкоголь третинний. 6 Метилоксалілхлорид зазвичай етерифікує третинні спирти без труднощів. 4,6—19 Ще однією причиною вибору метилоксалілових ефірів є те, що вони рідше відчувають термічну елімінацію (реакцію Чугаєва), що є загальним для третинних O -тіокарбонільних сполук. У молекулах з належною структурою циклізації може передувати воднево-атомний абстрагування. 13
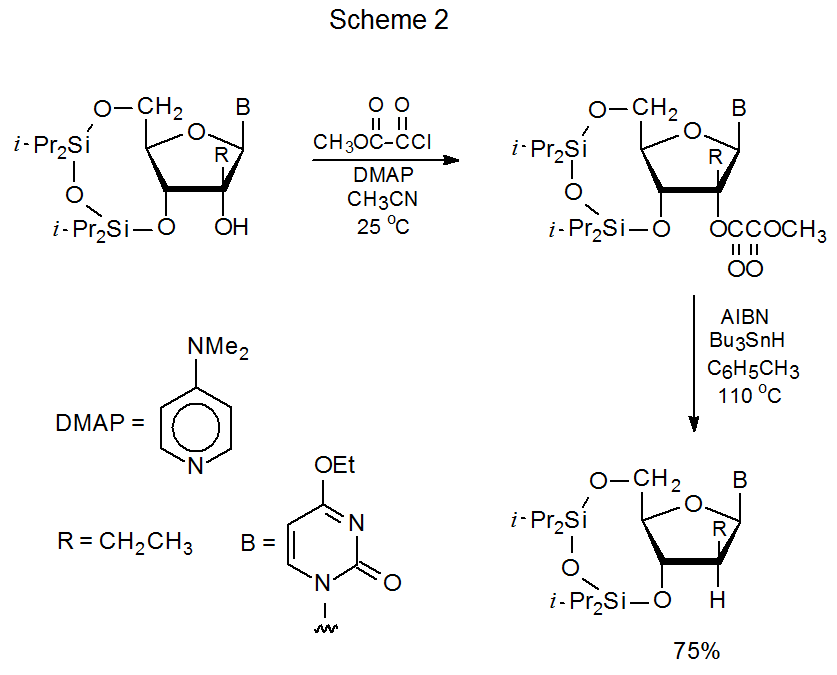
Запропонований механізм реакції метилоксалілових ефірів з три-н-бутилтилгідридом показаний на схемі 3. Відповідно до цього механізму три-н-бутилтіновий радикал передає електрон до π системи ефіру для отримання високостабілізованого радикального аніона (семідіона). 20 (Підтримуючи ідею про те, що така передача має місце, є спостереження, що Bu 3 Sn· реагує з оксалатними ефірами для отримання проміжних продуктів із спектрами ШОЕ, характерними для радикальних аніонів. 21) Фрагментація такого радикального аніону потім генерує вуглецево-центрований радикал, який абстрагує атом водню з Bu 3 SnH (схема 3).
Є дві суттєві проблеми, пов'язані з синтезом та реакцією метилоксалівих ефірів. Однією з них є труднощі очищення вихідного матеріалу, що виникає через те, що ці ефіри легко гідролізуються, зокрема, під час хроматографії на силікагелі. 4,22 Друга проблема пов'язана з регенерацією спирту, значною побічною реакцією від обробки деяких метилоксалілових ефірів три-н-бутилтингідридом. 5,20
C. ацетати і трифторацетати
Ацетильовані вуглеводи не вступають в реакцію з три-н -бутилтингідридом в нормальних умовах (80-110 o С, 2 ч, ініціація AIBN), але в різних, більш енергійних умовах (трифенілсилан, 140 о С, 12 ч, два еквіваленти пероксиду бензоїлу) ці сполуки виробляють ядро реагуючі на токсичні цукру (ур. 3). 23 Ці більш енергійні умови викликають подібну реакцію в O -трифторацетилзаміщених вуглеводах. 24 Необхідність двох еквівалентів пероксиду бензоїлу в реакції, показаної в еквалайзері 3, вказує на те, що відбувається неланцюговий процес.
.png)
D. p -ціанобензоати
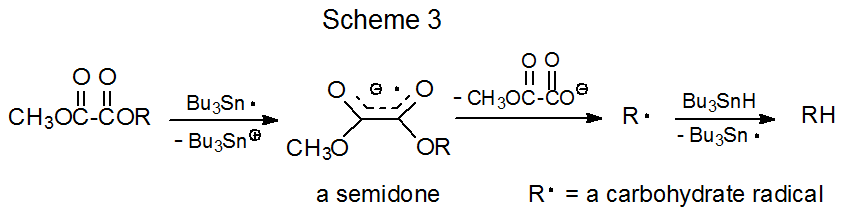
Заміна бензоїльної групи в з'єднанні 2 р -ціанобензоїльної групою перетворює нереактивну сполуку (2) в реактивну (3) (екв 4). 25 Одне пояснення цієї різниці в реактивності полягає в тому, що, оскільки ціано-група досить ефективна для стабілізації радикального аніону, перенесення електронів до сполуки 3 відбувається там, де аналогічний перехід до незамісленого бензоату 2 не відбувається. Оскільки радикальні аніони можуть утворюватися шляхом перенесення електронів від три-н-бутилтин-радикала до легко відновлюваних органічних сполук, 21,26 механізм передачі електронів, зображений на схемі 4, являє собою можливий шлях для заміни p -ціанобензойлокси-групи атом водню.
.png)