ІІІ. Фотохімічний перенесення електронів до ефірів карбонової кислоти
- Page ID
- 28140
А. ацетати і півалати
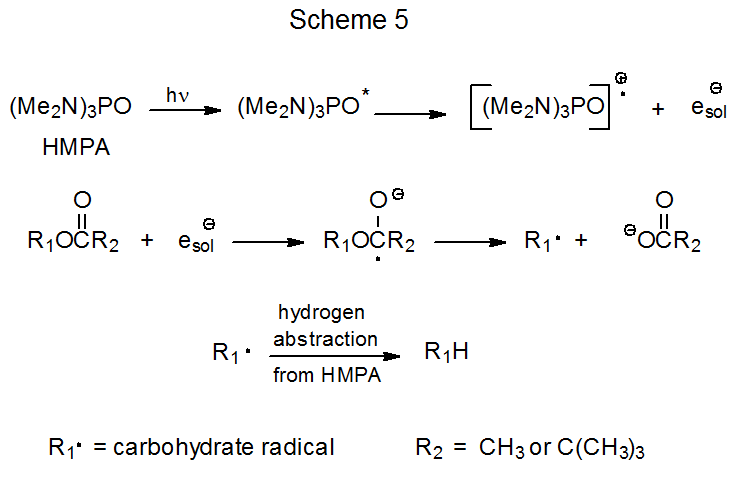
Фотохімічний перенесення електронів від збудженого гексаметилфосфораміду (HMPA) до O -ацильної групи у вуглеводі починає низку подій, які призводять до заміни кожної O -ацильної групи атомом водню. Приклад типової реакції показаний в еквалайзері 5. 27 Температура, при якій може проводитися ця реакція (~ 25 o С), синтетично набагато привабливіша, ніж 140 о С, необхідні для відповідної теплової реакції ацетильованого вуглеводу (ур. 3). 23 Фотохімічний перенесення електронів до ацетатів був використаний для синтезу ряду дезоксицукрів. 27—34 Ефіри півалової кислоти, які також можуть служити субстратами в цьому типі реакції, 28,35—41 іноді дають кращі врожаї, ніж відповідні ацетати. 28,35,36
.png)
1. Механізм реакції
Фотохімічний перенесення електронів починається з поглинання світла HMPA для отримання високореактивної, електронно збудженої молекули, яка викидає електрон в розчин (схема 5). 42.43 Викинутий електрон захоплюється ацильованим вуглеводом для отримання радикального аніону, який розщеплюється, даючи карбоксилатний аніон та вуглеводний радикал (R ·). 43 Абстракція атома водню вуглеводним радикалом потім завершує процес заміни (схема 5). Вода, присутня в реакційній суміші, продовжує термін служби розчиненого електрона і, таким чином, збільшує ймовірність того, що цей електрон буде захоплений молекулою ефіру. 43 (Важливість води для успіху цього процесу демонструється врожайністю реакцій, показаних в еквалайзері 6. 44,45)
.png)
2. Регенерація алкоголю
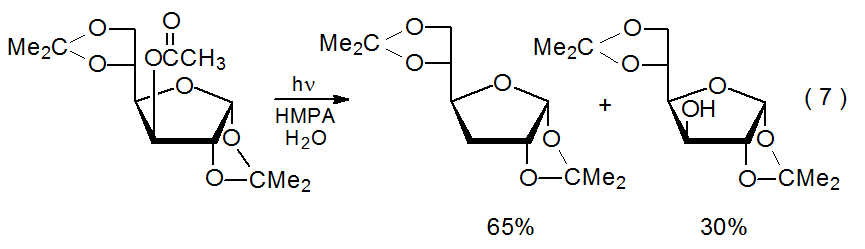
Фотоліз ефіру у водній HMPA іноді регенерує спирт, з якого синтезували ефір (ур. 7). 34 У деяких випадках утворення спирту може бути обумовлено нефотохімічним гідролізом ефіру. Нефотохімічна реакція забезпечує розумне пояснення легко гідролізованого, аномерного ацетату, показаного в еквалайзері 8, що піддається лише гідролізу (без дезоксигенації) при фотолізі у водному HMPA. 34 Незважаючи на те, що простий гідроліз може бути значним для деяких сполук, як описано нижче, регенерація спирту під час фотолізу інших, ймовірно, більшості ефірів повинна відбуватися по-іншому.
.png)
.png)
Утворення алкоголю при фотолізі ефіру неможливо пояснити, загалом, простим гідролізом, оскільки, як показує реакція, зображена на схемі 6, вихід спирту може залежати від концентрації вихідного ефіру. 43 Одне пояснення цієї залежності починається з того, що ефір 5 захоплює сольватизований електрон з утворенням радикального аніону 6. Потім цей радикальний аніон абстрагує атом водню з другої молекули 5 для отримання аніона 7, який потім утворює іон алкоксиду, який протонує, щоб дати спостережуваний спирт. 43 Оскільки, згідно з цим поясненням, підвищення концентрації ефіру повинно збільшити швидкість абстрагування атома водню, щоб дати 7, але не швидкість конкуруючого β-розщеплення, що утворює R ·, більша концентрація ефіру повинна збільшити кількість спирту (ROH), що виробляється на витрата дезоксигенізованого продукту (RH).
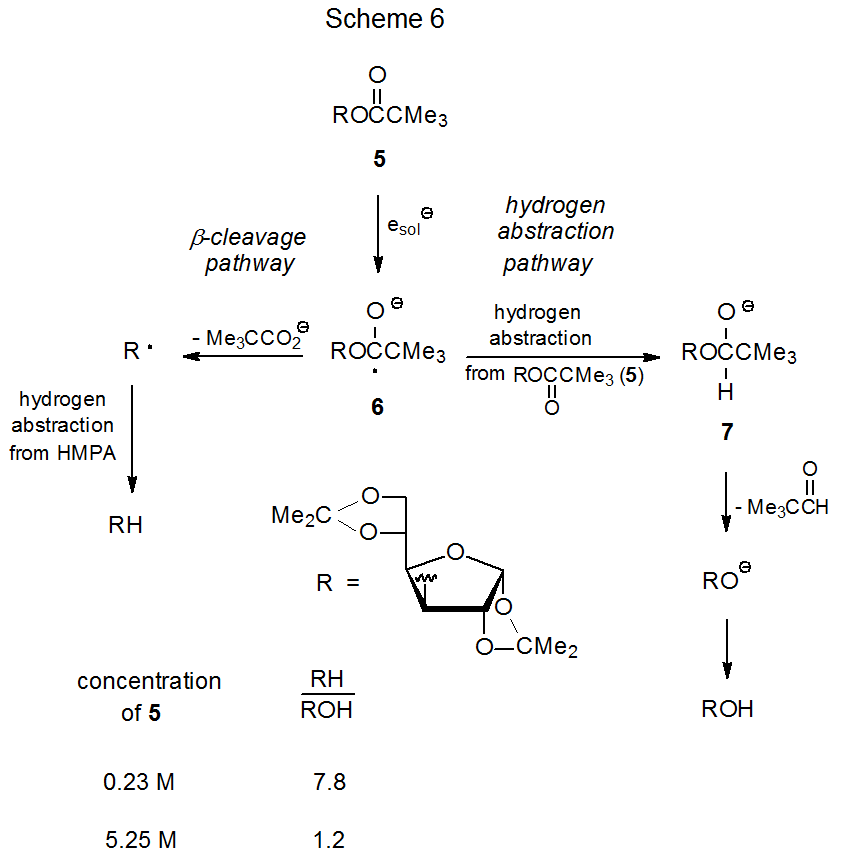
Критичне питання щодо механізму утворення спирту, представленого в схемі 6, стосується того, чи може радикальний аніон 6 абстрагувати атом водню з ефіру 5. Докази, знайдені в еквалайзері 9, підтверджують ідею, що 5 може функціонувати як донор атома водню. Опромінення 5 в HMPa‑d 18 /D 2 O дає 27% вихід 8, продукт відновлення, який не містить дейтерію. Оскільки єдиним джерелом для другого атома водню при С-3 в 8 є один з вуглеводів в реакційній суміші, а оскільки ефір 5 є єдиним вуглеводом, присутнім на початку реакції, абстрагування з 5, принаймні на ранніх стадіях реакції, здається неминучий. Якщо 5 може виступати донором атома водню при утворенні 8, він стає сильним кандидатом на таку ж роль в перетворенні радикального аніона 6 в алкоксид-іон 7 (схема 6).
.png)
3. Конкуренція зі світлопоглинаючими хромофорами
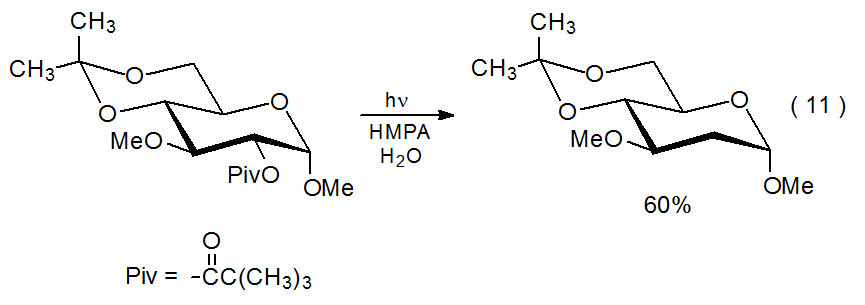
Якщо ефір містить сильно поглинаючий хромофор, збудження HMPA буде ефективно виключено, оскільки більша частина падаючого світла буде поглинена ефіром. Нездатність збуджувати HMPA буде перешкоджати заміні ацилокси-групи атомом водню, запобігаючи перенесенню електронів. Наприклад, світлопоглинаючі властивості бензоїлокси-групи роблять бензоати набагато менш бажаними учасниками цих реакцій передачі електронів, оскільки набагато менше падаючого світла досягає HMPA. Це означає, що важливим фактором реакції простих ацетатів і півалатів є те, що ці сполуки не містять сильно поглинаючого хромофора. 42 Приклад складного ефіру, який не піддається заміні ацилоксигрупи через наявність світлопоглинаючого замісника (тобто групи 4,6- O -бензилідену), показаний в еквалайзері 10. 41 Незважаючи на те, що бензиліденова група видаляється під час фотолізу, ароматичний хромофор залишається в розчині і продовжує поглинати падаюче світло. Зміна 4,6- O -бензилідену на 4,6- O -ізопропіліденовий захист дозволяє реакції протікати нормальним чином (ур. 11). 41
.png)
.png)
Б. м - (трифторметил) бензоати
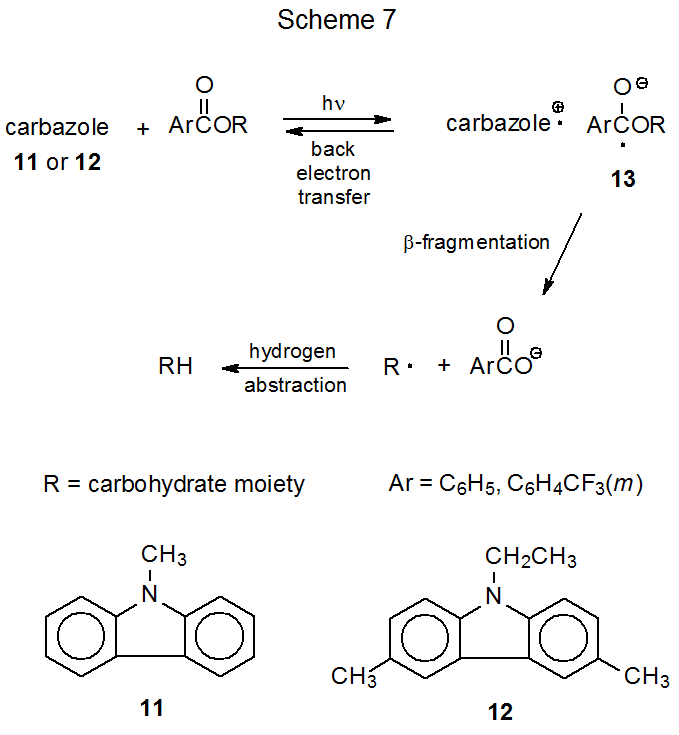
А м - (трифторметил) бензоат прийме електрон від збудженого N ‑метилкарбазолу (11) в реакції, яка призводить до заміни ацилоксигрупи атомом водню; наприклад, фотоліз 2',3',5'-tri- O - [m - (трифторметил) бензоїл] -аденозин (9) виробляє похідне 2',3'-дидезоксиаденозину 10 (екв 12). 46 (Більшість, 46—52, але не всі, 48 сполук, які, як повідомляється, проходять цей тип реакції, є нуклеозидами.) Реакції, такі як показані в еквалайзері 12, є регіоселективними, оскільки радикальний аніон, що утворюється з m - (трифторметил) бензоїльної групи, не фрагментується, щоб дати первинний радикал.
.png)
Фотохімічний перенесення електронів за участю m - (трифторметил) бензоатів і N -метилкарбазолу (11) має ряд переваг перед перенесенням електронів між HMPA і ацетатами або півалатами. Одним з них є те, що N ‑метилкарбазол має більшу молярну абсорбційну здатність, ніж HMPA, що робить вуглеводний реагент менш імовірним, щоб зупинити реакцію, поглинаючи падаюче світло. 52 З точки зору безпеки усунення HMPA з реакційної суміші дозволяє уникнути обробки високотоксичного агента, який підозрює рак. Оскільки m‑ (трифторметил) бензоїльна група є ефективним акцептором електронів (краще, ніж ацетильна або півалоїльна група), мало замісників у вуглеводі будуть конкурувати з цією групою за електрон, донорський збудженим N -метилкарбазолом (11); отже, реакції м - (трифторметил) бензоатів зазвичай є високохемоселективними. Приклад цієї селективності показаний в еквалайзері 13, де бензоїльна група залишається зв'язаною з С-3', тоді як m ‑ (трифторметил) бензоїльна група при C-2' замінена атомом водню. 49
.png)
При проведенні реакції в присутності Mg (ClO 4) 2 можна замінити навіть незаміслену бензоїлокси-групу атомом водню (екв 14 50). 50—52 Перхлорат магнію впливає на цю реакцію, перешкоджаючи зворотному перенесенню електронів, процес, який конкурує з фрагментацією радикального аніону 13 (схема 7). Іншим фактором, що впливає на реакцію бензоїлоксигрупи, є вибір донора електронів; таким чином, заміна N -метилкарбазолу (11) на 3,6-диметил-9-етилкарбазол (12) викликає дезоксигенацію, що відбувається швидше. 50 З'єднання 12 перевершує 11, оскільки при перенесенні електронів утворює більш стабільний радикальний катіон. 50,53,54
.png)