10,8: Алкіни
- Page ID
- 24556
Алкін - це вуглеводневий, який містить потрійний зв'язок CC. У цьому розділі ми розглянемо методи синтезу алкінів і хімічні реакції алкінів.
10.8.1 Кислотність термінальних алкінів та споріднених реакцій
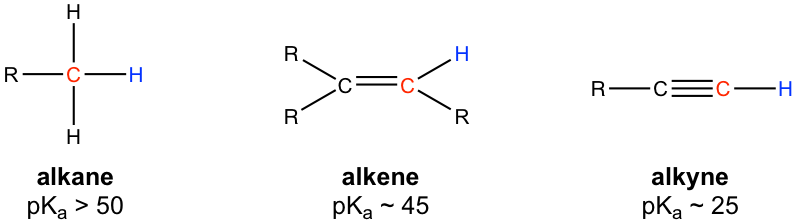
Під час обговорень кислот та основ (глава 3) ми дізналися, що атом водню, пов'язаний з кінцевим алкінним вуглецем, демонструє більш високу кислотність, ніж атоми водню, пов'язані з вуглецями алкена або алкану, а значення pKA кінцевого алкінного водню становить близько 25.
Через відносну високу кислотність кінцеві алкіни можуть депротонуватися відповідними сильними основами, такими як NaH, NaH 2.
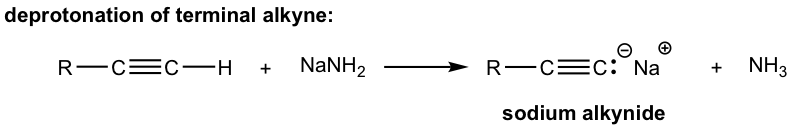
Продукт вищевказаної депротонації, алкінідний аніон, є хорошим нуклеофілом, який можна використовувати в реакції S N 2 з первинними субстратами (оскільки первинні субстрати найкраще працюють для такої реакції S N 2, як ми дізналися):

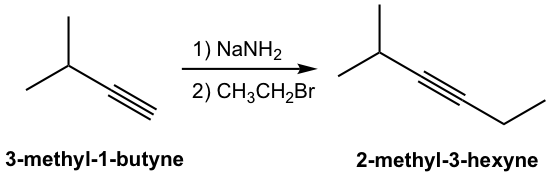
Нова частина вуглецю вводиться в продукт з новою вуглецево-вуглецевою зв'язком, утвореною в реакції S N 2, і це поширений метод синтезу внутрішніх алкінів з більш довгим вуглецевим ланцюгом. Конкретний приклад синтезу 2-метил-3-гексину з 3-метил-1-бутину наведено тут:
Метод в 10.4.1 застосовується до синтезу алкіну з певною структурою. Більш загальний спосіб синтезу алкіну - це реакція елімінації віцинальних дигалоїдів. Нагадаємо, що віцинальні дигалогеніди є продуктами галогенізації алкенів (розділ 10.4). Потім віцинальний дигалогенід може бути підданий подвійній реакції дегідрогалогенізації з сильною основою для отримання алкіну.
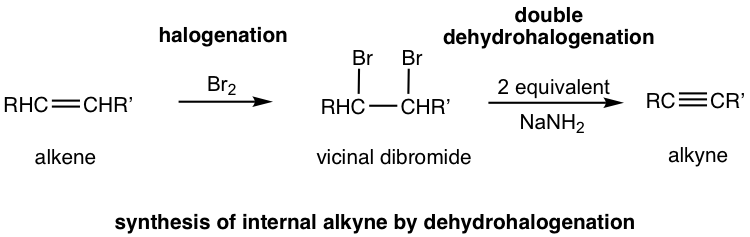
Дегідрогалогенування відбувається двічі, в два етапи, перший продукт - галоалкен, а другий продукт - алкін. Амід, зазвичай NanH2, є основою, яка досить сильна, щоб викликати обидві реакції, що проводяться послідовно в одній суміші. Два молярні еквіваленти аміду натрію на моль дигалоїду необхідні для забезпечення усунення відбувається два рази.

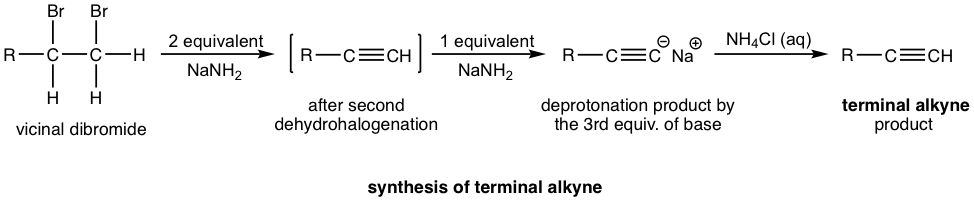
Якщо кінцевий алкін є бажаним продуктом, то потрібні три молярні еквіваленти основи. Термінальний алкін, отриманий після подвійної дегідрогалогенації, депротонується амідом натрію, третій моль основи полягає в тому, щоб забезпечити депротонацію повністю, а весь термінальний алкін перетворений у формат солі. Потім сіль алкініду обробляли хлоридом амонію (або водою, як джерело протона) для отримання кінцевого алкіну як кінцевого бажаного продукту.
Приклади
Розробити шлях синтезу 1-бутину з 1-бутену.
Підхід:
Використовуйте ретро-синтетичний аналіз:
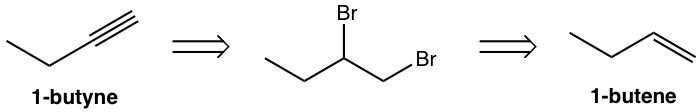
Цей аналіз можна перекласти на покроковий синтез як:
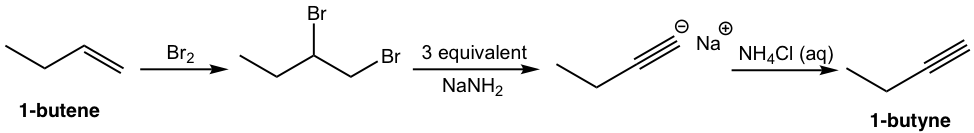
Рішення: (показати кроки разом у належному порядку, не показуючи проміжних продуктів для кожного кроку)
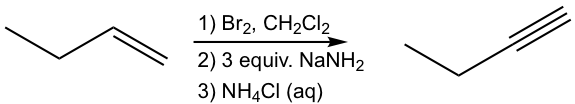
10.8.3 Реакції алкінів
Гідрування алкінів
Каталітичне гідрування застосовується і до π зв'язків потрійних зв'язків CC. Залежно від умов та використовуваних каталізаторів, один або два молярні еквіваленти водню будуть додані до потрійного зв'язку та алкену або алкану, виробленого як продукт відповідно.
При застосуванні платинових або паладієвих каталізаторів кінцевим продуктом гідрування є алкан з достатньою кількістю водню. Вихідним продуктом є алкен, який послідовно проходить реакцію, щоб дати алкан в якості кінцевого продукту.
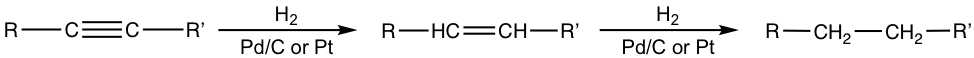
При використанні певного каталізатора гідрування алкіну може бути зупинено на стадії алкену. Найбільш часто використовуваним каталізатором є каталізатор Ліндлар. Ліндлар каталізатор отримують шляхом осадження паладію на карбонат кальцію з подальшою обробкою свинцю (II) ацетату і хіноліном. Спеціальна обробка модифікує поверхню металу паладію, частково деактивуючи його, і робить його більш ефективним при каталізації гідрування до потрійного зв'язку, а не до подвійного зв'язку.
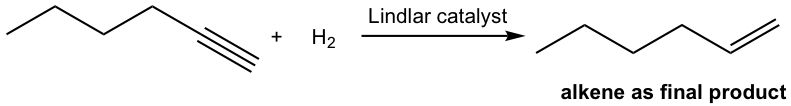
Механізм каталітичного гідрування алкіну майже такий же, як у алкену (10,5). Так як обидва атома водню доставляються з поверхні каталізатора, то вони доставляються в одну і ту ж сторону потрійної зв'язку, тому відбувається син-додавання. Таким чином, гідрування внутрішнього алкіну виробляє цис-алкен з каталізатором Ліндлар.
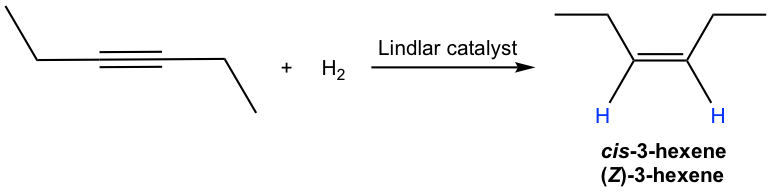
Внутрішній алкін може бути перетворений в транс-алкен за допомогою натрію (або літію) в рідкому аміаку. Механізм цієї реакції включає послідовні одиночні перенесення електронів з металу (натрію або літію) і протонні переноси з аміаку, з радикальними проміжними продуктами. Метал натрію (або літій) швидше реагує з потрійним зв'язком, ніж подвійним зв'язком, тому реакція зупиняється на стадії алкену. Низька температура (-78° C) необхідна для збереження аміаку в рідкому стані.
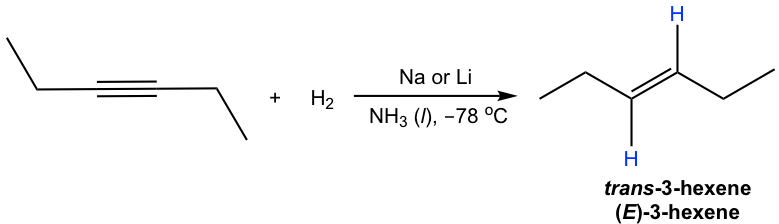
Транс-вініловий аніон утворюється переважно через вищу стабільність з двома R групами далі один від одного. Протонування транс-вінілового аніона призводить до транс-алкену.

Гідрогалогенізація алкінів
Алкін - це багата електронами молекула з високою щільністю pi електронів, тому це хороший нуклеофіл, який легко реагує з електрофілами. При цьому алкіни, як і алкени, також піддаються електрофільному додаванню галогенідом водню.
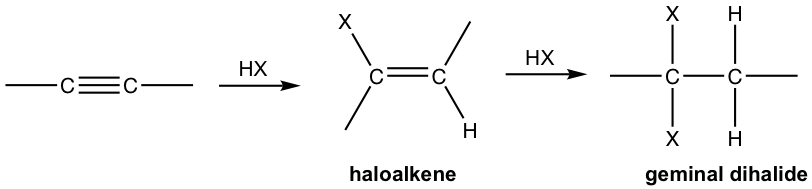
- Алкін реагує з одним молем HX, утворюючи галоалкен, а з двома родимками HX утворюють гемінальні дигалогенні дигалоїди, дигалоїд з обома галогенами, прикріпленими до того ж вуглецю. «Geminal» походить від geminus латинською мовою, що означає «близнюк».
- Обидва доповнення слідують правилу Марковникова в плані регіоселективності.
Якщо один молярний еквівалент HX доступний, додавання може бути припинено при першому додаванні до галоалкену. Галозаміщений алкен менш реактивний, ніж алкін для електрофільного додавання, оскільки галоген-замінник індуктивно виводить електрони, тим самим зменшуючи нуклеофільність подвійного зв'язку.
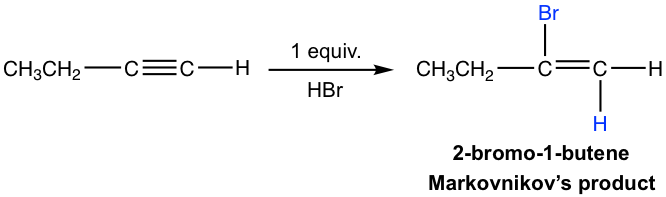
Механізм електрофільного додавання алкіну досить схожий на додавання алкену, причому протонування в якості першого кроку. Для термінального алкіну, якщо протонація відбувається на різному вуглеці з потрійним зв'язком, утворюється первинний або вторинний проміжний вініловий катіон. Більш висока стабільність вторинного вінілового катіону призводить до регіоселективності Марковникова, що атом водню прикріплений до вуглецю, який має більшу кількість атомів водню.

Якщо надлишок гідрогалогеніду присутній, додавання алкіну відбувається двічі, щоб дати галогенід геміналу, що слідують за регіоселективністю Марковникова.
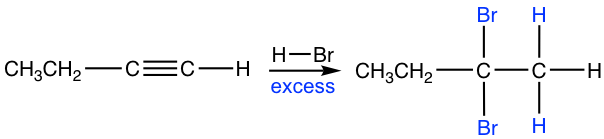
гідратація алкінів
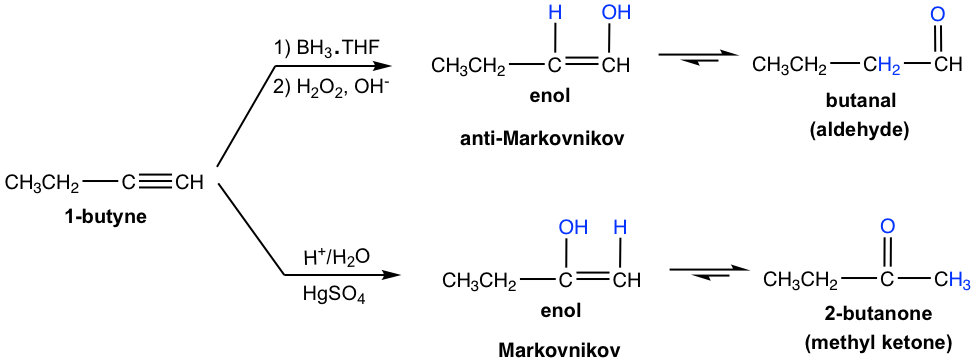
Алкіни також піддаються кислотно-каталізованому додаванню води (гідратації), подібної алкенам. В результаті Н додається до одного вуглецю потрійного зв'язку, а ОН додається до іншого вуглецю з потрійним зв'язком, а утворений продукт називається енолом («en» походить від «ene», що означає подвійний зв'язок, «ол» означає OH група). Енол - це сполука з подвійним зв'язком вуглецево-вуглецевої та OH групою, з'єднаною на одному з вуглецю подвійного зв'язку.
Енол - дуже нестійке з'єднання, воно відразу ж піддається перестановці для отримання більш стійкого карбонільного з'єднання, альдегіду або кетону. Будова карбонільного з'єднання і енолу відрізняються розташуванням подвійного зв'язку і атома водню, і називаються вони таутомерами. Взаємоперетворення між таутомерами називається тавтомеризацією. Механізм не накривається. Енол завжди швидко піддається тавтомеризації через високу стабільність карбонільної сполуки, як показано в загальному способі нижче.

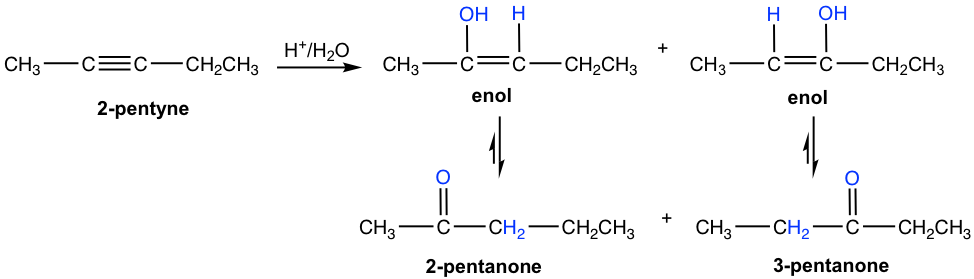
Для симетричного внутрішнього алкіну, який має ту ж групу, прикріплену до кожного з вуглецю потрійного зв'язку (sp), додавання води утворює єдиний кетон як продукт. Як і в ранньому прикладі, що 2-бутанон виробляється з гідратації 2-бутину.
Для несиметричного внутрішнього алкіну з різними групами на кожній з вуглецю потрійного зв'язку утворюється суміш двох кетонів, оскільки початкове додавання протона може відбуватися на будь-якому з вуглеців sp. Тут показано гідратацію 2-пентину, що виробляють суміш 2-пемтанону та 3-пентанону як продукт.
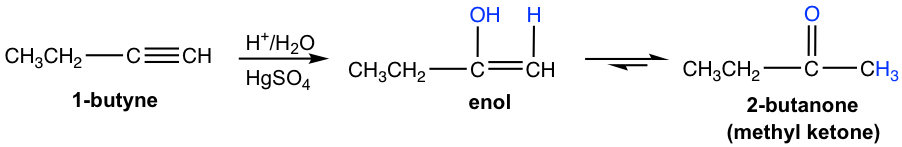
Термінальні алкіни не такі реактивні, як внутрішні алкіни до гідратації. Додавання води до кінцевого алкіну відбудеться, якщо іон ртуті (Hg 2+) присутній як каталізатор. Утворений від додавання енол слідує правилу Марковникова з атомом водню, прикріпленим до кінцевого вуглецю, а метилкетон (кетон з метильною групою, з'єднаний з одного боку зв'язку C = O) є кінцевим продуктом після таутомеризації.
Гідроборація-окислення алкінів:
Гідроборація-окислення також відноситься до алкіну аналогічно алкену. Двоетапний процес призводить до енолу, який проходить через таутомеризацію, щоб дати карбонільну сполуку.
Тим часом додавання борану до термінального алкіну показує ту саму регіоселективність, що і при додаванні борану до алкену. Тобто бор переважно додає до термінального потрійного зв'язку (sp) вуглецю (вуглецю з більшою кількістю атома водню) або кінцевого вуглецю з меншою кількістю замінників. Після окислення борсодержащая група перетворюється в групу ОН, тому енол виробляється антимарковниковим способом, при цьому ОН з'єднаний на клемі вуглець. Таутомеризація такого енолу генерує альдегід в якості кінцевого продукту.
Порівнюючи два методи гідратації алкіну, гідроборація-окислення виробляє альдегід з кінцевого алкіну, тоді як кислотно-каталізована гідратація перетворює термінальний алкін в метилкетон.