4.8: Кислотно-лужна екстракція
- Page ID
- 21347
Як вони працюють
Модифікація екстракцій, розглянутих раніше в цьому розділі, полягає в проведенні хімічної реакції в сепараторній воронці з метою зміни полярності і, отже, поділу сполуки у водному та органічному шарах. Поширеним методом є виконання кислотно-лужної реакції, яка може перетворити деякі сполуки з нейтральних в іонні форми (або навпаки).
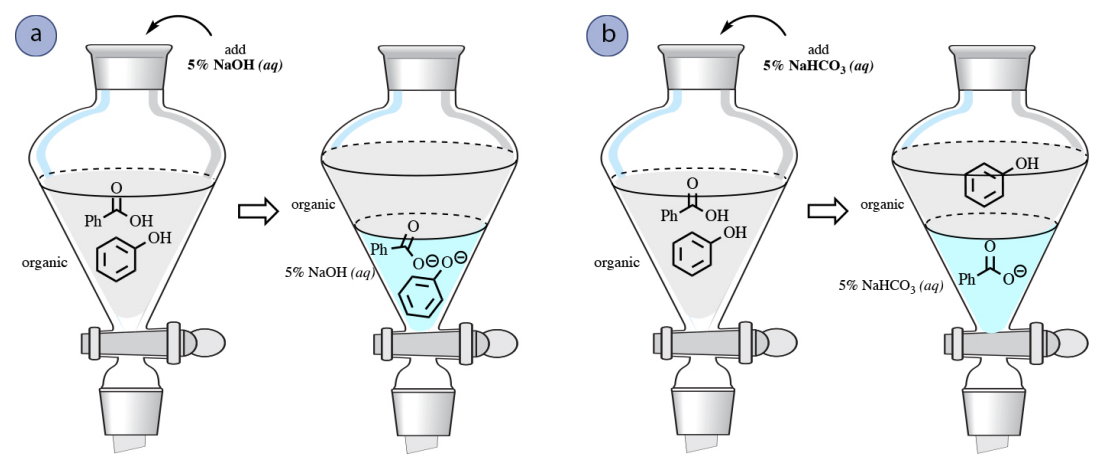
Наприклад, уявіть, що суміш бензойної кислоти і циклогексану розчиняється в органічному розчиннику типу етилацетату в сепараторної воронці. Для відокремлення компонентів можна спробувати видалити бензойну кислоту водою, але бензойна кислота не особливо розчинна у воді через її неполярного ароматичного кільця, і лише невеликі кількості будуть витягнуті у водний шар (рис. 4.54а).
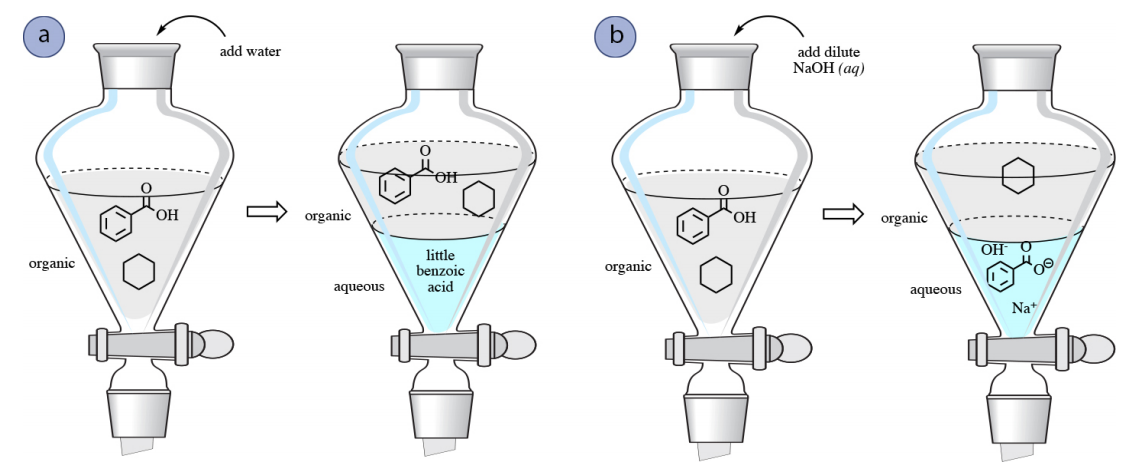
Поділ суміші бензойної кислоти та циклогексану, однак, можливо за допомогою промивання з основою, такою як\(\ce{NaOH}\). Завдяки своїй кислої природи бензойна кислота може піддаватися реакції з\(\ce{NaOH}\) наступним чином, в результаті чого утворюється карбоксилатна сіль бензоат натрію.
\[\begin{array}{ccccccccc} \ce{PhCO_2H} \left( aq \right) & + & \ce{NaOH} \left( aq \right) & \rightarrow & \ce{H_2O} \left( l \right) & + & \ce{PhCO_2Na} \left( aq \right) & & \left( \text{or } \ce{PhCO_2^-} \ce{Na^+} \right) \\ \text{Benzoic acid} & & & & & & \text{Sodium benzoate} & & \end{array}\]
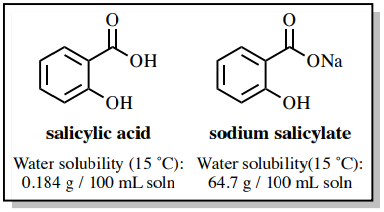
Властивості розчинності карбонових кислот істотно відрізняються від відповідних їм карбоксилатних солей. Саліцилат натрію приблизно в 350 разів більше розчинний у воді, ніж саліцилова кислота через його іонний характер (рис. 4.55), і він досить нерозчинний в органічних розчинниках, таких як діетиловий ефір.
Тому промивання з\(\ce{NaOH}\) перетворить бензойну кислоту в її іонну карбоксилатну форму, яка потім буде більш розчинною у водному шарі, дозволяючи витягувати бензоат натрію у водний шар. Циклогексан залишиться в органічному шарі, оскільки він не має спорідненості до водної фази, а також не може реагувати\(\ce{NaOH}\) ні з чим. Таким чином можна розділити суміш бензойної кислоти і циклогексану (рис. 4.54b). Водний шар може бути пізніше підкислений при\(\ce{HCl} \left( aq \right)\) бажанні перетворити бензойну кислоту назад в нейтральну форму.
Бікарбонат натрію миє
Кислотно-лужна екстракція може бути використана для вилучення карбонових кислот з органічного шару у водний шар. Як обговорювалося в попередньому розділі,\(\ce{NaOH}\) може бути використана для перетворення карбонової кислоти в її більш водорозчинну іонно-карбоксилатну форму. Однак, якщо суміш містить бажану сполуку, яка може вступити в реакцію\(\ce{NaOH}\), слід використовувати більш м'яку основу, таку як бікарбонат натрію. Подібна реакція відбувається:
\[\begin{array}{ccccccccccc} \ce{PhCO_2H} \left( aq \right) & + & \ce{NaHCO_3} \left( aq \right) & \rightarrow & \ce{PhCO_2Na} \left( aq \right) & + & \ce{H_2CO_3} \left( aq \right) & \rightleftharpoons & \ce{H_2O} \left( l \right) & + & \ce{CO_2} \left( g \right) \\ \text{Benzoic acid} & & & & \text{Sodium benzoate} & & & & & & \end{array}\]
Однією з відмінностей використання основи\(\ce{NaHCO_3}\) замість\(\ce{NaOH}\) є те, що побічний продукт вугільної кислоти\(\left( \ce{H_2CO_3} \right)\) може розкладатися на воду і вуглекислий газ. При струшуванні кислотного розчину з бікарбонатом натрію в сепараторній воронці слід подбати про те, щоб обережно крутити і частіше випускати повітря, щоб скинути тиск з газу.
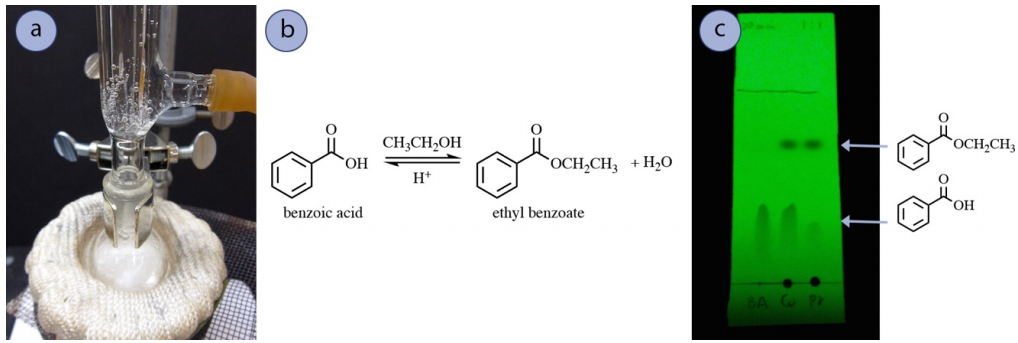
Прикладом реакції, яка часто використовує промивання бікарбонату натрію в роботі є реакція Етерифікації Фішера. Щоб продемонструвати, бензойну кислоту рефлюксивали в етанолі разом з концентрованою сірчаною кислотою з метою утворення етилбензоату (рис. 4.56a+b). Пластинка ТЛК реакційної суміші при 1 годині рефлюксу показала залишкову нереакційовану карбонову кислоту (рис. 4.56с), що не рідкість через енергетику реакції.
Залишкову карбонову кислоту можна видалити з потрібного продукту ефіру за допомогою кислотно-лужної екстракції в сепараторній воронці. Промивання бікарбонатом натрію перетворює бензойну кислоту в її більш водорозчинну форму бензоату натрію, витягуючи її у водний шар (рис. 4.57). Додатково бікарбонат натрію нейтралізує каталітичну кислоту в цій реакції.
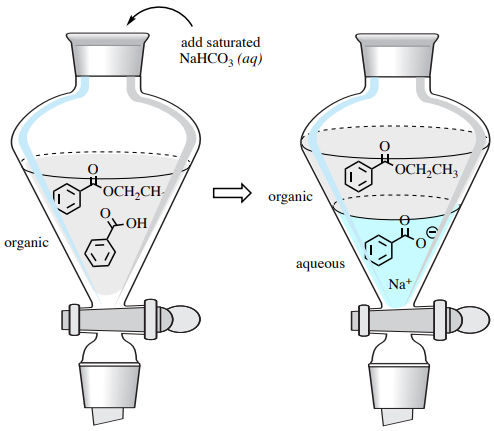
Бікарбонат натрію є кращим, ніж\(\ce{NaOH}\) у цьому процесі, оскільки це набагато слабша основа; промивання з\(\ce{NaOH}\) може спричинити гідроліз ефіру продукту.
Суміші кислот і основ
Як вже говорилося раніше, кислотно-лужні властивості сполук можуть бути використані для вибіркового вилучення певних сполук із сумішей. Цю стратегію можна розширити і на інші приклади
Видобуток основ
Основні сполуки, такі як аміни, можна витягти з органічних розчинів шляхом струшування їх кислими розчинами, щоб перетворити їх у більш водорозчинні солі. Таким способом їх можна витягти з органічного шару у водний шар.
\[\begin{array}{ccccccc} \ce{PhNH_2} \left( aq \right) & + & \ce{HCl} \left( aq \right) & \rightarrow & \ce{PhNH_3Cl} \left( aq \right) & & \left( \text{or } \ce{PhNH_3^+} \ce{Cl^-} \right) \\ \text{Basic amine} & & & & \text{Ammonium salt} & & \end{array}\]
Екстракція карбонових кислот проти фенолів
Як обговорювалося раніше, карбонові кислоти можна витягти з органічного шару у водний шар шляхом струшування їх основними розчинами, що перетворює їх в їх більш водорозчинні солі.
\[\begin{array}{ccccccccc} \ce{PhCO_2H} \left( aq \right) & + & \ce{NaOH} \left( aq \right) & \rightarrow & \ce{H_2O} \left( l \right) & + & \ce{PhCO_2Na} \left( aq \right) & & \left( \text{or } \ce{PhCO_2^-} \ce{Na^+} \right) \\ \text{Carboxylic acid} & & & & & & \text{Carboxylate salt} & & \end{array}\]
Аналогічна реакція відбувається з фенолами\(\left( \ce{PhOH} \right)\), і їх теж можна витягти у водний\(\ce{NaOH}\) шар (рис. 4.58а).
Однак феноли значно менш кислі, ніж карбонові кислоти, і недостатньо кислі, щоб повністю реагувати з\(\ce{NaHCO_3}\), слабшою основою. Тому розчин бікарбонату можна використовувати для поділу сумішей фенолів і карбонових кислот (рис. 4.58б).
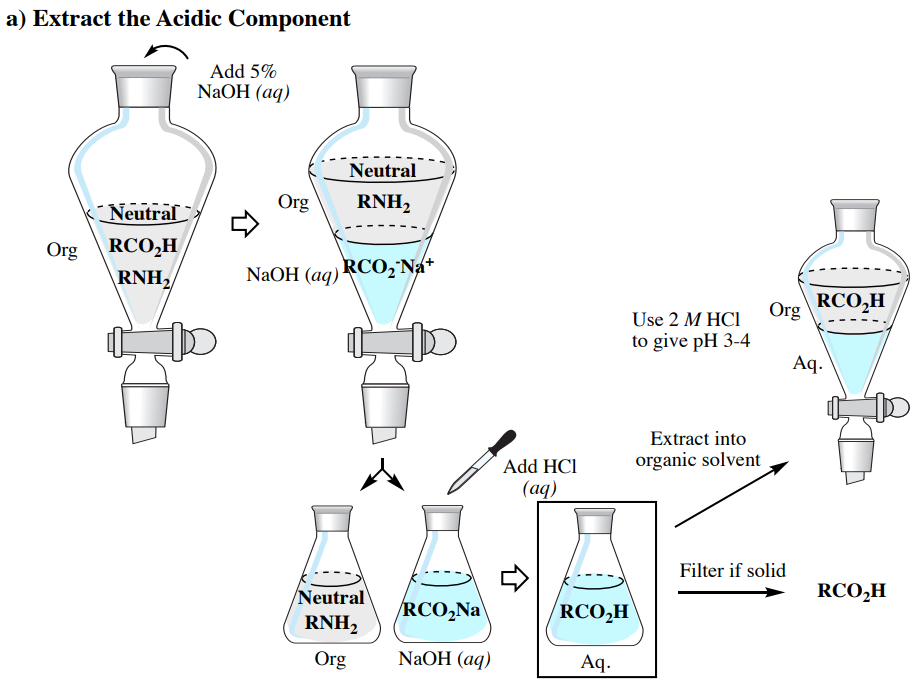
Вилучення кислотних, базових та нейтральних сполук
Розглянуті раніше кислотно-лужні властивості дозволяють очищати суміш, що містить кислі (наприклад\(\ce{RCO_2H}\)), основні (наприклад\(\ce{RNH_2}\)) та нейтральні компоненти, за допомогою серії екстракцій, як узагальнено на малюнку 4.59 (в якому використовується органічний розчинник менш щільний, ніж вода).
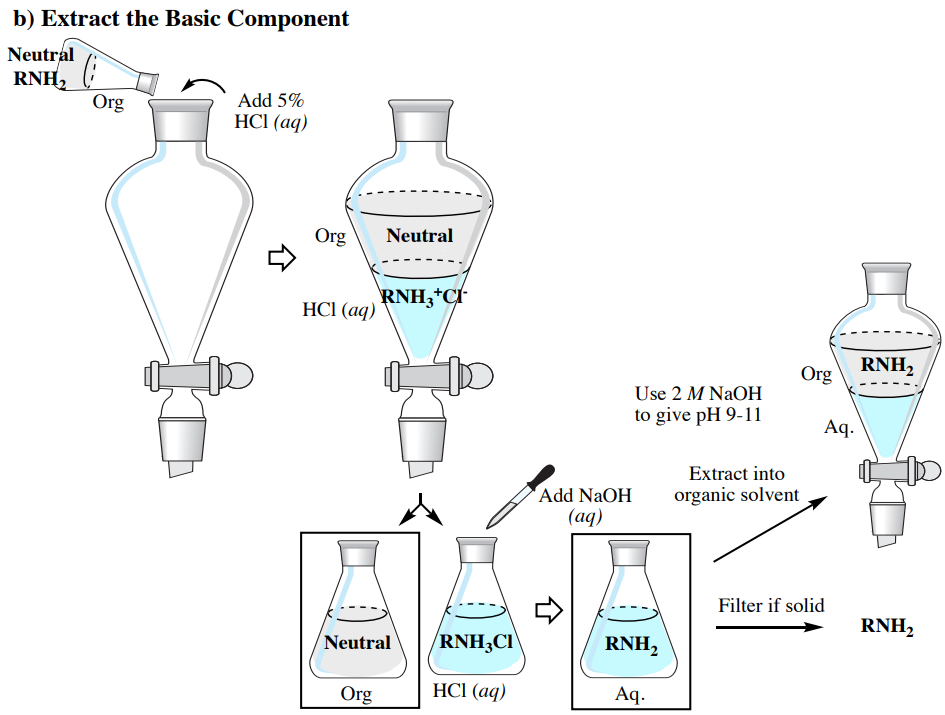
Передбачається, що читачі, які проводять цей тип експерименту, знайомі з виконанням одиночних і багаторазових вилучень. У цьому розділі описані відмінності між загальними процедурами екстракції та процесом, як узагальнено на малюнку 4.59.
- Виділення кислотного компонента:
- Коли кислотний компонент знаходиться у водному шарі в колбі Ерленмейера, його можна перетворити назад в нейтральний компонент шляхом додавання до тих пір,\(2 \: \text{M} \: \ce{HCl} \left( aq \right)\) поки розчин не дасть рН 3-4 (як визначається pH паперу). Якщо велика кількість кислоти присутня така, що підкислення вимагатиме занадто великого обсягу\(2 \: \text{M} \: \ce{HCl} \left( aq \right)\), концентрований\(\ce{HCl} \left( aq \right)\) може бути доданий замість крапель. Більш\(\ce{HCl} \left( aq \right)\) низькі концентрації менш небезпечні, але збільшення обсягу водного шару на велику кількість вплине на ефективність подальших екстракцій і етапів фільтрації.
- Після підкислення можуть бути прийняті два шляхи, в залежності від того, чи є кислий компонент твердим або рідким.
- Якщо тверда речовина утворюється при підкисленні іонної солі, її можна зібрати за допомогою всмоктувальної фільтрації. Цей метод слід застосовувати лише в тому випадку, якщо видно велику кількість кристалів великого розміру. Якщо утворюються дрібні кристали (які досить поширені), вони будуть забивати фільтрувальний папір і заважати достатньому дренажу. Якщо спостерігається лише невелика кількість твердої речовини порівняно з теоретичною кількістю, ймовірно, сполука є досить водорозчинною, і фільтрація призведе до низького відновлення.
- Якщо при підкисленні немає твердих форм (або якщо дрібні кристали або низька кількість твердих форм), витягніть кислотний компонент назад в органічний розчинник (\(\times 3\)). Як правило, використовуйте на третину стільки розчинника для екстракцій, скільки вихідного шару (наприклад, якщо використовуєте\(100 \: \text{mL}\) водний розчин, екстрагуйте\(33 \: \text{mL}\) органічним розчинником кожен раз). Обов'язково спочатку охолодіть водний розчин на крижаній бані перед екстракцією, якщо підкислення створило помітне тепло. Слідкуйте за допомогою розсолу (\(\times 1\)), якщо використовуєте діетиловий ефір або етилацетат, висушіть сушильним агентом та видаліть розчинник через ротаційний випарник, щоб залишити чистий кислий компонент.
- Ізоляція базового компонента:
- Використовуйте аналогічний процес, як виділення кислотного компонента, за винятком основи розчину за допомогою,\(2 \: \text{M} \: \ce{NaOH} \left( aq \right)\) поки він не дасть рН 9-10, як визначається pH паперу.
- Ізоляція нейтрального компонента:
- Нейтральним компонентом буде «залишки» з'єднання в органічному шарі. Для ізоляції промийте розсолом (\(\times 1\)), якщо використовуєте діетиловий ефір або етилацетат, висушіть сушильним агентом та видаліть розчинник через ротаційний випарник, щоб залишити чистий нейтральний компонент.
