4.5: Теорія видобутку
- Page ID
- 21321
Коефіцієнт розділу/розподілу\(\left( K \right)\)
Коли розчин поміщають в сепараторну воронку і струшують з незмішуваним розчинником, розчинені речовини часто розчиняються частково в обидва шари. Кажуть, що компоненти «розділяють» між двома шарами або «розподіляють себе» між двома шарами. Коли рівновага встановилася, співвідношення концентрації розчиненої речовини в кожному шарі є постійним для кожної системи, і це може бути представлено величиною\(K\) (називається коефіцієнтом поділу або коефіцієнтом розподілу).
\[K = \dfrac{\text{Molarity in organic phase}}{\text{Molarity in aqueous phase}}\]
Наприклад, морфін має коефіцієнт поділу приблизно 6 в етилацетаті і воді. \(^2\)Якщо темні кола представляють молекули\(1.00 \: \text{g}\) морфіну, морфіну розподілятимуть себе, як показано на малюнку 4.11.
![Діаграма морфіну поруч з діаграмою поділу. Зображення A: 50 мілілітрів етилацетату вище 50 мілілітрів води в колбі, чорні точки (що представляють собою морфін) розчинені в обох. Нижче рівняння читає K = [морфін] етилацетат/[морфін] вода = 0,0600 Молі/0,0101 Молі = 5,95. B: 25 мілілітрів етилацетату понад 50 мілілітрів води в колбі, чорні точки в обох. Нижче рівняння читає K = 0,105 молі понад 0,0177 моль = 5,93.](https://chem.libretexts.org/@api/deki/files/126150/Nichols_Screenshot_4-4-1.png)
Відзначимо, що при рівних обсягах органічної і водної фаз коефіцієнт поділу представляє співвідношення частинок в кожному шарі (рис. 4.11а). При використанні рівних обсягів, а\(K\)\(\sim 6\) означає, що в органічному шарі буде в шість разів більше молекул морфіну, ніж у водному шарі. Співвідношення частинок не таке просте, коли обсяги шару різні, але співвідношення концентрацій завжди дорівнює\(K\) (рис. 4.11b).
Коефіцієнти поділу відображають розчинність сполуки в органічному та водному шарах, і тому залежать від використовуваної системи розчинників. Наприклад, морфін має\(K\) приблизно 2 в петролейному ефірі та воді, а\(K\) приблизно 0,33 в діетиловому ефірі та воді. \(^2\)Коли менше\(K\) одиниці, це означає, що з'єднання перегороджує у водний шар більше, ніж органічний шар.
Вибір розчинника з даними про розчинність
Коефіцієнт поділу\(K\) - це відношення концентрації сполуки в органічному шарі в порівнянні з водним шаром. Фактичні коефіцієнти поділу є експериментальними, але їх можна оцінити за допомогою даних розчинності.
\[\begin{align} K &= \dfrac{\text{Molarity in organic phase}}{\text{Molarity in aqueous phase}} \\[4pt] & \approx \dfrac{\text{Solubility in organic phase}}{\text{Solubility in aqueous phase}} \end{align}\]
\(K\)Обчислені за значеннями молярності та розчинності не є ідентичними, оскільки задіяні різні рівноваги. Істинне\(K\) являє рівновагу між водними та органічними розчинами, тоді як дані про розчинність представляють рівновагу між насиченим розчином і твердою фазою. Однак ці дві системи пов'язані між собою, і\(K\) отримані від даних розчинності повинні бути подібними до\(K\) фактичних.
| Розчинник | 1 г кофеїну розчиняється в розчиннику (при 25° C) |
|---|---|
| вода | 45 мл |
| Діетиловий ефір | 530 мл |
| Бензол | 100 мл |
| Хлороформ | 5,5 мл |
Таким чином, дані про розчинність можуть бути використані для вибору відповідного розчинника для екстракції. Наприклад, уявіть, що кофеїн (рис. 4.12) призначений для екстрагування з чайної гущі в киплячу воду, а потім екстрагування в органічний розчинник. Дані про розчинність кофеїну наведені в таблиці 4.2.

Як діетиловий ефір, так і бензол на перший погляд здаються поганим вибором для екстракції, оскільки кофеїн більш розчинний у воді, ніж у будь-якому розчиннику (якщо грам кофеїну розчиняється у\(46 \: \text{mL}\) воді, але\(100 \: \text{mL}\) бензолу, кофеїн більш розчинний у воді). При видобутку будь-яким із цих розчинників, це\(K\) було б менше одного (див. Розрахунок нижче), і це буде «важка битва», щоб витягнути кофеїн з води. Однак кофеїн більш розчинний у хлороформі, ніж у воді, тому хлороформ був би найкращим вибором розчинників, показаних з точки зору максимальної екстракції кофеїну.
\[\begin{align} K_\text{benzene} &\sim \dfrac{\left( \dfrac{1 \: \text{g caffeine}}{100 \: \text{mL benzene}} \right)}{\left( \dfrac{1 \: \text{g caffeine}}{46 \: \text{mL water}} \right)} \sim 0.46 \\[4pt] K_\text{chloroform} &\sim \dfrac{\left( \dfrac{1 \: \text{g caffeine}}{5.5 \: \text{mL chloroform}} \right)}{\left( \dfrac{1 \: \text{g caffeine}}{46 \: \text{mL water}} \right)} \sim 8.4 \end{align}\]
Іншим міркуванням при виборі розчинника для екстракції є токсичність: хлороформ є канцерогенним і тому, мабуть, не найкращий варіант, незважаючи на його чудову сольватуючу здатність. Подальшим розглядом є розчинність інших компонентів, присутніх в суміші. Якщо мета полягає в тому, щоб переважно витягти кофеїн і залишити після себе інші компоненти в чаї, один розчинник може бути більш вибірковим у цьому відношенні.
Кількісне визначення одиничного видобутку
Гіосціамін - алкалоїд з рослини сімейства пасльонових (рис. 4.13а), і застосовується в медицині для надання полегшення при різних шлунково-кишкових розладах. Дані про його розчинність наведені на малюнку 4.13b.
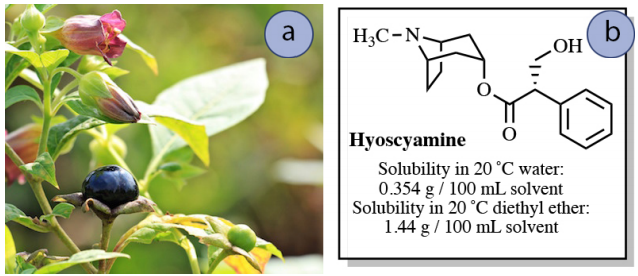
Уявіть, що майже насичений розчин \(0.50 \: \text{g}\)гіосціаміну у\(150 \: \text{mL}\) воді повинен бути витягнутий в\(150 \: \text{mL}\) діетиловий ефір. Скільки гіосціаміну буде витягнуто в шар діетилового ефіру в цьому процесі?
Цю величину можна наблизити за допомогою даних про розчинність. Взяття співвідношення розчинності сполуки в діетиловому ефірі порівняно з водою дає приблизне\(K\) значення 4.
\[\begin{align} K &\sim \dfrac{\text{organic solubility}}{\text{water solubility}} \\[4pt] &\sim \dfrac{\left( 1.44 \: \text{g hyoscyamine}/100 \: \text{mL diethyl ether} \right)}{\left( 0.354 \: \text{g hyoscyamine}/100 \: \text{mL water} \right)} \\[4pt] &\sim \textbf{4.07} \: \text{(approximate} K \text{)} \end{align}\]
Якщо "\(x\)" - грамова кількість гіосціаміну, витягнутого в шар діетилового ефіру, то "\(0.50 \: \text{g} - x\)" залишиться у водному шарі після встановлення рівноваги. Знаючи значення\(K\), значення\(x\) можна вирішити за допомогою рівняння нижче.
\[4.07 = \dfrac{\left( \dfrac{x}{150 \: \text{mL ether}} \right)}{\left( \dfrac{0.50 \: \text{g} - x}{150 \: \text{mL water}} \right)}\]
Після розв'язання алгебри,\(x = \textbf{0.40 g}\). Цей результат означає, що\(0.40 \: \text{g}\) оригінал\(0.50 \: \text{g}\) гіосціаміну витягується в діетиловий ефір за допомогою однієї екстракції. Цей процес узагальнено на малюнку 4.14.
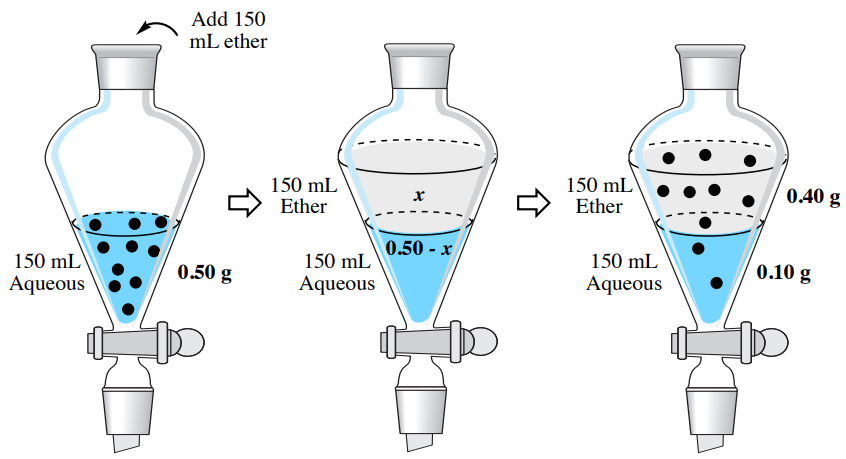
У цьому прикладі одноразова екстракція призвела до\(80\%\) екстракції гіосціаміну\(\left( 100\% \times 0.40 \: \text{g}/0.50 \: \text{g} \right)\) з водного шару в органічний шар. Розбиття з'єднання між двома шарами призвело до неповного вилучення зразка.
Кілька вилучень
Огляд декількох вилучень
Залежно від коефіцієнта поділу з'єднання в розчиннику, одноразова екстракція може бути все, що потрібно для ефективного вилучення сполуки. Однак частіше за все процедура вимагає, щоб рішення було витягнуто кілька разів, щоб виділити потрібну сполуку, оскільки цей метод є більш ефективним, ніж одноразове вилучення (див. Статтю журналу на рис. 4.15b для прикладу того, де цей процес використовується).

У процедурі багаторазового екстракції кількість розчинника використовується для вилучення одного шару (часто водного шару) кілька разів поспіль. Екстракція повторюється два-три рази, або, можливо, більше разів, якщо сполука має низький коефіцієнт розподілу в органічному розчиннику. На малюнку 4.16 показана схема водного розчину, екстрагованого двічі діетиловим ефіром. Діетиловий ефір має щільність менше\(1 \: \text{g/mL}\), ніж, так і верхній органічний шар в воронці.
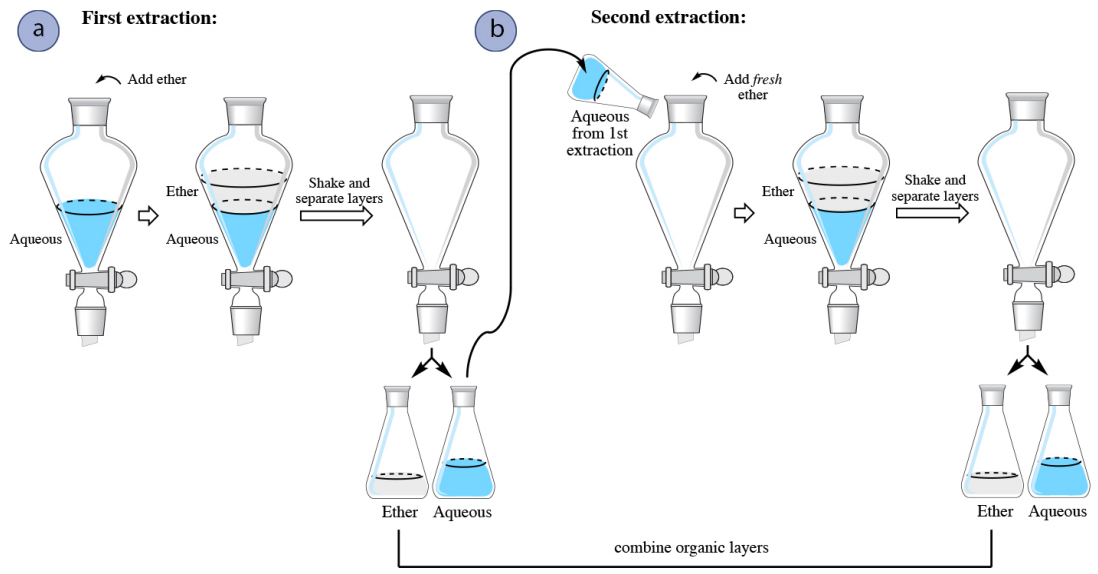
При багаторазовому вилученні водного шару перша екстракція процедурно ідентична одній екстракції. При другій екстракції водний шар з першої екстракції повертається в сепараторну воронку (рис. 4.16б), з метою вилучення додаткового з'єднання. Оскільки органічний шар з першого видобутку вже досяг рівноваги з водним шаром, було б мало користі повернути його в сепараторну воронку і знову піддати водному шару. Замість цього до водного шару додають свіжий діетиловий ефір, оскільки він має потенціал для вилучення більшої кількості сполук.
Процес часто повторюється з третьою екстракцією (не показана на малюнку 4.16), при цьому водний шар з другої екстракції повертається в сепараторну воронку з подальшою порцією свіжого органічного розчинника. При багаторазових екстракціях органічні шари об'єднуються разом, оскільки метою є вилучення сполуки в органічний розчинник.
Коли водний розчин екстрагують органічним розчинником, щільнішим за воду (наприклад, дихлорметан\(\ce{CH_2Cl_2}\)), єдина процедурна відмінність полягає в тому, що немає необхідності коли-небудь зливати водний шар з сепараторної воронки. Після зливу органічного шару з першої екстракції свіжий розчинник може бути доданий до водного шару, що залишився в воронці, щоб почати другу екстракцію (рис. 4.17b).
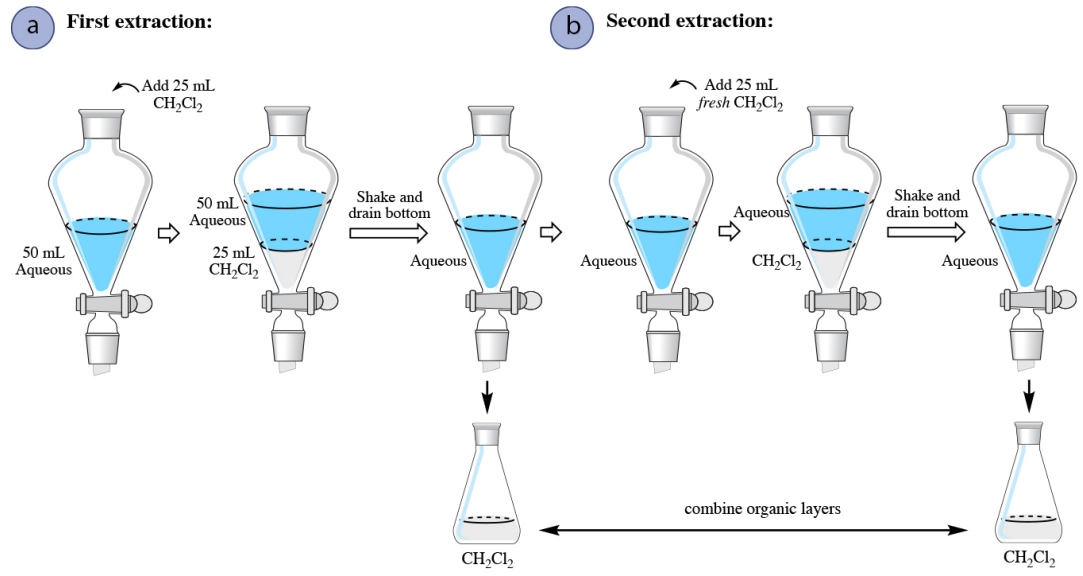
Кількісне багаторазове видобуток
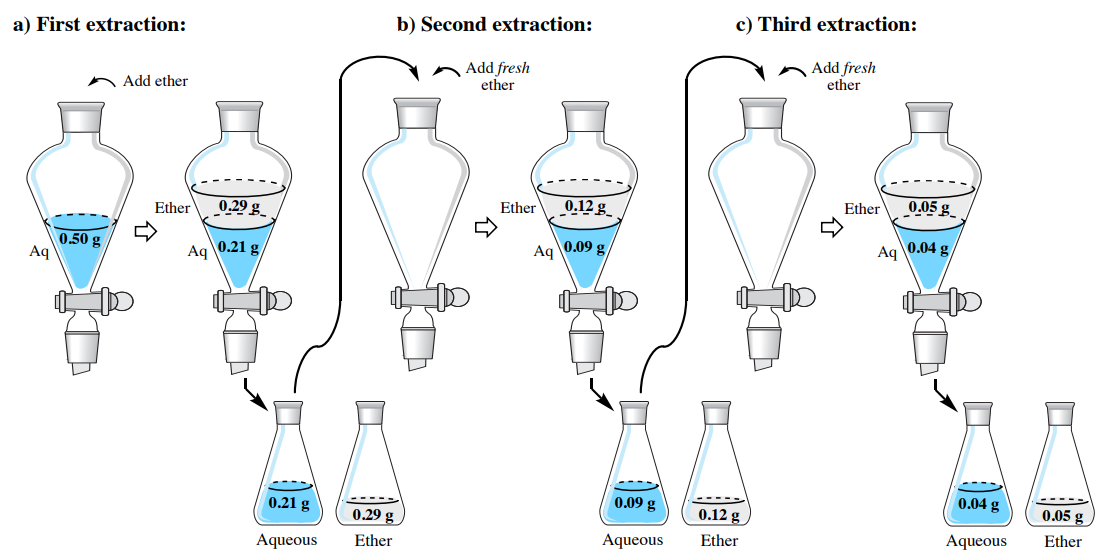
Щоб продемонструвати ефективність багаторазового екстракції, повернемося до проблеми з однієї секції екстракції, де розчин \(0.50 \: \text{g}\)гіосціаміну у\(150 \: \text{mL}\) воді повинен бути екстрагований в діетиловий ефір. Замість того, щоб використовувати одну\(150 \: \text{mL}\) порцію, давайте замість цього розбиваємо розчинник на три\(50 \: \text{mL}\) порції діетилового ефіру. Скільки гіосціаміну буде витягнуто за допомогою цього методу?
У попередньому розділі для оцінки коефіцієнта поділу використовувались дані розчинності\(K\), і було встановлено, що він дорівнює 4,07. Як і раніше, ми можемо призначити кількості гіосціаміну, витягнутого в діетиловий ефір, значення "\(x\)«, яке залишило б\(0.50 \: \text{g} - x\)" "залишатися у водному шарі першої екстракції. Використовуючи\(K\), розрахунок ідентичний попередньому обговоренню, відрізняючись лише меншим обсягом органічного шару (\(50 \: \text{mL}\)замість\(150 \: \text{mL}\)).
\[4.07 = \dfrac{\left( \dfrac{x}{50 \: \text{mL ether}} \right)}{\left( \dfrac{0.50 \: \text{g} - x}{150 \: \text{mL water}} \right)}\]
Після розв'язання алгебри,\(x = 0.29 \: \text{g}\). Цей результат означає, що\(0.29 \: \text{g}\) витягується в діетиловий ефір при першій екстракції і\(0.21 \: \text{g}\) залишається у водному шарі\(\left( 0.50 \: \text{g} - 0.29 \: \text{g} \right)\). Коли водний шар повертається в сепараторну воронку, залишок\(0.21 \: \text{g}\) - це кількість, яку потрібно додатково витягти, що змінює розрахунок для другої екстракції шляхом заміни\(0.50 \: \text{g}\) значення.
\[4.07 = \dfrac{\left( \dfrac{x}{50 \: \text{mL ether}} \right)}{\left( \dfrac{0.21 \: \text{g} - x}{150 \: \text{mL water}} \right)}\]
Після розв'язання алгебри,\(x = 0.12 \: \text{g}\). Цей результат означає, що\(0.12 \: \text{g}\) витягується в діетиловий ефір при другій екстракції і\(0.09 \: \text{g}\) залишається у водному шарі\(\left( 0.21 \: \text{g} - 0.12 \: \text{g} \right)\). Розрахунок для третьої видобутку виглядає наступним чином:
\[4.07 = \dfrac{\left( \dfrac{x}{50 \: \text{mL ether}} \right)}{\left( \dfrac{0.09 \: \text{g} - x}{150 \: \text{mL water}} \right)}\]
Після розв'язання алгебри,\(x = 0.05 \: \text{g}\). Цей результат кошти\(0.04 \: \text{g}\) залишається у водному шарі\(\left( 0.09 \: \text{g} - 0.05 \: \text{g} \right)\) після третьої екстракції. Результати розрахунків в цьому розділі зведені на малюнку 4.18.
Якщо екстракти\(50 \: \text{mL}\) діетилового ефіру об'єднані в цьому прикладі (рис. 4.19), в комбінованих органічних екстрактах буде загальна кількість гіосціаміну.\(0.46 \: \text{g}\) З\(0.50 \: \text{g}\) гіосциаміну в вихідному водному \(92\%\)шарі матеріал витягується в органічний шар\(\left( 100\% \times 0.46 \: \text{g}/0.50 \: \text{g} \right)\). Це більша кількість, ніж було отримано за допомогою одноразового екстракції\(150 \: \text{mL}\) діетилового ефіру, в результаті чого екстрагували лише\(0.40 \: \text{g}\) гіосціамін (\(80\%\)).
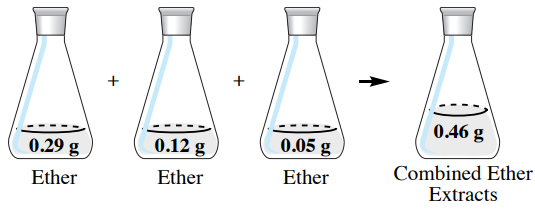
Ці розрахунки демонструють, що використання декількох порцій розчинника максимізує екстрактивну потужність розчинника. Загалом, три екстракції є оптимальним компромісом між витраченими зусиллями і максимальним відновленням матеріалу.
\(^2\)Коефіцієнти поділу були апроксимовані за допомогою даних розчинності, знайдених у: A. Seidell, Розчинності неорганічних та органічних речовин, Д. Компанія Ностранд, 1907 р.
\(^3\)Від: Індекс Мерка,\(^\text{th}\) видання 12, Дослідницькі лабораторії Merck, 1996.
