4.7: Реакційні тренування
- Page ID
- 21337
Мета роботи
Коли метою експерименту є проведення реакції і виділення продукту, загальна послідовність подій показана в таблиці 4.4.
 |
 |
 |
 |
| а) Провести реакцію. | б) Виконайте багаторазові вилучення та/або промивання, щоб частково очистити бажаний продукт. | в) Видаліть сліди води за допомогою сушильного агента. г) Фільтрувати або зціджувати сушильний агент. |
д) Видалити розчинник за допомогою роторного випарника f) При необхідності додатково очистити. |
Ключовий етап в цій послідовності настає відразу після завершення реакції, і називається реакцією «відпрацювання» (крок b) в табл. 4.4). Обробка відноситься до методів, спрямованих на очищення матеріалу, і найчастіше відбуваються в сепараторної воронці. Розчини додають в воронку для вилучення або промивання суміші, з метою виділення продукту від надлишків реагентів, каталізаторів, побічних продуктів, розчинників або сполук, що утворюються в результаті побічних реакцій.
Загальні мийки
Вода
Найпоширеніша промивка в сепараторних воронках - це, мабуть, вода. Вода дешева, безпечна, і добре працює для видалення будь-яких домішок, знайдених поряд з бажаним продуктом.
Вода потенційно може видаляти водорозчинні домішки з органічного шару, якщо вони присутні в кількостях, які не перевищують їх розчинність у воді. Нижче наведено загальні матеріали, які можна видалити за допомогою промивання водою: неспоживана кислота або основа, багато іонних солей та сполуки, які можуть зв'язуватися з водою (мають атом кисню або азоту) і відносно невеликі (наприклад,\(\ce{CH_3CH_2OH}\) або\(\ce{CH_3COCH_3}\)).
Щоб продемонструвати ефективність промивання водою, була проведена реакція етерифікації Фішера для отримання ізоамілацетату (рис. 4.38). У цій реакції надлишок оцтової кислоти використовується для приводу реакції за принципом Ле Шательє, і оцтову кислоту довелося видалити з продукту в процесі очищення.
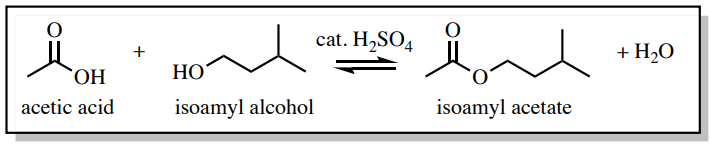
Спектр\(\ce{^1H}\) ЯМР на малюнку 4.39а був взятий з реакційної суміші відразу після припинення нагрівання та перед роботою. Як і очікувалося, значний сигнал для оцтової кислоти видно при\(2.097 \: \text{ppm}\).
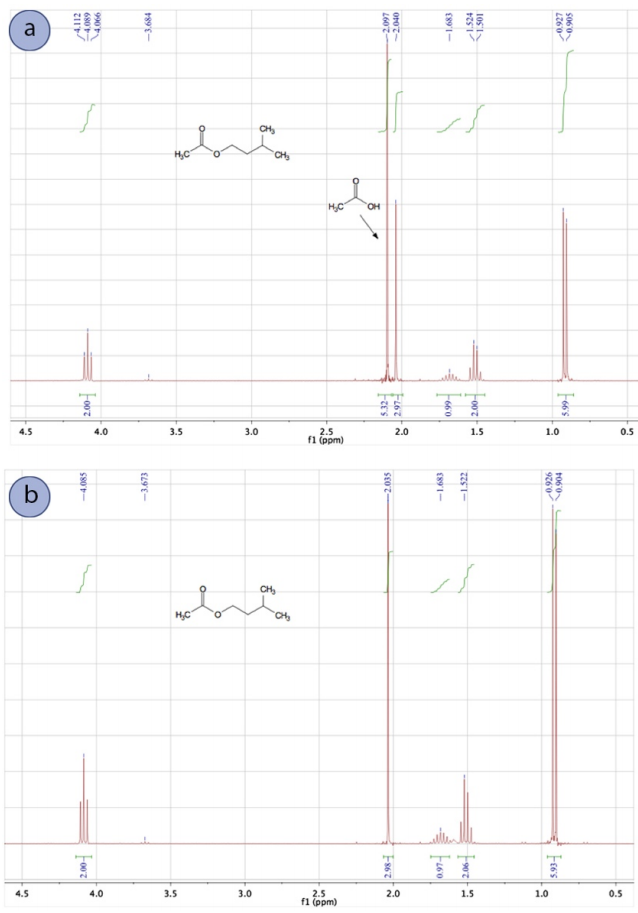
Потім реакцію «опрацьовували» шляхом заливки реакційної суміші в сепараторну воронку і послідовно промиваючи органічний шар водою, бікарбонатом натрію та розсолом. Основною метою промивання водою було видалення більшої частини каталітичної сірчаної кислоти та надлишку оцтової кислоти, тоді як промивка бікарбонату натрію нейтралізувала решту. Спектр\(\ce{^1H}\) ЯМР кінцевого продукту (рис. 4.39b) показав, що промивки були ефективними, оскільки сигнал оцтової кислоти при\(2.097 \: \text{ppm}\) відсутня.
Промивання бікарбонатом натрію в цьому прикладі було необхідним (і обговорювалося в наступному розділі), оскільки одна промивка водою може не повністю видалити оцтову кислоту. Важливо знати, що коли сполука «розчинна у воді», це не обов'язково означає, що вона «органічна нерозчинна», поширена помилка, яка виникає з принципу «подібне розчиняється, як». Наприклад, оцтова кислота має\(K\) 0,5 при розподілі між діетиловим ефіром та водою, тобто оцтова кислота сприяє водному шару лише вдвічі більше, ніж органічний шар. \(^4\)Не слід ігнорувати здатність оцтової кислоти та інших полярних сполук розчинятися в органічному шарі сепараторної воронки.
Бікарбонат натрію і карбонат натрію
Як вони працюють
Нормальна частина багатьох тренувань включає нейтралізацію. Важливо нейтралізувати будь-який органічний розчинник, який піддавався впливу кислотного або основного розчину, оскільки сліди кислоти або основи можуть викликати небажані реакції при концентруванні розчинів. Також зразки, призначені для аналізу ГК, повинні бути нейтральними, оскільки кислі розчини погіршують полімерне покриття колонки ГК. Крім того, краще маніпулювати нейтральними матеріалами, а не кислими або основними, оскільки тоді розливи менш небезпечні.
Водні розчини насиченого бікарбонату натрію\(\left( \ce{NaHCO_3} \right)\) і карбонату натрію\(\left( \ce{Na_2CO_3} \right)\) є основними, і метою цих промивань є нейтралізація органічного шару, який може містити сліди кислих компонентів. Навіть якщо органічний шар теоретично не повинен розчиняти дуже полярні компоненти, такі як кислота, кислота іноді «катається» на полярних компонентах, які можуть розчинятися в органічному шарі, наприклад, невеликій кількості спиртів або води.

\(\left( \ce{H^+} \right)\)Під час прання між іоном бікарбонату (1), карбонатним іоном (2) та кислотою відбуваються такі реакції:
\[\ce{HCO_3^-} \left( aq \right) + \ce{H^+} \left( aq \right) \rightarrow \ce{H_2CO_3} \left( aq \right) \rightleftharpoons \ce{H_2O} \left( l \right) + \ce{CO_2} \left( g \right) \tag{1}\]
\[\ce{CO_3^{2-}} \left( aq \right) + \ce{H^+} \left( aq \right) \rightarrow \ce{HCO_3^-} \left( aq \right) \tag{2}\]
Вихідним продуктом реакції (1) є вугільна кислота\(\left( \ce{H_2CO_3} \right)\), яка знаходиться в рівновазі з водою і газом вуглекислого газу. Це означає, що розчини бікарбонату часто пузириться під час нейтралізації промивання в сепараторній воронці. Продукт реакції (2) - іон бікарбонату, який згодом може піддаватися реакції (1). Це означає, що розчини карбонатних іонів також часто пузириться під час нейтралізації.
Примітка з безпеки: Щоб запобігти утворенню надлишкового тиску в результаті виділення вуглекислого газу в сепараторну воронку під час нейтралізації, шари повинні бути обережно закручені разом перед розміщенням пробки. Їх слід вентилювати безпосередньо після інверсії, причому частіше, ніж зазвичай. На малюнку 4.41 показаний сильнокислий органічний шар (зверху), що контактує з водним розчином бікарбонату\(10\%\) натрію (знизу). Енергійний потік бульбашок видно, що походить від невеликої частини органічного шару, захопленого на дні воронки. Барботаж був ще більш енергійним, коли шари змішувалися між собою.

Тестування рН після прання
Щоб перевірити, чи була базова промивка з\(\ce{NaHCO_3}\) або\(\ce{Na_2CO_3}\) була ефективною при видаленні всієї кислоти з органічного шару, корисно перевірити рН. Неможливо перевірити рН органічного розчину безпосередньо, однак можна перевірити рН водного розчину, з яким стикався органічний розчин. Якщо водний шар знаходиться у верхній частині роздільної воронки, вставте скляний перемішувальний стрижень у верхній шар і торкніться мокрого стрижня до синього лакмусового паперу. Кислий розчин перетворює блакитний лакмусовий папір рожевого кольору (або червоного кольору), тоді як нейтральний або базовий розчин надає блакитному лакмусовому папері тільки затемнений «мокрий» вигляд (рис. 4.42д). Якщо лакмусовий папір зовсім рожевіє\(^5\), то промивка основи не повністю нейтралізувала органічний шар, і необхідні подальші промивання основи.
Якщо водний шар знаходиться на дні сепараторної воронки, протестуйте «аліквоту» водного шару (або крихітного зразка) на лакмусовому папері наступним методом:

- Пальцем, поміщеним поверх скляної піпетки, вставте піпетку в роздільну воронку так, щоб наконечник розташовувався в нижньому водному шарі (рис. 4.42а).
- Видаліть палець на піпетці, щоб проба водного шару потрапила в піпетку через капілярну дію (рис. 4.42б).
- Пальцем, поміщеним поверх скляної піпетки, знову вийміть піпетку з роздільної воронки. У наконечнику піпетки повинно залишитися трохи рідини, аліквота нижнього шару (рис. 4.42в).
- Доторкніться аліквота до блакитного лакмусового паперу і спостерігайте за кольором (рис. 4.42д).
- Якщо лакмусовий папір зовсім рожевіє, то промивка основи не повністю нейтралізувала органічний шар, і необхідні подальші промивання основи.
Розсіл (Насичений\(\ce{NaCl}\))
У деяких експериментах органічний шар може бути промитий розсолом, який є насиченим розчином\(\ce{NaCl} \left( aq \right)\). Мета цього миття - видалити велику кількість води, яка може бути розчинена в органічному шарі. Хоча органічний шар завжди слід пізніше піддавати впливу сушильного агента (наприклад, безводного сульфату натрію, сульфату магнію або хлориду кальцію), ці реагенти в кращому випадку видаляють лише невелику кількість води.

Органічними розчинниками, які потребують промивання розсолом перед впливом твердого сушильного агента, є діетиловий ефір та етилацетат. Ці розчинники розчиняють велику кількість води в порівнянні з іншими розчинниками (табл. 4.5).
| Розчинник | Грам води, розчиненої в 100 мл розчинника |
|---|---|
| Діетиловий ефір | 1,24 г |
| Етилацетат | 2,92 г |
| Дихлорметан (\(CH_2Cl_2\)) | 0,32 г |
| Гексани | 0,007 г |
Розсіл працює для видалення води з органічного шару, оскільки він висококонцентрований (оскільки\(\ce{NaCl}\) настільки добре розчинний у воді). Насичений\(\ce{NaCl} \left( aq \right)\) розчин високо впорядкований, викликаючи велику мотивацію для того, щоб вода втягувалася в розчин з органічного шару для збільшення ентропії розчину солі (для розведення розчину).
На малюнку 4.44 показана якісна різниця в кількості води, присутньої в органічному шарі з використанням розсолу і без нього. Етилацетат збовтують з водою (рис. 4.44а), потім висушують порцією безводного\(\ce{MgSO_4}\). Великі скупчення сушильного агента на малюнку 4.44b вказують на те, що цей шар етилацетату все ще помітно вологий. Етилацетат потім струшують з розсолом (рис. 4.44с) і висушують з такою ж кількістю безводного\(\ce{MgSO_4}\). У цьому шарі етилацетату мало скупчення сушильного агента, і видно дрібні частинки (рис. 4.44d), що означає, що цей шар містив дуже мало води.

Якщо для видалення води використовуються сушильні агенти, ви можете задатися питанням: «Навіщо турбуватися з розсолом; чому б не використовувати багато сушильного агента, коли настає час?» Основна причина обмеження кількості води, присутньої в органічному розчині перед етапом сушильного агента, полягає в тому, що сушильний агент часто адсорбує сполуку разом з водою. Використання якомога менше дозволить максимально збільшити врожайність.
Для демонстрації на малюнку 4.45 показаний розчин етилацетату, який має слабкий рожевий відтінок, оскільки він містить деякий розчинений червоний харчовий барвник. розчин був закручений білим безводним\(\ce{MgSO_4}\), а сушильний агент став рожевим, коли він адсорбував червону сполуку харчового барвника (рис. 4.45a). Додавання більш безводного\(\ce{MgSO_4}\) зробило сушильний агент рожевішим (рис. 4.45b), так як з розчину було видалено більше барвника. У цьому прикладі навіть після фільтрування і промивання сушильного агента додатковим розчинником сушильний агент залишився рожевим (рис. 4.45c). Таким чином, чим більше сушильного агента використовується, тим більше з'єднання, яке може бути безповоротно втрачено.

Зниження розчинності органічних сполук у воді («засолювання»)
Насичені іонні розчини можуть бути використані для зменшення розчинності органічних сполук у водному шарі, дозволяючи більшій кількості сполуки розчинятися в органічному шарі. Якщо бажаний продукт може зв'язуватися з водою і відносно невеликий, то може бути важко утримувати його в органічному шарі при поділі з водною фазою (\(K\)буде <1). Однак рівновага може сприяти органічному шару, якщо всі водні промивки містять високі концентрації іонів (наприклад\(\ce{NaHCO_3}\), насичених\(\ce{NaCl}\), або\(\ce{NH_4Cl}\)). При тому, що вода настільки щільно «зайнята» в розчиненні іонів в цих розчині, вони менш здатні розчиняти органічні сполуки. Крім того, іонні розчини мають високі діелектричні проникності, що робить їх менш сумісними з органічними сполуками.
На малюнку 4.47 показано, як розсіл впливає на перегородку червоного харчового барвника в етилацетатних і водних розчинами. На малюнку 4.47а показано додавання однієї краплі червоного харчового барвника до шару води в сепараторній воронці, і барвник легко розчиняється навіть без закручування. На малюнку 4.47b показаний водний шар, що містить барвник після струшування з порцією етилацетату. Органічний шар має лише дуже слабкий рожевий колір, що означає, що мало барвника розчинилося. Барвник явно розділився в бік водного шару, що відповідає його дуже полярної структурі (рис. 4.46).
На малюнку 4.47c показано додавання однієї краплі червоного харчового барвника в розсольний розчин, і барвник, здається, не змішується з розсолом взагалі. На малюнку 4.47d показаний шар розсолу, що містить барвник після струшування з порцією етилацетату. Органічний шар рожевий, що означає, що більше барвника тепер розбито до органічного шару. молекули полярного барвника набагато менш розчинні в розчині розсолу, ніж у чистій воді (вони були "підсолені «). Насправді деяка частина барвника осідала в воронці (рис. 4.47d), оскільки вона мала таку низьку розчинність як в розсолі, так і в етилацетаті.

Сушильні агенти
Чому вони використовуються
Органічний шар завжди обробляють сушильним агентом після впливу води в сепараторній воронці (крок с) в табл. 4.4). Сушильні агенти - це безводні неорганічні матеріали, які сприятливо утворюють «гідрати», які включають молекули води в свою тверду ґратчасту структуру (наприклад,\(\ce{Na_2SO_4} \cdot 7 \ce{H_2O}\)). Сушильний агент закручують органічним розчином, щоб видалити слідові кількості води.
Багато органічних розчинників розчиняють значну частину води (табл. 4.6), яку необхідно видалити перед ротаційним випаровуванням, інакше вода буде знаходитися в концентрованому продукті. Після видалення розчинника за допомогою роторного випарника іноді трапляється так багато води, що крапель або другий шар видно серед маслянистої рідини в колбі з круглим дном. Наявність води з продуктом робить вихід неточним, і вода також повинна бути видалена перед аналізом ГК-МС, так як вода несумісна з мас-спектрометричними детекторами.
| Розчинник | Грам води, розчиненої в 100 мл розчинника |
|---|---|
| Діетиловий ефір | 1,24 г |
| Етилацетат | 2,92 г |
| Дихлорметан (\(CH_2Cl_2\)) | 0,32 г |
| Гексани | 0,007 г |
Сушильні агенти повинні використовуватися навіть з відносно неполярними органічними розчинниками, які теоретично не розчиняють багато води, оскільки вода може чіплятися з боків сепараторної воронки і ненавмисно подорожувати разом з органічним шаром під час зливу. Крім того, розчинені в органічному шарі з полярними функціональними групами (наприклад, спирти, карбонові кислоти) можуть водень зв'язуватися з водою і збільшувати ймовірність розчинення води в органічному шарі.
Види сушильних агентів

Сушильні агенти (рис. 4.48) видаляють слідові кількості води з органічних розчинів шляхом утворення гідратів. Найкорисніші підсушують кошти вказують на те, коли вони повністю ввібрали всю воду з розчину. Безводний сульфат магнію\(\left( \ce{MgSO_4} \right)\) - це дрібний пухкий порошок (рис. 4.49а), але його гідрат незграбний і часто чіпляється за скло (рис. 4.49b). Типовою процедурою сушіння є додавання безводного\(\ce{MgSO_4}\) до органічного розчину, поки він не перестане комкуватися і не будуть помічені дрібні частинки, які свідчать про те, що більше немає води для утворення незграбних гідратів.

Безводний сульфат кальцію\(\left( \ce{CaSO_4} \right)\), можна придбати, що містить сполуку кобальту, яка синя при висиханні і рожева при вологому стані (це потім продається під назвою Drierite, рис. 4.49c+d). Таким чином, блакитний дріерит можна використовувати як візуальний індикатор наявності води. \(^8\)
Найбільш поширеними сушильними засобами, що використовуються для видалення води з органічних розчинів, є безводний сульфат натрію\(\left( \ce{Na_2SO_4} \right)\) і безводний сульфат магнію\(\left( \ce{MgSO_4} \right)\). Багато хіміків вважають\(\ce{MgSO_4}\) «перехідним» сушильним агентом, оскільки він працює швидко, утримує багато води для своєї маси, а гідрати помітно більш тонкі порівняно з безводною формою, що дозволяє легко побачити, коли ви додали достатньо. Недоліком використання\(\ce{MgSO_4}\) є те, що це дрібний порошок, і тому розчини необхідно згодом фільтрувати для видалення сушильного агента. Ще одним недоліком\(\ce{MgSO_4}\) є те, що всі дрібні порошки сильно адсорбують продукт на їх поверхні (саме тому їх необхідно промити розчинником після фільтрації), а іноді більш гранульовані сушильні агенти використовуються для мінімізації втрат продукту шляхом адсорбції.
У деяких процедурах\(\ce{Na_2SO_4}\) або\(\ce{CaCl_2}\) використовуються, якщо вони, здається, працюють так само добре\(\ce{MgSO_4}\), або якщо рішення несумісне з\(\ce{MgSO_4}\) (див. Таблицю 4.8). Процедурною перевагою цих сушильних агентів є те, що їх гранули не легко диспергуються, що дозволяє легко декантувати (заливати) розчини. У багатьох ситуаціях сушильні агенти є взаємозамінними (див. Таблицю 4.8 для огляду сушильних агентів). Однак найбільш часто для ексикаторів та сушильних трубок використовують\(\ce{CaSO_4}\) або\(\ce{CaCl_2}\) (рис. 4.50), оскільки ними можна легко маніпулювати у вигляді гранул або гірських порід.

| Сушильний агент | Формула (и) гідрату | практичні коментарі | Інші коментарі |
|---|---|---|---|
| Сульфат магнію | \(\ce{MgSO_4} \cdot 7 \ce{H_2O}\) | Швидко видаляє більшу частину води, і може багато утримувати для своєї маси (\(0.15\)-\(0.75 \: \text{g}\) вода на\(\text{g}\) осушувач). \(^9\)Являє собою дрібний порошок, тому повинен бути профільтрований гравітацією. Його висока площа поверхні означає, що він буде кілька адсорбувати з'єднання: обов'язково промийте після фільтрації. | \(\ce{Mg(H_2O)_4^{2+}}\)кілька кислий, тому несумісний з висококислоточутливими групами. |
| Сульфат натрію |
\(\ce{Na_2SO_4} \cdot 7 \ce{H_2O}\) \(\ce{Na_2SO_4} \cdot 10 \ce{H_2O}\) |
Видаляє воду з помірною швидкістю, тому розчину слід дати настоятися з сушильним засобом деякий час. Може утримувати багато води для своєї маси (\(1.25 \: \text{g}\)вода на\(\text{g}\) осушувач), але може залишити невелику кількість води, що залишилася. Розчини з зазвичай\(\ce{Na_2SO_4}\) можна зціджувати. | Не можна добре висушити діетиловий ефір, якщо не було використано промивання розсолом. |
| Хлорид кальцію |
\(\ce{CaCl_2} \cdot 2 \ce{H_2O}\) \(\ce{CaCl_2} \cdot 6 \ce{H_2O}\) |
Швидко видаляє воду добре, хоча потрібні більші кількості, ніж інші сушильні агенти (утримує\(0.30 \: \text{g}\) воду на\(\text{g}\) осушувач). Якщо використовується дрібний порошок, то розчин необхідно самопливом процідити і промити сушильним засобом. Якщо використовують гранули, розчину слід дати настоятися кілька хвилин, потім зцідити. | Поглинає воду, а також метанол і етанол. |
| Сульфат кальцію (дрієрит) |
\(\ce{CaSO_4} \cdot \frac{1}{2} \ce{H_2O}\) \(\ce{CaSO_4} \cdot 2 \ce{H_2O}\) |
Швидко видаляє воду, але потребує великих кількостях, оскільки вона вміщує мало води на грам. Найчастіше використовуються в ексикаторах і сушильних трубках, а не з розчинами. |
Процедура сушіння агентів

- Органічний розчин, який підлягає сушінню, повинен знаходитися в колбі Ерленмейера, оскільки розчини можуть легко виплескатися з склянок при закручуванні.
- Спочатку огляньте розчин, щоб побачити, чи є він однорідним, або чи є другий шар рідини (зазвичай калюжа на дні). Якщо помічено другий шар, це, ймовірно, вода, і більшість з них повинні бути піпетками, перш ніж продовжувати далі (рис. 4.51a). Повністю видалити водний шар піпеткою може бути важко, тому залишати крихітний шматочок допустимо.
- Додайте невелику порцію сушильного агента в колбу розміром з одну горошину для макромасштабних робіт (рис. 4.51б), і закрутіть розчин (рис. 4.51c). Обов'язково закрийте банку з сушильним засобом, коли він не використовується, так як реагенти гігроскопічні. Через невеликий проміжок часу уважно огляньте суміш.
- Якщо весь сушильний агент скупчується на шматки, які набагато більше початкового розміру (рис. 4.52b+c), в колбі все ще залишається вода. Додайте ще одну порцію сушильного агента і завихрте.
- Розчин наближається до сухості, коли помічені дрібні частинки, які не чіпляються за інші частинки (рис. 4.52a+c) або до скла при закручуванні (рис. 4.53а). Вологий органічний розчин може бути каламутним, а сухий - завжди прозорим.
- Якщо використовується безводний\(\ce{Na_2SO_4}\), дайте розчину сидіти принаймні 5 хвилин, перш ніж оголосити розчин сухим, оскільки цей реагент вимагає часу для роботи.


- Коли розчин висохне, відокремте від розчину сушильний засіб:
- При використанні\(\ce{Na_2SO_4}\),\(\ce{CaCl_2}\) гранули, або\(\ce{CaSO_4}\) гірські породи, ретельно зціджувати розчин в відповідного розміру круглий дном колбу (рис. 4.53b), переконавшись, щоб заповнити колбу не більше ніж на півдорозі. Нагадування: маса порожньої колби повинна вийти, якщо розчинник буде випаровуватися на обертовому випарнику.
- При використанні\(\ce{MgSO_4}\) гравітаційного фільтрувати розчин у відповідну за розміром колбу з круглим дном (рис. 4.53c). При заливці залиште тверду масу позаду якомога довше (істотно зціджують розчин, але в воронку, вистелену фільтрувальним папером). Тверда речовина може уповільнити дренаж у фільтрувальному папері.
- З усіма сушильними агентами промийте сушильний агент (в колбі і в воронці фільтра) декількома\(\text{mL}\) свіжим органічним розчинником, а ополіскування додайте в колбу з круглим дном (рис. 4.53d). Видаліть розчинник за допомогою роторного випарника.
\(^4\)Зайделл, Розчинності неорганічних та органічних речовин, Компанія D.Van Nostrand, 1907.
\(^5\)Оцінюючи результат лакмусового папірця, подивіться на центр краплі. Центр є найбільш концентрованим плямою, і можливо, зміна кольору може не спостерігатися зовні, де розчин розтікався і розлучився. Будь-який рожевий, помічений на блакитному лакмусовому папері, означає, що розчин кислий.
\(^6\)Від: Фессенден, Фессенден, Фейст, Органічні лабораторні методи, 3\(^\text{th}\) изд., Брукс-Коул, 2001.
\(^7\)Від: Фессенден, Фессенден, Фейст, Органічні лабораторні методи, 3\(^\text{th}\) изд., Брукс-Коул, 2001.
\(^8\)Blue Drierite коштує дорого, тому зазвичай використовується шляхом змішування його разом з білим Дріеріт (\(\ce{CaSO_4}\)без індикатора кобальту). Рожевий (мокрий) дрієрит можна висушити, розклавши його на годинниковому келиху і висушивши в\(110^\text{o} \text{C}\) духовці протягом ночі.
\(^9\)Грами води на грам значень осушувача взяті з: Дж. Дін, Довідник з хімії Ланге, 15\(^\text{th}\) видання, Макгроу-Хілл, 1999, Розділ 11.2. \(\ce{CaCl_2}\)значення цитується для формування\(\ce{CaCl_2} \cdot 2 \ce{H_2O}\).
