31.3: Сполуки перехідних металів як реагенти для органічних синтезів
- Page ID
- 106301
Реакції хлорогідриду цирконоцену
Деякі гідриди перехідних металів виявляють обіцянку як синтетичні реагенти тієї ж загальної придатності, що і гідриди бору (Розділ 11-6). Відмінну ілюстрацію дає робота Дж.Шварца з хлорогідридом цирконоцену\(13\), який доступний шляхом відновлення дихлориду цирконоцену:
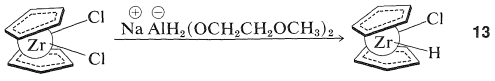
(Циклопентадієнідні кільця в\(13\) показані як непаралельні, і це узгоджується з рентгенівськими дифракційними дослідженнями металоценів, які мають додаткові замінники на металі.) Відтепер ми будемо скорочувати структуру\(13\) на\(\ce{(Cp)_2ZrClH}\).
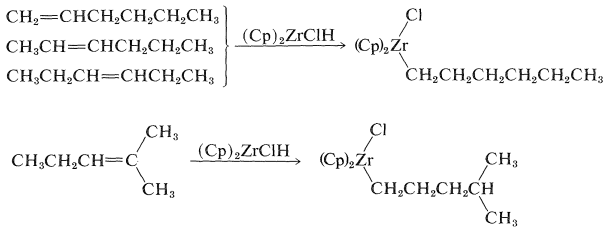
Алкени реагують з\(\ce{(Cp)_2ZrClH}\) утворенням\(\ce{Zr}\) алкіл-зв'язків з цирконієм, приєднуючись до найменш перешкодженого первинного вуглецю:
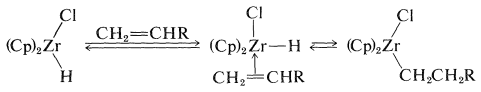
Початковим етапом в цьому виді реакції є формування комплексу\(\pi\) -алкенів з подальшим перенесенням гідридів:
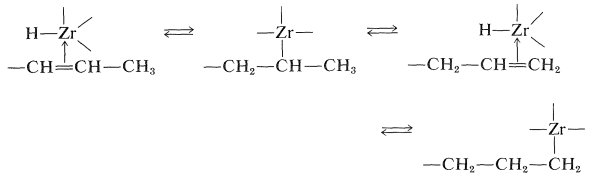
Ці реакції повинні бути оборотними для алкену з внутрішнім подвійним зв'язком, щоб утворити аддукт з атомом металу на кінці ланцюга. Процес розглядається як низка взаємоперетворень між\(\pi\) і\(\sigma\) комплексами, що дозволяє атому металу рухатися до найменш утрудненого (первинного) вуглецю:
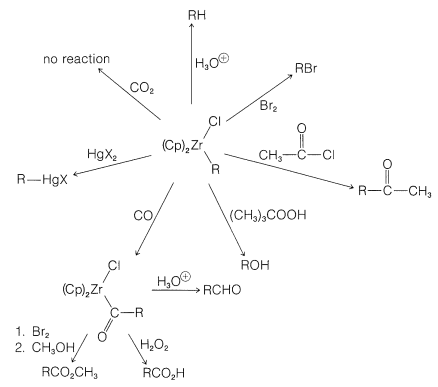
Однією з витончених особливостей цих реакцій є утворення\(\ce{[(Cp)_2Zr(Cl)]_2O}\) кристалів при обробці продуктів реакції водою. Ця речовина може бути перетворена назад в дихлорид цирконіцену з\(\ce{HCl}\) і звідти назад до\(\ce{(Cp)_2ZrClH}\):
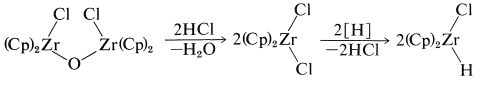

Ця послідовність кроків є важливою частиною механізму гідроформулювання алкенів (оксореакція), яка буде розглянута в розділі 31-4B, а також пов'язана з реакціями карбонілювання боранів, розглянутими в розділі 16-9G.
Нуклеофільний реагент перехідних металів. Натрію тетракарбонілферрат (-II)
Натрій реагує з пентакарбонілом заліза для отримання солі, відомої як тетракарбонілферрат натрію (-II)\(^2\)\(\ce{Na_2Fe(CO)_4}\), яка, як було показано Джей П. Коллманом та колегами, має значний потенціал як реагент для органічного синтезу.
\[2 \ce{Na} + \ce{Fe(CO)_5} \rightarrow \ce{Na_2Fe(CO)_4} + \ce{CO}\]
Діаніон тетракарбонілферрат є хорошим нуклеофілом і реагує з алкілгалогенідами або ефірами алкілсульфонату\(S_\text{N}2\) механізмом (з інверсією) з утворенням\(\ce{C-Fe}\) зв'язків:
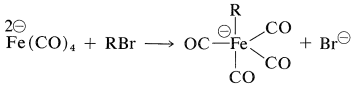
Отриманий аніон піддається введенню з окисом вуглецю або утворенням кетону з ацилгалогенідами подібним до алкілхлорцирконоценів (Розділ 31-3А):
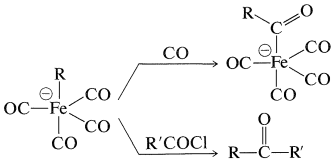
Продукт\(\ce{CO}\) введення має потенціал перенесення\(\ce{R}- \overset{\ominus}{\ce{C}} \ce{=O}\), і перетворюється на\(\ce{RCHO}\) з кислотами, в\(\ce{RCOX}\) галогени, або до\(\ce{RCO_2H}\) окислення:
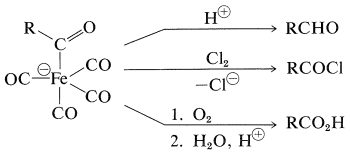
\(^2\)Позначення (-II) вказує на те, що залізо в цій речовині може розглядатися як знаходиться в стані окислення -2.
