30.5: Біосинтез
- Page ID
- 105950
Жирні кислоти
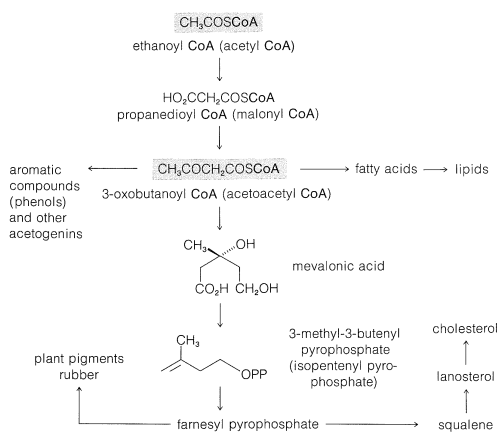
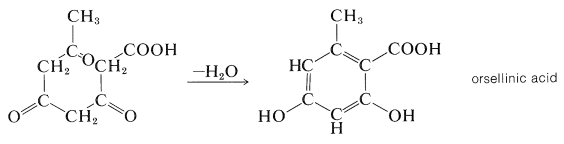
Ідея про те, що етановая кислота (оцтова кислота) є можливим поширеним вихідним матеріалом для біосинтезу багатьох органічних сполук, вперше була запропонована Коллі (1893 р.) на чисто структурних ознаках. Він визнав структурний зв'язок між лінійним ланцюгом повторюваних\(\ce{CH_3CO}\) одиниць (полікетометиленовий ланцюг\(\ce{CH_3COCH_2COCH_2COCH_2CO}-\)) і певними циклічними природними продуктами. У наведеному нижче прикладі орселінова кислота представлена так, ніби вона була отримана з ланцюга з чотирьох\(\ce{CH_3CO}\) одиниць реакцією конденсації-циклізації:
Експериментальна перевірка гіпотези Коллі відбулася через багато років, коли стали доступні ізотопний водень і вуглець (\(\ce{^2H}\)\(\ce{^3H}\)\(\ce{^{13}C}\),, і\(\ce{^{14}C}\)). Дослідження Tracer показали, що довголанцюгові жирні кислоти виробляються рослинами і тваринами з\(\ce{CH_3CO}\) одиниць шляхом послідовного зв'язування між собою карбонільної групи однієї з метильною групою іншої (К.Блох і Ф.Лінен, Нобелівська премія, 1964). Якщо етанова кислота, що надходить в організм, маркується в карбоксильній групі з\(\ce{^{14}C} \: \left( \overset{*}{\ce{C}} \right)\), жирна кислота має етикетку на альтернативних вуглецях:
\[\ce{CH_3} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{O_2H}\]
Однак, якщо вуглець метильної групи маркується, продукт виходить маркованим на іншому наборі альтернативних вуглеців:
\[\overset{*}{\ce{C}} \ce{H_3CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CO_2H}\]
Етанову кислоту активують для біосинтезу комбінацією з тіолом, коензимом А (\ textbf {CoA}\ ce {SH}\), рис. 18-7), щоб дати тіоефір, етаноїл (ацетил) коензим А\(\left( \ce{CH_3COS} \textbf{CoA} \right)\). Ви можете згадати, що метаболічна деградація жирів також включає цей кофермент (\ (\ alpha\) Вуглець похідних карбонової кислоти» href=» /книжкові полиці/Organic_chemistry/Book:_basic_principles_of_organic_chemistry_ (Roberts_and_Caserio) /18: Carbosylic_acids_і_їх_похідні/18.09: Реакції_AT_the/ (/альфа/) _вуглеці_оф_карбоксилової кислоти_похідних #18 -8F_Біологічні_клайзен_конденсації_і_алдол_доповнення. _Fatty_Acid_Metabolism">Розділ 18-8F) і спокусливо припустити, що біосинтез жирних кислот є просто зворотним метаболізмом жирних кислот\(\ce{CH_3COS} \textbf{CoA}\). Однак це не зовсім так. По суті, це загальне спостереження в біохімії, що первинні метаболіти синтезуються різними шляхами від тих, за якими вони метаболізуються (наприклад, порівняйте шляхи вуглецю в фотосинтезі і метаболізмі вуглеводів в розділах 20-9 і 20-10).
Нижче наведено короткий опис основних подій у біосинтезі жирних кислот, і всі ці кроки слід розуміти, що вони знаходяться під контролем відповідних ферментів та їх коферментів, хоча вони тут опущені.
\(\ce{CH_3CO}\)Група етаноїл-коферменту А спочатку переноситься на білок, що має вільну тиолову\(\left( \ce{SH} \right)\) групу, щоб зробити інший тіоефір, представлений тут як\(\ce{CH_3COS}-\textbf{ACP}\), де ACP означає A cyl- C arrier- P білок. Зростаючий вуглецевий ланцюг залишається пов'язаним з цим білком протягом усього синтезу:
\[\ce{CH_3COS} \textbf{CoA} + \ce{HS}-\textbf{ACP} \rightarrow \ce{CH_3COS}-\textbf{ACP} + \textbf{CoA} \ce{SH}\]
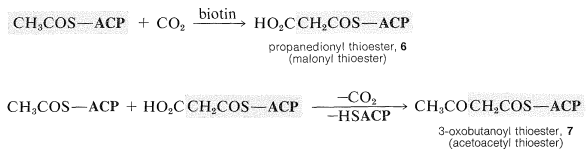
Карбоксилювання\(\ce{CH_3COS}-\textbf{ACP}\) дає пропандіоїлтіоефір\(6\), який потім піддається конденсації Клайсена з другим молем\(\ce{CH_3COS}-\textbf{ACP}\) супроводжується декарбоксилюванням з отриманням 3-оксобутаноїлу тіоефіру,\(7\):
Зменшення кетонової групи тіоефіру (по\(\ce{NADPH}\)) призводить до утворення тіольного ефіру чотиривуглецевої карбонової кислоти. Повторні ущільнення з тіоефіром з\(6\) подальшим відновленням в кінцевому підсумку призводять до жирних кислот. Кожне повторення збільшує довжину ланцюга на два вуглеці:
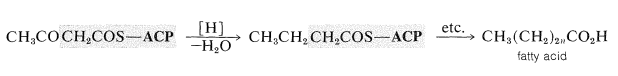
Попередня схема є репрезентативною біосинтезу жирних кислот у рослин, тварин, бактерій. Основна відмінність полягає в тому, що рослинні та бактеріальні жирні кислоти зазвичай містять більше подвійних зв'язків (або навіть потрійних зв'язків), ніж жирні кислоти тварин.
Біосинтез ароматичних кілець
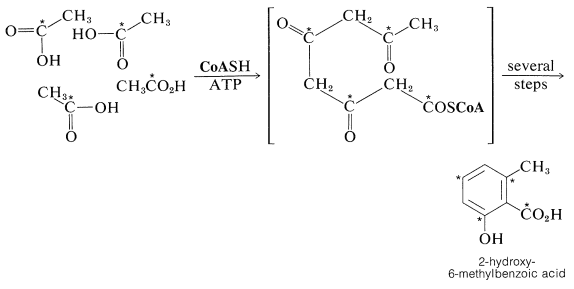
Гіпотеза Коллі про те, що ароматичні сполуки виготовляються біологічно з етанової кислоти, була значно розширена А.Дж. Берчем, включивши надзвичайну кількість різноманітних сполук. Загальна назва «ацетогенін» було запропоновано як зручну класифікацію натуральних продуктів, отриманих етаноат (ацетат), але також використовується назва «полікетіди». Природні ароматичні сполуки та хінони значною мірою виготовляються таким чином. Прикладом є 2-гідрокси-6-метилбензойна кислота, утворена як метаболіт цвілі Penicillium urticae; використовуючи\(\ce{^{14}C}\) -карбоксил-марковану етанонову кислоту, етикетка була показана на позиціях, зазначених нижче:
Біосинтез терпену
Біосинтез терпенів чітко слід дещо іншим курсом від жирних кислот тим, що утворюються сполуки з розгалуженим ланцюгом. Один із способів, який це може статися, полягає в тому, щоб 2-оксобутаноїл кофермент А піддавався додаванню альдолу в кето карбонільній групі з етаноїл-коензимом А, щоб дати похідне 3-метил-3-гідроксипентандіової кислоти\(8\):
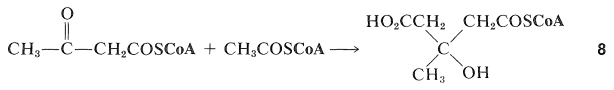
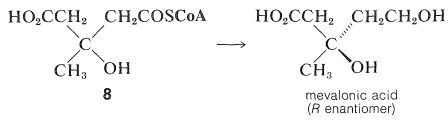
Наступним етапом є зменшення однієї з карбоксильних груп,\(8\) щоб дати мевалонову кислоту:
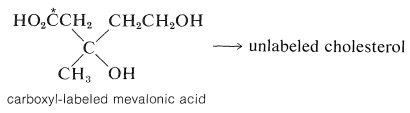
Ця речовина було показано в дослідженнях tracer, щоб бути ефективним попередником терпенів і стероїдів. Мевалонова кислота має шість атомів вуглецю, тоді як ізопренова одиниця має всього п'ять. Тому, якщо мевалонова кислота є попередником ізопренових одиниць, вона повинна втратити один атом вуглецю на певному етапі. Синтез мевалонової кислоти, маркованої в карбоксильної групі з\(\ce{^{14}C}\), і використання цього матеріалу в якості вихідного матеріалу для виробництва холестерину, дає немаркований холестерин. Тому карбоксильний вуглець - це той, який втрачається:
Показано, що формування «біологічної ізопренової одиниці» з мевалонової кислоти відбувається шляхом ступеневого фосфорилювання обох спиртових груп, потім елімінації та декарбоксилювання з отриманням 3-метил-3-бутенілпірофосфату\(9\) (часто називають\(\Delta^3\) -ізопентенілпірофосфат):
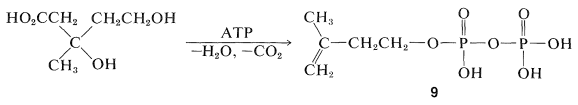
З'єднання п'ятивуглецевих агрегатів\(9\), щоб надати ізопреноїдні сполуки, було запропоновано продовжити наступними кроками. По-перше, ізомеризацію подвійного зв'язку здійснює фермент,\(\left( \ce{E} \right)\) що несе\(\ce{SH}\) групу:
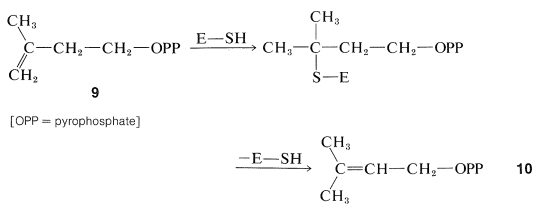
Ефір\(10\), потім стає з'єднаним з подвійним зв'язком молекули\(9\), ймовірно, в індукованому ферментом типу карбокації полімеризації (Розділ 10-8B):
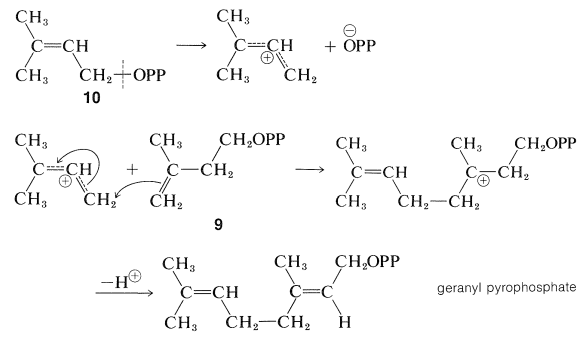
Продукт поєднання двох одиниць пірофосфату\(9\), через цю послідовність є геранілпірофосфат, якщо, як показано, протон втрачається, щоб дати транс-подвійний зв'язок. Утворення подвійного зв'язку цис дасть нерілпірофосфат (Розділ 30-3B).
Продовження додавання від голови до хвоста п'ятивуглецевих одиниць до геранілу (або нерілу) пірофосфату може протікати таким же чином до фарнезилпірофосфату і так до гуттаперчі (або натурального каучуку). На якомусь етапі необхідно залучити новий процес, оскільки, хоча багато ізопреноїдних сполук є полімерами ізопрену типу «голова до хвоста», інші, такі як сквален, лікопін та\(\beta\) - і\(\gamma\) -каротин (табл. 30-1), утворюються по-різному. Сквален, наприклад, має структуру, утворену з голови до голови відновної муфти двох фарнезилпірофосфатів:
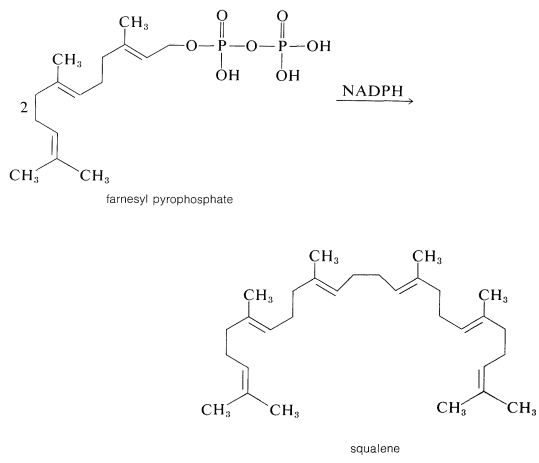
Оскільки сквален може бути отриманий з фарнезилпірофосфату з\(\ce{NADPH}\) і відповідною ферментною системою, загальні особливості вищевказаної схеми біосинтезу терпену добре підтримуються експериментом.
Підсумовуючи, послідовність від етаноату до сквалену простежується як
\[\text{ethanoyl coenzyme A} \rightarrow \text{mevalonic acid} \rightarrow \text{isopentenyl pyrophosphate} \rightarrow \text{farnesyl pyrophosphate} \rightarrow \text{squalene}\]
Біосинтез холестерину
Експерименти з ізотопним маркуванням показують, що холестерин отримують з етаноату шляхом сквалену та ланостерину. Доказом цього є те, що гомогенізована тканина печінки здатна перетворювати маркований сквален в мічений ланостерол, а звідти в мічений холестерин. Перетворення сквалену в ланостерол особливо цікавий тим, що, хоча сквален ділиться на одиниці ізопрену, ланостерол не є - метил необхідний при\(\ce{C_8}\) і ні\(\ce{C_{13}}\):
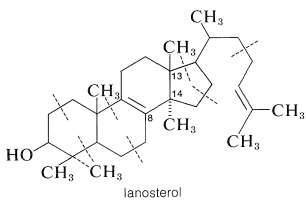
В результаті повинна знадобитися якась перестановка, щоб потрапити зі сквалену в ланостерол. Характер цієї перестановки стає зрозумілішим, якщо написати формулу сквалену так, щоб прийняти форму ланостерину:
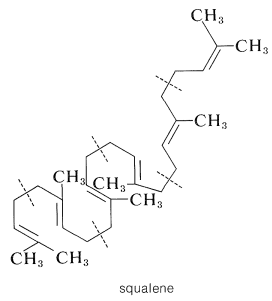
Коли сквален пишеться в такому вигляді, ми бачимо, що він прекрасно побудований для циклізації до ланостерину. Ключовим проміжним продуктом, який ініціює циклізацію, є 2,3-епоксид сквалену. Ферментативне розщеплення епоксидного кільця супроводжується циклізацією, а потім багатоводні гідридні\(\left( \ce{H} \colon \right)\) і метидні\(\left( \ce{CH_3} \colon \right)\) зрушення для отримання ланостерину:
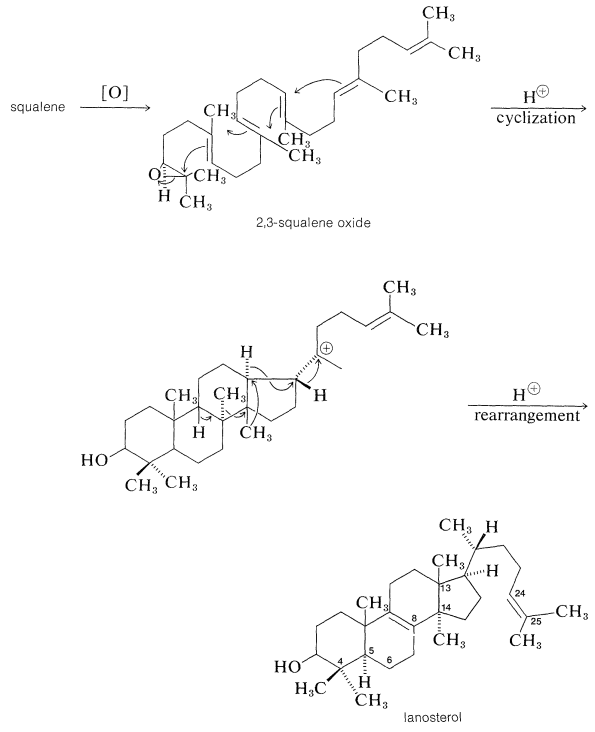
Докази свідчать про те, що біосинтез ланостерину насправді протікає шляхом цього типу. За допомогою сквалену, виготовленого з метіл- або карбоксил-маркованого етаноату, всі вуглеці ланостерину та холестерину маркуються так само, як передбачено механізмом. Крім того, геніальні експерименти з подвійним маркуванням показали, що метиловий ат\(\ce{C_{13}}\) ланостеролу - це той\(\ce{C_{14}}\), який спочатку був розташований в\(\ce{C_{14}}\), тоді як той, що прийшов з\(\ce{C_8}\).
Перетворення ланостерину в холестерин передбачає видалення трьох метильних груп в 4,4- і 14-положеннях, зсув подвійного зв'язку на\(B\)/\(C\)стику між\(\ce{C_5}\) і\(\ce{C_6}\), і зменшення\(\ce{C_{24}}\) -\(\ce{C_{25}}\) подвійного зв'язку. Метильні групи позначені експериментами з трасування, які слід усунути шляхом окислення до вуглекислого газу.
Біосинтетичний зв'язок між етаноїл-коензимом А та складними природними продуктами, коротко розглянутими, узагальнено на малюнку 30-1.