30.4: Стероїди
- Page ID
- 105928
Термін стероїд відноситься до сполук, що містять гідрогенізований циклопентанофенантрин вуглецевого скелета:
Більшість стероїдів є спирти, і відповідно називаються стерини. Важливі приклади включають холестерин, ергостерол, естрадіол, стигмастерол та інші репрезентативні стерини, наведені в таблиці 30-2. Як видно з їхніх структур, більшість мають однаковий кільцевий скелет, але значно різняться за своїми периферійними структурними особливостями, стереохімією та ступенем кільцевої ненасиченості.
Таблиця 30-2: Представницькі стероїди
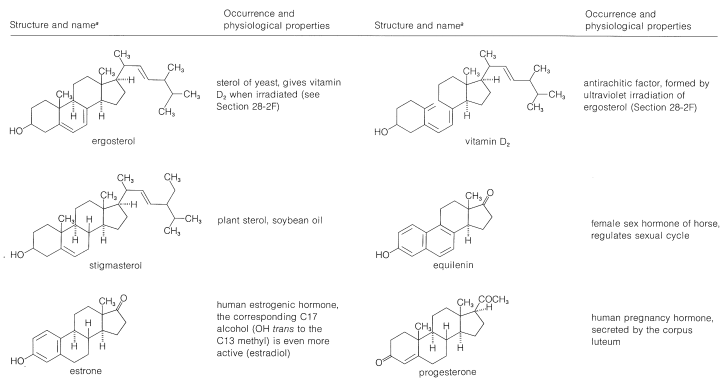
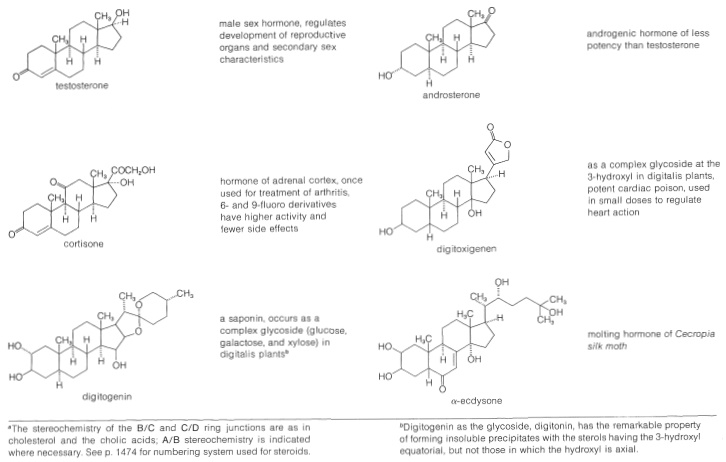
Стерини широко поширені як у рослин, так і у тварин. Багато з них мають життєво важливе значення для фізіології тварин, таких як холестерин, жовчні кислоти, вітамін D, статеві гормони та кортикоїдні гормони. Багато хто має цінність як лікарські засоби, такі як серцеві глікозиди, гормони та стероїдні антибіотики. Виникнення і фізіологічні властивості представницьких стероїдів включені в таблицю 30-2.
Холестерин
Холестерин - це ненасичений спирт формули,\(\ce{C_{27}H_{45}OH}\) який давно відомий як головна складова жовчних каменів людини і отримав відомість в останні роки за його зв'язок із захворюваннями кровообігу, особливо загартовування артерій. Холестерин, вільний або у вигляді ефірів, насправді широко поширюється в організмі, особливо в нервовій і мозковій тканині, з яких він становить близько однієї шостої частини сухої ваги. Функція холестерину в організмі не вивчена; експерименти з міченим холестерином свідчать про те, що холестерин в нервовій і мозковій тканині не швидко врівноважується з холестерином, що вводиться в раціон. Зрозумілі дві речі: холестерин синтезується в організмі, а його метаболізм регулюється високоспецифічним набором ферментів. Про високу специфічність цих ферментів можна судити з того, що дуже тісно пов'язані рослинні стерини, такі як ситостерин, не метаболізуються вищими тваринами, навіть незважаючи на те, що вони мають однакову стереохімічну конфігурацію всіх груп в кільці і відрізняються за будовою тільки поблизу кінця бічний ланцюг:
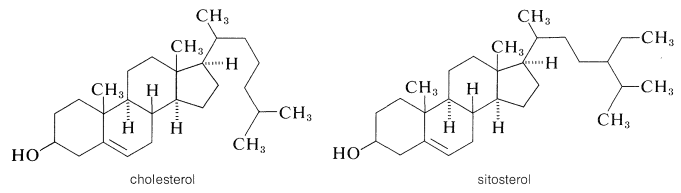
Прийнята система нумерації для стероїдного ядра та прикріплених бічних ланцюгів проілюстрована для холестерину в\(4\). Метильні групи на стику кілець\(A\) і кілець\(B\)\(\left( \ce{C_{10}} \right)\)\(C\) і\(D\)\(\left( \ce{C_{13}} \right)\) називаються кутовими метилами. Щоб уникнути неправильного тлумачення структури та стереохімії, метильні групи та водні на кільцевих переходах повинні бути чітко записані як\(\ce{CH_3}\) або\(\ce{H}\). Стереохімія задається суцільною лінією, якщо атом або група знаходиться над кільцевою площиною\(\left( \beta \right)\), і пунктирною лінією, якщо нижче кільцевої площини\(\left( \alpha \right)\). Таким чином\(5\), з'єднання, 5\(\alpha\) -холестан-3\(\beta\) -ол, яке отримують шляхом зниження холестерину, означає в назві, що гідроксил ат\(\ce{C_3}\) знаходиться вище кільцевої площини і що водень при\(\ce{C_5}\) знаходиться нижче кільцевої площини (тобто\(A\)/\(B\)кільця, мають транс-декалін стереохімія; Розділ 12-9).
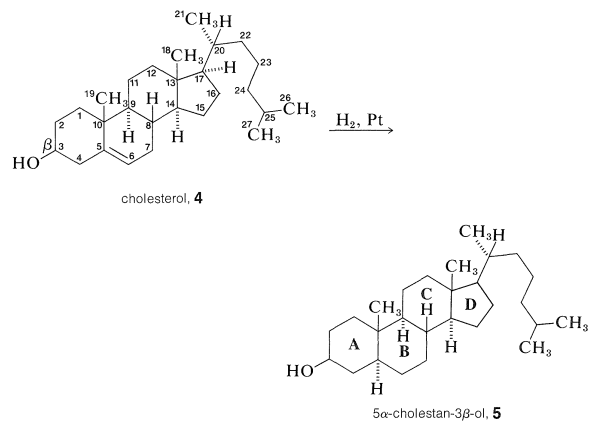
структура холестерину
Хоча холестерин був визнаний окремою хімічною речовиною в 1812 році, всі аспекти його структури і стереохімічної конфігурації не були врегульовані приблизно до 1955 року. Структурна проблема була дуже складною, оскільки більша частина холестерину насичується і не легко деградується. На щастя, холестерин легко доступний, так що можна було використовувати досить складні деградаційні послідовності, про які б не йшлося з деякими з більш рідкісних натуральних продуктів.
Першим кроком з'ясування структури холестерину стало визначення молекулярної формули, спочатку неправильно як\(\ce{C_{26}H_{44}O}\) в 1859 році, а потім правильно, як\(\ce{C_{27}H_{46}O}\) в 1888 році. Точність, необхідна для розрізнення цих двох формул, досить висока, тому що\(\ce{C_{26}H_{44}O}\) має\(83.80\%\)\(\ce{C}\) і\(11.90\%\)\(\ce{H}\), тоді як\(\ce{C_{27}H_{46}O}\) має\(83.87\%\)\(\ce{C}\) і\(11.99\%\)\(\ce{H}\). Було показано, що в 1859 році холестерин є алкоголем шляхом утворення похідних ефіру і в 1868 році має подвійний зв'язок шляхом утворення диброміду. До 1903 року алкогольна функція була вказана як вторинна окислення до кетону, а не альдегіду. Наявність гідроксильної групи і подвійного зв'язку при поєднанні з молекулярною формулою показало наявність чотирьох карбоциклічних кілець. Подальший прогрес був можливий лише шляхом окислювальної деградації.
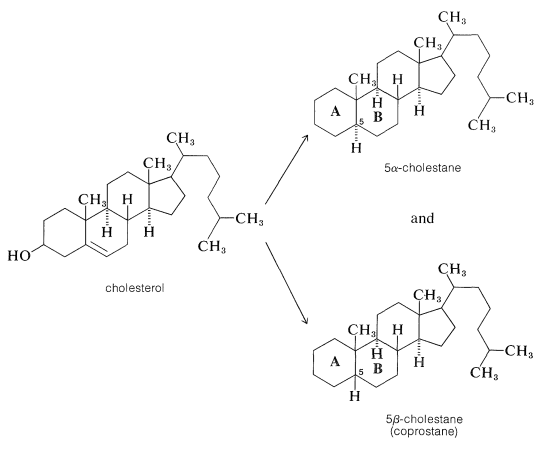
Структура доказу холестерину паралельно тому, що для двох інших важливих стероїдів, так званих жовчних кислот, холевої та дезоксихолевої кислоти, які функціонують, щоб допомогти солюбілізувати жири в кишковому тракті. Доказ того, що холестерин і жовчні кислоти мають однакову загальну кільцеву систему, було досягнуто шляхом зневоднення і зниження холестерину до двох різних вуглеводнів, 5\(\alpha\)\(\beta\) -холестан і 5 -холестан (копростан), які відрізняються тільки стереохімією місця з'єднання між кільцями\(A\) і\(B\):
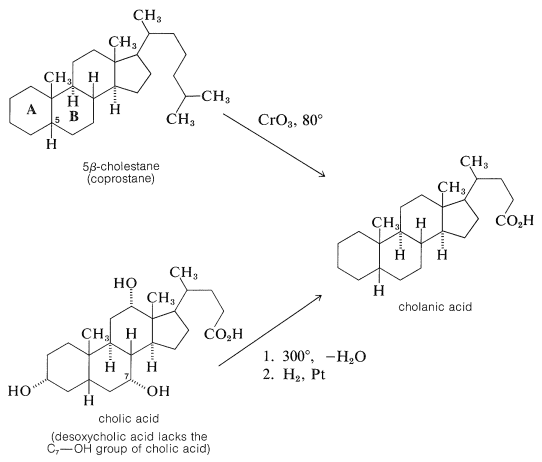
Окислення 5\(\beta\) -холестану, але не 5\(\alpha\) -холестану, дало кислоту, яка виявилася ідентичною з холанової кислотою, отриманої при зневодненні холевої кислоти\(300^\text{o}\) при подальшому гідруванні:
Після того, як був встановлений зв'язок між холестерином та жовчними кислотами, подальша робота над доказом структури була спрямована на експерименти з деградацією жовчних кислот, які з їх гідроксильними групами на кільцях\(B\) і пропонували більше можливих реакцій деградації\(C\), ніж холестерин. Видатний внесок у доказ структури зробили німецькі хіміки Х. Віланд і А.Віндаус, обидва з яких були удостоєні Нобелівської премії з хімії. Віланд отримав нагороду в 1927 році, а Віндаус в 1928 році. Незважаючи на їх багаторічні зусилля, структура, запропонована Віндаусом у 1928 році для дезоксихольової кислоти, була лише орієнтовною і була неспецифічною щодо розташування двох вуглеців.
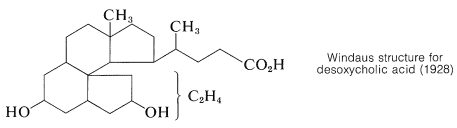
Серйозні сумніви щодо правильності будови Вінда виникли в результаті рентгенівського дослідження ергостеролу Дж.Д. Берналя в 1932 році. Він зазначив, що рентгенівські дані вказують на те, що ергостерол є довгою, досить плоскою молекулою. Стероїди з кільцевою системою, що відповідає структурі Windaus, мали б кулясту форму. Це спостереження стимулювало подальшу роботу і повторну експертизу доказів, що в підсумку призвело до правильної структури. Подробиці цього дослідження можна знайти в іншому місці. \(^3\)
Синтез стероїдів
Одним з найбільш помітних досягнень 1950-х був загальний синтез ряду важливих стероїдів, у тому числі естрону, холестерин, кортизон, андростерон, і тестостерон. Курси деяких з цих синтезів надзвичайно складні і включають велику кількість кроків. Хоча вони не перевершили Природа в наданні практичних кількостях синтетичних стероїдів, вони призвели до розвитку ключових реакцій загального використання в органічному синтезі. Особливо корисною реакцією для побудови злитих кільцевих систем є так звана реакція відпалу Робінсона, розроблена сером Робертом Робінсоном (Нобелівська премія, 1947) та Дж. Корнфортом (Нобелівська премія, 1975). Реакція включає в себе доповнення Майкла до\(\alpha\),\(\beta\) -ненасичених кетонових негайно з подальшим додаванням альдолу:
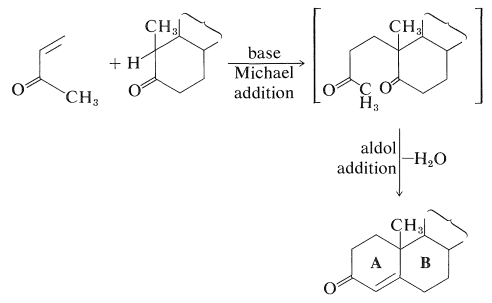
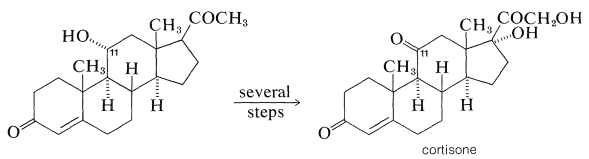
Фармакологічна важливість багатьох природних стероїдів стимулювала багато синтетичних роботи в спробі отримати практичні кількості природних і неприродних стероїдів. Часто найкраще працює поєднання біосинтезу та органічного синтезу. Наприклад, потреба у великих кількостях похідних кортизону для терапевтичного застосування при лікуванні артритів і подібних захворювань обміну речовин призвела до інтенсивних досліджень синтетичних підходів до методів отримання стероїдів з функціями кисню при\(\ce{C_{11}}\), що не є особливо поширеним моментом заміщення в стероїди.
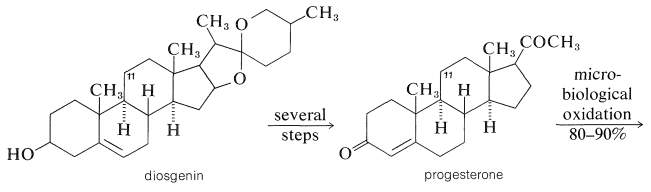
Ефективним способом цього є мікробіологічне окислення. Кортизон може бути виготовлений у відносно великих масштабах з сапоніну, діосгеніну, який виділяють з бульб мексиканського ямсу роду Dioscorea. Діосгенін перетворюється в прогестерон, потім високопродуктивним (\(80\%\)-\(90\%\)) окисленням цвіллю, Rhizopus nigricans, в 11-гідроксипрогестерон і, нарешті, в кортизон:
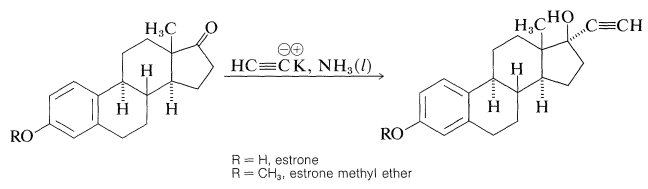
Особливо важливими стероїдними похідними в застосуванні сьогодні є синтетичні естрогени, 17\(\alpha\) - етинілестрадіол і його 3-\(\ce{OCH_3}\) похідне, местранол:

Обидва ці сполуки мають потужну естрогенну активність (пригнічують овуляцію) і широко використовуються в якості оральних контрацептивів. Вони синтезуються з природного естрогену, естрону, наступною реакцією:
З'єднання, відоме як diethylstilbestrol (DES) також проявляє естрогенну активність, хоча вона структурно не пов'язана з стероїдними естрогенами. Він придбав славу як можливу причину раку матки. Diethylstilbestrol широко використовується як добавка в корм великої рогатої худоби та курки, оскільки це дає більший приріст у вазі для даної кількості корму.

\(^3\)Див., наприклад, відмінний і авторитетний рахунок дають Л.Ф. Фізер і М.Фізер, Стероїди, Ван Ностранд Рейнхолд Co., Нью-Йорк, 1959, глава 3.
