14.13: Органомагнієві та органолітієві сполуки в синтезі
- Page ID
- 106280
Доповнення до карбонільних груп. Синтез спиртів
Найбільш важливим синтетичним використанням реагентів Гріньяра та органолітієвих реагентів є формування нових вуглецево-вуглецевих зв'язків шляхом додавання до полярних множинних зв'язків, особливо карбонільних зв'язків. Прикладом може служити додавання метил-магнію йодиду до метаналу:

Вихід продуктів додавання в реакціях такого роду, як правило, високий. Аддукти мають метало-кисневі зв'язки, які можуть бути легко порушені кислотним гідролізом, щоб дати органічний продукт. Реагенти Гріньяра рідко додають до вуглецево-вуглецевих багаторазових зв'язків (однак див. Розділ 14-12D).
При відповідних варіаціях карбонільної сполуки широкий спектр сполук може бути побудований з речовин, що містять менше атомів вуглецю на молекулу. Продукти, що утворюються при взаємодії декількох видів карбонільних сполук з реагентами Гріньяра, наведені в таблиці 14-4. Послідовність реакцій, починаючи з органічного галогеніду\(\ce{RX}\), становить додавання\(\ce{R-H}\) через карбонільний зв'язок. \(^2\)

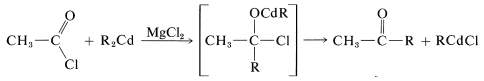
Первинні спирти можуть бути отримані шляхом додавання\(\ce{RMgX}\) або\(\ce{RLi}\) до метаналу\(\ce{CH_2=O}\),
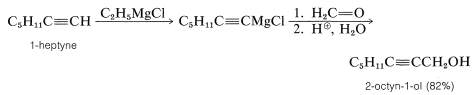
Спирти формули\(\ce{RCH_2CH_2OH}\) можуть бути отримані шляхом додавання\(\ce{RMgX}\) до оксациклопропану (оксирану):

Таблиця 14-4: Продукти реакції реагентів Гріньяра\(\left( \ce{RMgX} \right)\) з карбонільними сполуками

Вторинні спирти отримують з альдегідів, тоді як кетони дають третинні спирти:

Гідроліз проміжного\(\ce{R-OMgX}\) з'єднання найкраще досягається водним розчином хлориду амонію. Додавання води дає неприємний безлад,\(\ce{Mg(OH)_2}\) тоді як додавання сильних кислот, таких як\(\ce{HCl}\) або\(\ce{H_2SO_4}\) може призвести до побічних реакцій зневоднення тощо, особливо з третинними спиртами (Розділ 8-9С):

Третинні спирти також отримують як з ацилгалогенідів\(\ce{RCOCl}\), так і з складних ефірів\(\ce{RCO_2R}\), шляхом додавання двох молей реагенту Гріньяра. Перший моль\(\ce{RMgX}\) додає до карбонільного зв'язку, щоб дати аддукти\(13\) або\(14\):

Однак ці вперше сформовані аддукти нестійкі і розкладаються на кетон\(\ce{CH_3COR}\), а також солі магнію,\(\ce{MgXCl}\) або\(\ce{MgXOC_2H_5}\). Кетон зазвичай не може бути ізольований, але швидко реагує з\(\ce{RMgX}\) більшою мірою, щоб дати третинний алкоголь:

Літійорганічні сполуки поводяться дуже схожими на реагенти Гріньяра, але з підвищеною реактивністю. Вони пропонують переваги перед сполуками магнію, коли\(\ce{R}\) група або карбонільна сполука сильно розгалужена. Наприклад, ізопропілітій додає з хорошим виходом до 2,4-диметил-3-пентанону, тоді як бромід ізопропілмагнію повністю не дає нормального продукту додавання:

Неможливість додавання реагентів Гріньяра звичайним способом, як правило, полягає в тому, що реакції альтернативними шляхами відбуваються швидше. Якщо реагент Гріньяра має водень на вуглеці, що примикає до місця прикріплення\(\ce{-MgX}\) (тобто\(\beta\) водню), то може відбуватися відновлення, з ефектом додавання\(\ce{H_2}\) до карбонільної групи.
Побічні реакції - зниження

Крім того, якщо карбонільна сполука має водень, розташований на вуглеці поруч з карбонільною групою, реагент Гріньяра може поводитися як основа і видаляти цей водень як протон. Результатом є те, що з'єднання стає енолатной сіллю і\(\ce{RMgX}\) стає\(\ce{RH}\).
Побічні реакції - енолізація

Мабуть, ускладнюючі побічні реакції, що\(\ce{RMgX}\) спостерігаються з, не настільки важливі с\(\ce{RLi}\). Причини такої різниці недостатньо вивчені.
Синтез карбонових кислот
Реакція вуглекислого газу з реагентами Гріньяра спочатку дає магнієву сіль карбонової кислоти,\(\ce{RCO_2MgX}\):
Ця сіль, яка має карбонільну групу, в принципі могла б додати секунду\(\ce{RMgX}\). Однак подальше додавання зазвичай відбувається повільно, і для більшості практичних цілей реакція припиняється на цьому етапі. Якщо реакція може піти далі, найгірший спосіб її запустити - це бульбашка\(\ce{CO_2}\) в розчин Гріньяра. Це піддає першоутвореного\(\ce{RCO_2MgX}\) надлишку\(\ce{RMgX}\) і може призвести до подальших реакцій приєднання. Найпростіший спосіб уникнути цієї проблеми - вилити\(\ce{RMgX}\) розчин на порошкоподібний сухий лід (твердий\(\ce{CO_2}\)). Гідроліз продукту (тут більш сильна кислота, ніж потрібно)\(\ce{NH_4Cl}\) утворює карбонова кислота,\(\ce{RCO_2H}\):

Синтез кетонів
Хоча органомагнієві сполуки недостатньо реактивні для додавання до карбоксилатних аніонів, алкілітієві сполуки додають досить добре. Корисний синтез метилкетонів передбачає додавання метилітію до солі літію карбонової кислоти:

Інші методи починаються з хлоридів кислот або ефірів і намагаються додати тільки один моль\(\ce{RMgX}\):

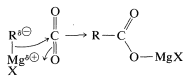
Недоліком використання реагентів Гріньяра для цієї мети є те, що вони дуже швидко додаються до кетону в міру його утворення. Існує два способи, за допомогою яких цей недолік можна звести до мінімуму. По-перше, можна додати розчин Гріньяра до надлишку розчину хлориду кислоти (так звана процедура «зворотного додавання»), щоб зберегти концентрацію\(\ce{RMgX}\) в реакційній суміші низькою, і сподіватися, що реакція припиниться на кетоновій стадії. Однак цей пристрій рідко дуже добре працює з хлоридами кислот. Кращі результати можна отримати за допомогою\(\ce{RMgX}\) і\(\ce{R'CON(CH_3)_2}\). Другий спосіб полягає у використанні менш реактивного металоорганічного з'єднання - такого, який буде реагувати з,\(\ce{RCOCl}\) але не з\(\ce{R_2C=O}\). Одним з простих способів зробити це є додавання хлориду кадмію в розчин Гріньяра, в результаті чого утворюється органокадмієве з'єднання (див. Розділ 14-10B, Спосіб 3).\(\ce{R_2Cd}\) У присутності галогенідів магнію помірно швидко\(\ce{R_2Cd}\) реагує з хлоридами кислот, але лише повільно з кетонами. Тому додавання може бути заарештовано на кетоновій стадії:
\[2 \ce{RMgCl} + \ce{CdCl_2} \rightarrow \ce{R_2Cd} + 2 \ce{MgCl_2}\]
Алкілмідні сполуки\(\ce{R-Cu}\), також є селективними реагентами, які реагують з хлоридами кислот, щоб дати кетони, але не додають до ефірів, кислот, альдегідів або кетонів. \(\ce{R-Cu}\)З'єднання можна приготувати з\(\ce{CuI}\) і алкілітію. При надлишку алкілітію алкілмідь перетворюється в\(\ce{R_2CuLi}\):

1,4 Доповнення до ненасичених карбонільних сполук
Кон'югований алкенон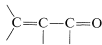 , може вступати в реакцію з металоорганічним реагентом шляхом нормального додавання 1,2 по всій карбонільній групі, або 1,4 додавання в кон'юговану систему.
, може вступати в реакцію з металоорганічним реагентом шляхом нормального додавання 1,2 по всій карбонільній групі, або 1,4 додавання в кон'юговану систему.
1,4 додавання

При гідролізі 1,4 аддукт спочатку дає відповідний енол, але це нормально нестабільно і швидко перебудовується на кетон. Таким чином, кінцевий продукт відповідає додаванню\(\ce{R-H}\) подвійного зв'язку вуглецево-вуглецевого:

Органомагнієві і органолітієві сполуки можуть додавати як 1,2, так і 1,4 в алкенони, причому відносна важливість кожного способу додавання залежить від структури реагентів. Така подвійна поведінка може бути неприємністю в синтетичній роботі, оскільки це призводить до проблем розділення та низької врожайності. Мідні органомідні сполуки є великою підмогою в цій ситуації, оскільки вони виявляють дуже високу селективність для додавання 1,4 і додають до ненасичених кетонів у відмінному виході:

Кисень, сірка та галогени
Реагенти Гриньяра вступають в реакцію з киснем, сіркою і галогенами з утворенням речовин\(\ce{C-O}\), що містять\(\ce{C-S}\), і\(\ce{C-X}\) зв'язків, відповідно:

Ці реакції не часто важливі для синтезу, оскільки продукти,, і\(\ce{ROH}\)\(\ce{RSH}\)\(\ce{RX}\), можуть бути отримані більш зручно і безпосередньо з алкілгалогенідів шляхом\(S_\text{N}1\) і реакцій\(S_\text{N}2\) витіснення, як описано в розділі 8. Однак, коли обидві\(S_\text{N}1\)\(S_\text{N}2\) реакції повільні або іншим чином непрактичні, що стосується похідних неопентилу, реакції Гріньяра можуть бути дуже корисними:

Також оксигенація реагенту Гріньяра при низьких температурах забезпечує відмінний метод синтезу гідропероксидів:

Для запобігання утворенню надмірної кількості спирту бажано зворотне додавання (тобто до ефіру додають розчин реагенту Гріньяра, через який кисень пузириться, а не кисень через розчин реагенту Гріньяра).
Таблиця 14-5: Способи отримання органічних галогенідів


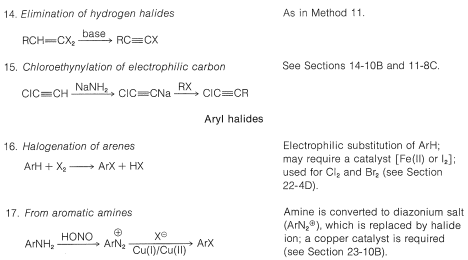
Таблиця 14-6: Реактивність галогенорганічних сполук у реакціях витіснення та елімінації

Таблиця 14-7: Способи отримання металоорганічних сполук

\(^2\)Неможливо додати\(\ce{RH}\) безпосередньо, оскільки\(\Delta G^0\) загалом є дещо несприятливим [\(+5 \: \text{kcal}\)для\(\ce{CH_4} + \ce{(CH_3)_2C=O} \rightarrow \ce{(CH_3)_3COH}\)]. Те, як ми обійти цю несприятливу рівновагу на практиці, дає цікавий приклад того, як енергія може бути (і є) витрачена для досягнення певного бажаного результату; наприклад, реакція\(\ce{CH_3CH_3} + \ce{CH_3CHO} \rightarrow \ce{CH_3CH_3CH(CH_3)OH}\) має\(\Delta H^0 = -12 \: \text{kcal}\) але\(\Delta G^0 = + 0.5 \: \text{kcal}\). Можлива послідовність
безпосередньо, оскільки\(\Delta G^0\) загалом є дещо несприятливим [\(+5 \: \text{kcal}\)для\(\ce{CH_4} + \ce{(CH_3)_2C=O} \rightarrow \ce{(CH_3)_3COH}\)]. Те, як ми обійти цю несприятливу рівновагу на практиці, дає цікавий приклад того, як енергія може бути (і є) витрачена для досягнення певного бажаного результату; наприклад, реакція\(\ce{CH_3CH_3} + \ce{CH_3CHO} \rightarrow \ce{CH_3CH_3CH(CH_3)OH}\) має\(\Delta H^0 = -12 \: \text{kcal}\) але\(\Delta G^0 = + 0.5 \: \text{kcal}\). Можлива послідовність

Загальний результат - це витрати на\(10 + 76 + 71 = 157 \: \text{kcal}\) досягнення реакції, яка сама по собі має\(\Delta H^0 = -12 \: \text{kcal}\), але несприятлива\(\Delta G^0\). (\(\ce{Li}\)використовується в цьому прикладі, а не\(\ce{Mg}\) тому, що теплота утворення\(\ce{C_2H_5MgBr}\) недоступна.)
