14.11: Отримання металоорганічних сполук
- Page ID
- 106281
Метали з органічними галогенідами
Реакція металу з органічним галогенідом є зручним методом отримання металоорганічних сполук розумно активних металів, таких як літій, магній, цинк. Ефіри, зокрема діетиловий ефір та оксациклопентан (тетрагідрофуран), забезпечують інертні, слабополярні середовища, в яких зазвичай розчинні металоорганічні сполуки. Необхідна обережність, щоб виключити вологу, кисень і вуглекислий газ, які б вступали в реакцію з металоорганічною сполукою. Це може бути досягнуто за допомогою інертної атмосфери азоту або гелію.

Порядок реактивності галогенідів становить\(\ce{I} \: > \: \ce{Br} \: > \: \ce{Cl} \: \gg \ce{F}\). Тоді як магній і літій добре реагують з хлоридами, бромідами та йодидами, цинк є задовільним лише з бромідами та йодидами. Ртуть реагує лише при з'єднанні з натрієм. Натрій і калій представляють особливі проблеми через високу реакційну здатність алкілнатрієвих і алкілкалієвих сполук до ефіру та органічних галогенідів. Зазвичай необхідні алканові розчинники.
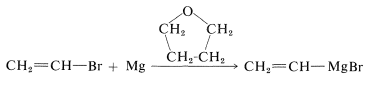
Алкеніл, алкініл та аріл галогеніди, як алкілгалогеніди, можуть бути перетворені у відповідні сполуки магнію та літію. Однак умови реакції, такі як вибір розчинника, можуть бути критичними. Наприклад, брометен може бути перетворений на бромід етенилмагнію з хорошим виходом, якщо розчинником є оксациклопентан [тетрагідрофуран,\(\ce{(CH_2)_4O}\)]:
Більш реактивні аллілові та бензилові галогеніди представляють проблему - не стільки в утворенні металоорганічної похідної, скільки в тому, щоб утримувати його від подальшої реакції з початковим галогенідом. Часто небажаною побічною реакцією при отриманні металоорганічних сполук є реакція зміщення, ймовірно,\(S_\text{N}2\) типу:
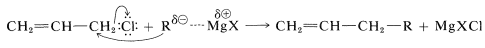
Цю проблему можна значно зменшити, використовуючи великий надлишок магнію та розбавлені розчини галогеніду аллілу, щоб мінімізувати реакцію зчеплення.
Така ж складність виникає і при приготуванні алкілнатрієвих сполук. Стартовий галогенід\(\ce{RX}\) пари з\(\ce{RNa}\) (дати\(\ce{R-R}\) і\(\ce{NaX}\)) або перетворюється на алкен. Ці реакції, як видається, включають радикальні проміжні продукти, які проходять комбінацію та диспропорцію (Розділ 10-8C):

За відсутності металевого натрію етилнатрій, ймовірно, все ще реагує з бромідом етилу радикальною реакцією, а не\(S_\text{N}2\) або\(E2\). Це відбувається тому, що\(\ce{CH_3CH_2^-}\) має тенденцію легко втрачати електрон і може діяти як металевий натрій, щоб пожертвувати електрон,\(\ce{CH_3CH_2Br}\) щоб сформувати етиловий радикал і сам стати етиловим радикалом:

Реакції між одержаними радикалами потім виробляють бутан, етан та етен.
Точка, в якій можна очікувати\(S_\text{N}2\) і\(E2\) реакції йдуть швидше, ніж радикальне утворення, оскільки структури галогенідів і характер металу змінюються, ще не чітко визначена. Однак стає все більш очевидним, що існують реакції заміщення «неактивованих» арилогалогенідів, які протікають без перестановки шляхом радикальних проміжних продуктів. Ключовим етапом цих реакцій є донорство електрона на одну з незаповнених\(\pi\) орбіталей кільця і подальший викид галогенідного іона:

Такий механізм, ймовірно, бере участь в утворенні металоорганічних сполук з арілгалогенідів і металів.
Деякі інші препарати металоорганічних сполук
Короткі описи слідують менш загальним, але дуже корисним методам формування металоорганічних сполук (див. також таблицю 14-7). У кожному з цих препаратів розчинник повинен бути інертним до всіх задіяних металоорганічних сполук.
Галогенно-металургійний обмін
\[\ce{RBr} + \ce{R'Li} \rightleftharpoons \ce{RLi} + \ce{R'Br}\]
Рівновага в цих реакціях сприяє утворенню металоорганічної сполуки з металом, приєднаним до більш електронегативної\(\ce{R}\) групи. Метод в основному використовується при отриманні органолітієвих сполук, отриманих з нереактивних галогенідів, таких як арил, етенил або етинілгалогеніди. Ці галогеніди не завжди легко реагують з металом літію, але можуть добре реагувати з бутилітієм:

Зсув одного металу іншим
\[\ce{R_2Hg} + 2 \ce{Na} \rightleftharpoons 2 \ce{RNa} + \ce{Hg}\]
Тут рівновага така, що\(\ce{R}\) група сприяє приєднанню до більш електропозитивного металу.
Металоорганічні сполуки з галогенідами металів
\[\ce{RMgCl} + \ce{HgCl_2} \rightleftharpoons \ce{RHgCl} + \ce{MgCl_2}\]
\[\ce{RLi} + \ce{CuI} \rightleftharpoons \ce{RCu} + \ce{LiI}\]
Рівновага сприяє продуктам,\(\ce{R}\) підключеним до менш електропозитивного металу, тому реакція має тенденцію утворювати менш реактивну металоорганічну сполуку з більш реактивної.
Металеорганічні сполуки з кислих вуглеводнів
Деякі металоорганічні сполуки найкраще отримують реакцією міцної основи або похідного алкільного металу з кислим вуглеводнем, таким як алкін:

Особливо важливим прикладом є 1,3-циклопентадієн, який є кислим, оскільки його кон'югатна основа (ціклопентадієнід аніон) значно стабілізується за допомогою електронної делокалізації. Аніон легко утворюється з вуглеводню і метилітію:

Металоорганічні сполуки з полігалогенних сполук
Діорганометалічні сполуки не можуть бути отримані з дигалогенів, якщо галогени розділені трьома\(\ce{C-C}\) зв'язками або менше, оскільки зазвичай переважають елімінація або інші реакції. З активними металами і 1,1-, 1,2-, або 1,3-дигалогенідами в нормі відбуваються такі реакції:

Коли галогени складають принаймні чотири вуглеці один від одного, може утворитися діорганометалічна сполука:

Карбени,\(\ce{R_2C} :\) (Розділ 14-7B) отримують шляхом\(\alpha\) елімінації з полігалогенних сполук з металоорганічними реагентами. Першим кроком є галоген-металообмін, після чого слід ліквідація галогенідів металів:

Реакції елімінації цього типу можуть бути корисні в синтезі для утворення вуглецево-вуглецевих зв'язків. Наприклад, якщо дибромокарбене генерується в присутності алкену, він буде реагувати циклододаванням, щоб дати похідне циклопропану:

Пов'язаним прикладом є генерація бензину з 1-бром-2-фторбензолу з магнієм в оксациклопентані (тетрагідрофурані). Якщо температура тримається навколо\(0^\text{o}\), утворюється 2-фторфенілмагнію бромід. При більш високих температурах галогенід магнію усувається і бензин призводить:

Якщо дієн присутній, бензин реагуватиме з ним циклододаванням [4 + 2], як у наступному прикладі:

